 产业资讯
产业资讯
 识林
识林  2023-12-26
2023-12-26
 1482
1482
近年来,日本发生了多起非法制药事件。一些制药企业GMP合规性不足和缺乏质量文化被认为是此类案件的根本原因。本文研究进行了一项广泛的问卷调查,以了解日本制药企业与知识管理和培养质量文化相关的问题。根据395份问卷调查,发现制药企业虽然了解知识管理和质量文化的重要性,但在操作方法上存在问题。共有94%的受访者同意他们提到“知识管理”是ICH Q10药品质量体系的推动者,98%的受访者承认质量文化培养不足会导致企业风险。然而,调查显示,许多企业都在为这种方法而苦苦挣扎。
材料和方法
此次问卷调查的对象为在日本拥有上市许可持有人许可证或药品生产许可证的国内制药企业,包括日本药品生产商协会联合会成员(按业务类型划分的 15 家组织和按地区划分的 16 家组织),以及日本原料药生产商协会成员(截至 2021 年 9 月有 102 家企业)。通过日本药品生产商协会联合会于 2021 年 9 月 13 日至 10 月 18 日期间进行调查。
问卷调查包括受访者基本信息、知识管理、质量文化三部分。第一部分,基本信息,包括受访企业的背景信息等基本数据,如受访企业的职称、企业的业务类型等。第二部分包括对知识管理的理解、技术转移的文档管理(这在知识管理中很重要)、实施知识管理的挑战以及知识管理运作的成功/失败案例等问题。第三部分提出了质量文化的“理想状态”、培养质量文化的举措以及质量文化对企业的影响。答案系统包括选择格式、单个答案或多个答案以及评论描述格式。
问卷调查结果
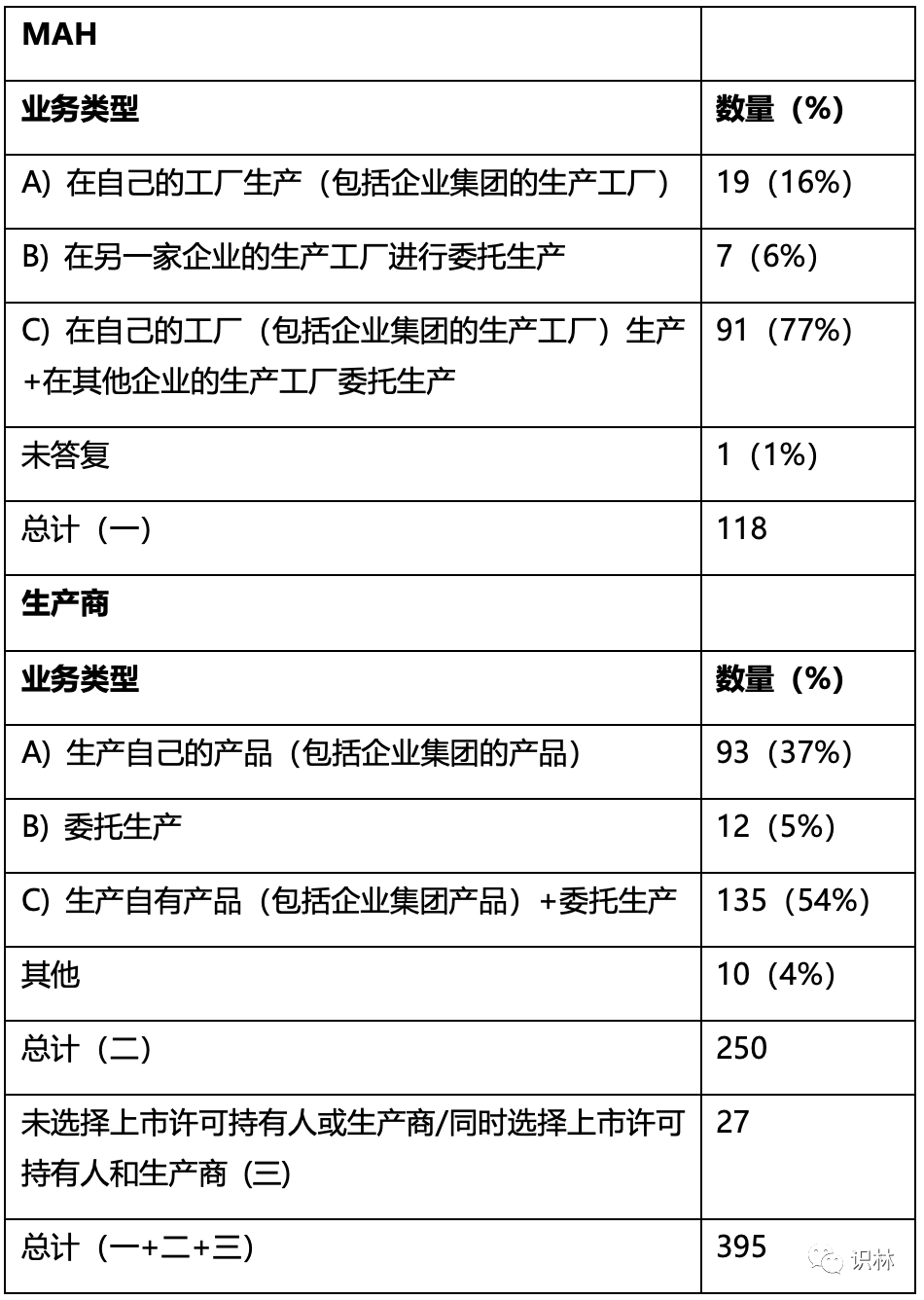
表1. 上市许可持有人(MAH)和生产商的业务类型
受访者被问及是否知道 ICH Q10 药品质量体系指南将“知识管理”称为实现 ICH Q10“药品质量体系”的过程。如图1所示,在 395 份回复中,94%(373 份回复)的受访者回答“是”。
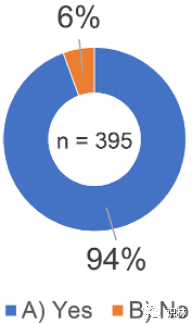
图1. 关于ICH Q10指南和知识管理的调查结果
受访者被问及共享知识的范围是否存在差异,具体取决于技术转移目的地/来源是他们自己的企业还是参与合同生产的另一家企业。根据上市许可持有人和生产商的基本数据分析了 226 份回复。在 226 份回复中,上市许可持有人的 91 份回复为“C) 在自己的工厂(包括企业集团的生产工厂)生产+在其他企业的生产工厂委托生产”,来自生产商的 135 份回复为“C) 生产自有产品(包括企业集团产品)+委托生产”(表1)。如图 2 所示,54% 的上市许可持有人(91 名受访者)回答说,自己企业与其他企业在生产方面共享知识的范围“相同”,而 34% 的生产商(135 名受访者)回答“相同”。尽管 22% 的生产商没有给出答案,但总体结果表明,分享知识的人和接受知识的人对共享知识的范围的认识存在差异。
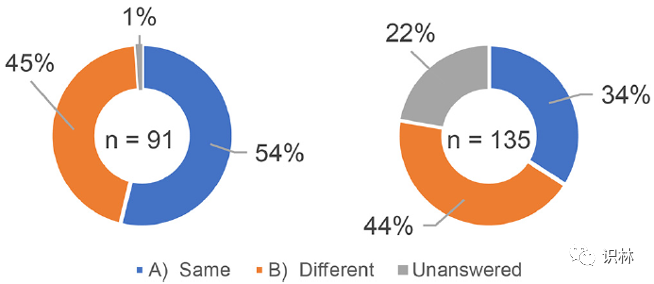
图2. 关于共享知识范围的调查结果
研究调查了在研发过程中获得的信息(对应于知识)是否在技术转移时由执行合同生产的生产商和执行委托生产的上市许可持有人共享;基础数据调查结果分别如图3和图4所示。图 3 中的目标受访者是表1中的生产商 B)委托生产(12 个答复)和 C)生产自有产品(包括企业集团产品)+委托生产(135 个答复),共147 个答复。图 4 中的目标受访者是表1中的上市许可持有人 B)在另一家企业的生产工厂进行委托生产(7 个答复)和 C)在自己的工厂(包括企业集团的生产工厂)生产+在其他企业的生产工厂委托生产(91 个答复),共98个答复。虽然图 3 和图 4 中 A) - C)的比例没有显著差异,但结果表明在研发过程中获得的知识尚未得到充分共享。此外,在图 3 中,大约 70% 的受访者回答 B) 共享,但不是全部或 C) 不积极共享,他们表示:“我们遇到了问题,因为我们在研发过程中技术转移时没有获得足够的信息(对应于知识)。”
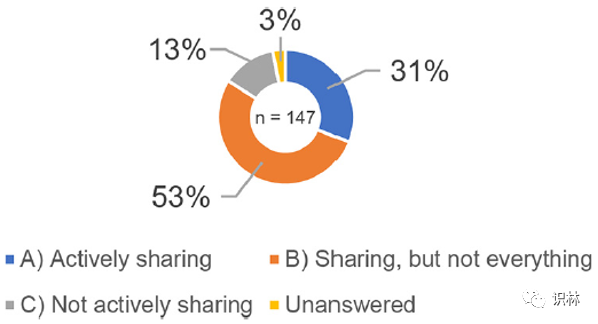
图3. 生产商研发期间技术转移时获得的信息共享调查结果
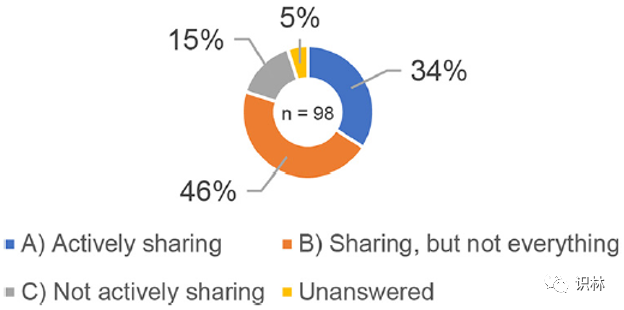
图4. MAH研发期间技术转移时获得的信息共享调查结果
此外,研究询问生产商是否已与研发部门和委托人共享在商业生产中获得的产品知识,分析了生产商的 250 个答复,大约 26% 的人回答没有知识反馈(图 5)。
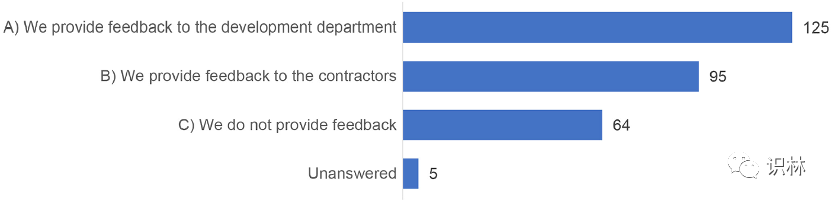
图5. 商业生产过程中获得的知识反馈的调查结果
将隐性知识转换为显性知识对于在组织内共享知识非常重要。隐性知识是“基于经验和直觉的、不能轻易用语言表达的知识”,而显性知识是“主要通过句子、图表和数学表达式来解释和表达的知识”。除了分析所有 395 个回复之外,研究还对图 6 中的每个上市许可持有人(118 个回复)和生产商(250 个回复)进行了评估。图 6 显示了个人隐性知识是否已转化为显性知识的调查结果;62%的受访者回答“否”,表明只有少数企业将隐性知识转化为显性知识。此外,根据基础数据对上市许可持有人和生产商的结果进行分析发现,生产商将隐性知识转化为显性知识的比例比上市许可持有人高出20%。
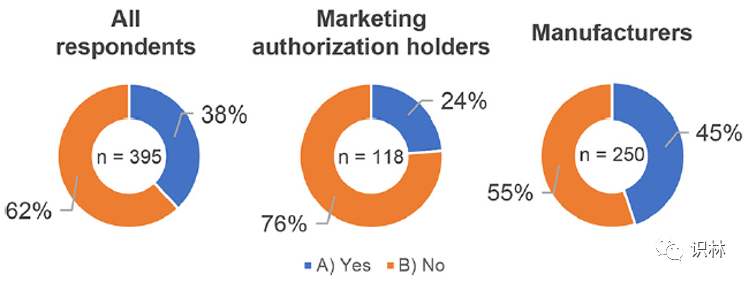
图6. 关于隐性知识和显性知识的调查结果
图7展示了培养质量文化的“理想状态”的调查结果,分析了所有 395 份回复。这个问题允许有多个答案。回答“B)有明确指挥系统的组织管理体系”和“E)药品供应稳定”的受访者比例低于选择其他答案的受访者。
研究在旨在实现培养质量文化的“理想状态”中发现了人力资源和/或时间资源方面的问题(图8),分析了所有 395 份回复。这个问题允许有多个答案。
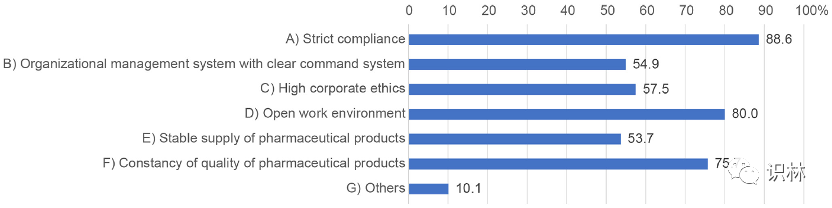
图7. 关于培养质量文化的“理想状态”的调查结果
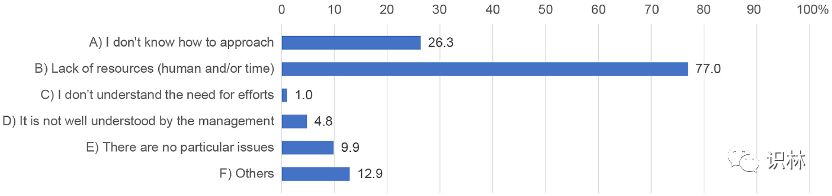
图8. 关于实现培养质量文化的“理想状态”问题的调查结果
由于培养质量文化是有效 PQS 的前提,正如最近的非法生产案例所表明的那样,研究了制药企业对培养质量文化和 PQS 的看法。研究发现,90% 的受访者(354 名受访者)回答说,仅仅遵循 PQS 的法律和准则无法培养质量文化(图 9)。图 10 显示了他们认为培养质量文化必要条件的调查结果。研究分析了图 9 中 354 个“否”的回答,并提取了其中 20 个(包括负责人的回答)进行比较。结果显示,除“I) 自下而上方法”之外,其他答案存在显著差异(约 8%–24%)。在培养质量文化所需的项目中,“C)高道德观”、“D)企业内部合规培训”、“E)工作环境的改善”、“F)适当的人员评价体系”、“G)企业管理者的意识”表明管理层和员工之间的意识至少有15%的差异。在这两项结果中,员工的意识均高于管理层。
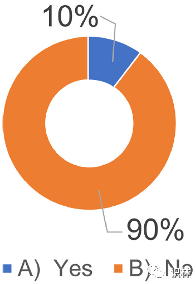
图9. 关于制药企业对质量文化和 PQS 培养的看法的调查结果
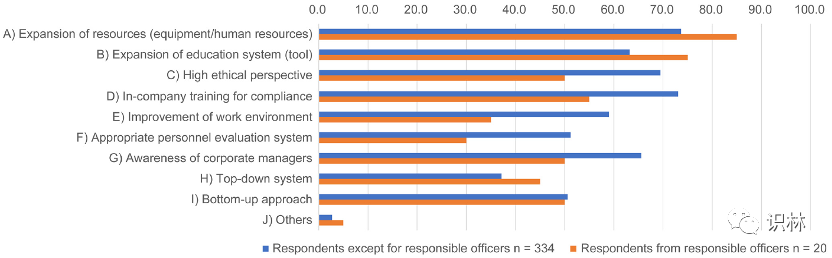
图10. 关于培养质量文化所需因素的调查结果
研究对质量文化培养不足的企业风险进行了调查,分析了该问题的所有 395 条回复。在受访者中,98%(388 名受访者)回答质量文化培养不足会引发企业风险(图 11)。对回答“是”的 98%(388 名受访者)进行了分析,如图 11 所示,其中 23 名是负责人。进行比较是为了澄清负责人(23人)和其他受访者(365人)的看法差异。对 365 份回复的分析显示,88.7%、81.2% 和 86.6% 的受访者分别选择“D)产品质量恶化”、“E)发生不当行为”和“F)隐瞒不当行为和偏差”作为企业风险,而 49.2%、52.3% 和 58.0% 的人分别选择“B) 企业业绩下降”、“C) 离职率上升”和“G) 对可用性的影响”(图 12)。此外,研究还比较了包括负责人在内的 23 份答复,结果显示,在“B)企业业绩下降”、“D)产品质量恶化”和“E)发生不当行为”方面,存在显著差异(约 12% 至 17%)。
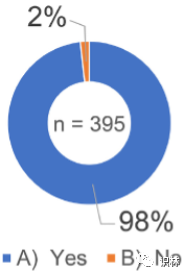
图11. 关于质量文化和企业风险的调查结果
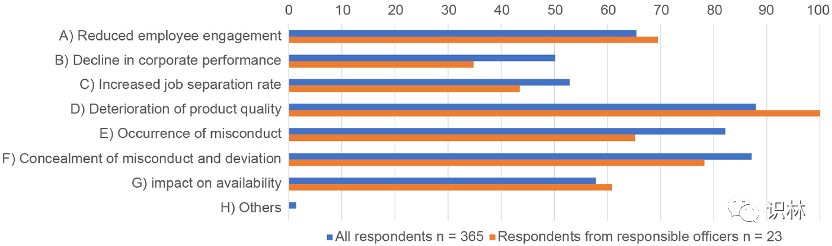
图12. 不良质量文化将引发的企业风险调查结果
结论
本研究根据问卷调查的结果,阐明了日本制药企业知识管理和质量文化培养的现状和问题。“优质药品的供应”问题应该由制药企业解决。非法生产的药品造成的质量问题会给患者的健康带来损害,而隐瞒非法生产的行政处罚则可能导致药品短缺,对人民群众的身体健康产生重大影响。因此,药品质量下降会产生不可逆转的后果。此外,社会强烈要求制药企业具有高度的道德观,因为它们生产与生命相关的产品,并培养根深蒂固的质量文化,而不是表面上的合规。
参考文献:
Takahashi S, Takarada T, Ito K, Shikano M, Sakurai S. Quality Culture and Knowledge Management in the Japanese Pharmaceutical Industry-A Cross-Sectional Study and Case Report. PDA J Pharm Sci Technol. 2023 Sep-Oct;77(5):350-375. doi: 10.5731/pdajpst.2022.012797. Epub 2023 Jun 15. PMID: 37321863.

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-01
2025-05-01
 4
4

 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-01
2025-05-01
 5
5

 产业资讯
产业资讯
 药渡Daily
药渡Daily  2025-05-01
2025-05-01
 4
4