 产业资讯
产业资讯
 火石创造
火石创造  2024-01-11
2024-01-11
 2189
2189
引言
2023年,全球批准新药数量随区域变化较大。FDA共完成750项药品首次批准(不包含暂时批准,不包含撤市产品),与往年基本持平,其中批准127款新药(NDA/BLA),包含37款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),28款生物制品药物(BLA)。EMA共授权55款药品上市,同比22年减少了43%,其中包含17款新活性物质药。
NMPA于2023年批准创新药51个品规(41个品种)上市,按品规计,创新药获批同比2022年上升70%。其中27个品规(20个品种)化药、18个品规(15个品种)生物制品和6个品规(6个品种)中药。仿制药一致性评价工作持续稳步推行,2023年过评2104个品规,其中注射剂占比约50%。
01 美国FDA批准情况
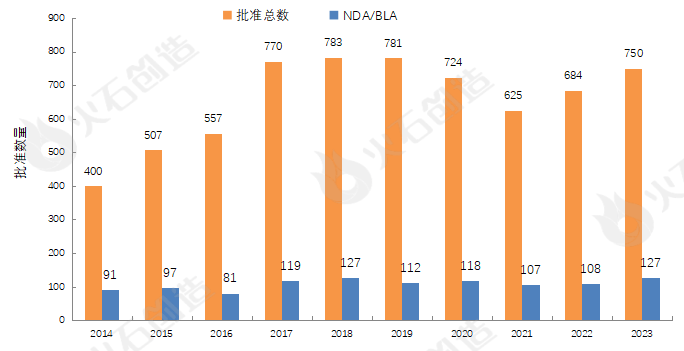
图1 2014—2023年FDA药物批准数量变化情况 来源:火石创造产业数据中心
如图1,截至2024年1月9日FDA官网披露,2023年FDA共完成750项药品首次批准(不包含暂时批准,不包含撤市产品),其中NDA/BLA批准127款(不包含暂时批准,不包含撤市产品)。其中包括37款新获批的新分子实体药物(NDA:Type 1 - New Molecular Entity),见表1,28款生物制品药物(BLA)。
表1 2023年FDA批准新分子实体药物
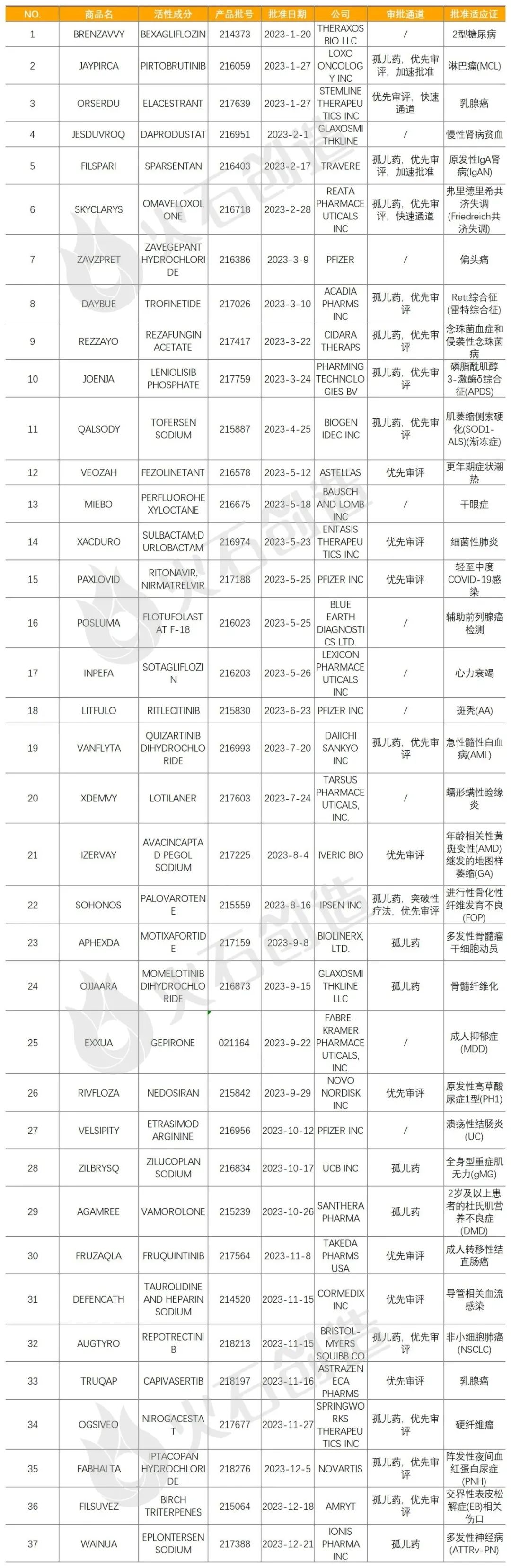
来源:火石创造产业数据中心
02 欧盟EMA批准情况
截至2024年1月9日EMA官网披露,2014年至2023年的推荐上市药品及推荐上市新活性物质(NAS)数量情况见图2。
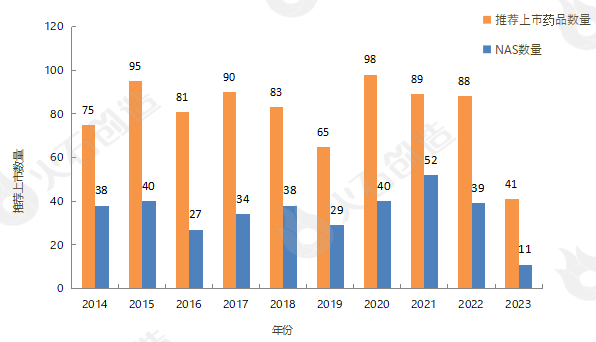
图2 2014—2023年EMA推荐上市药品数量变化情况 来源:火石创造产业数据中心
截至2024年1月9日,2023年EMA共授权55款药品上市,研发企业中,Accord Healthcare S.L.U.和Viatris Limited获授权上市药品最多,均有3款药品,AbbVie、Amicus、AstraZeneca、Bristol-Myers Squibb、Eli Lilly、Extrovis、Janssen-Cilag、Pfizer、Sandoz九家药企各有2款药品上市,位列第二梯队。其中授权17款新活性物质药,详细情况如列表2。
表2 2023年EMA授权上市的新活性物质药物列表
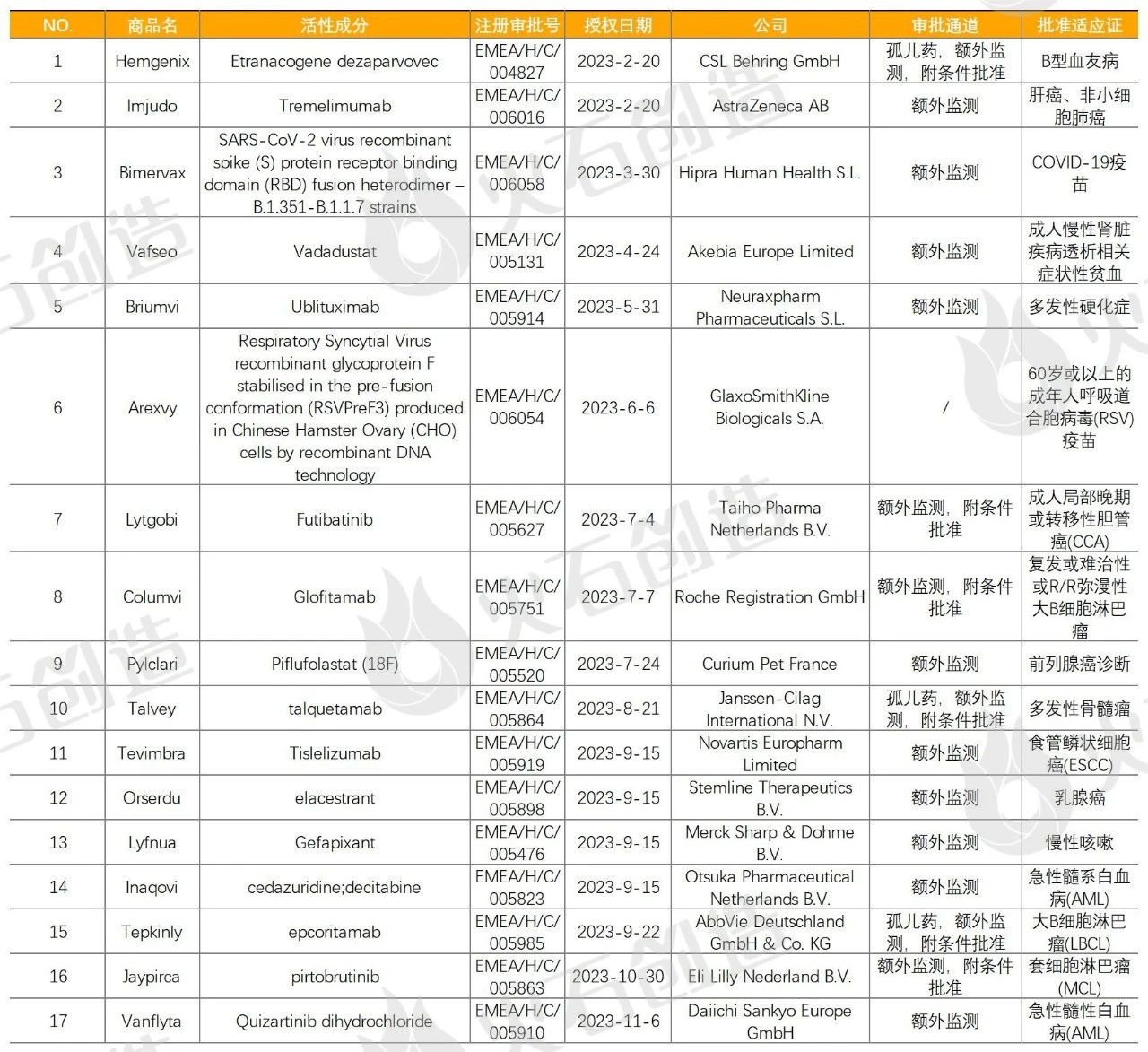
来源:火石创造产业数据中心
03 NMPA批准情况
截至2024年1月9日NMPA披露,2023年共批准国产首次注册药品1812件。按剂型去重后,共592个药品品种(不同厂家生产同一药物按同一品种计算),共51个品规(41个品种)1类创新药获批上市,包含27个品规(20个品种)化药、18个品规(15个品种)生物制品和6个品规(6个品种)中药。
按品规计,创新药获批同比2022年上升70.00%。2023年NMPA批准的1类创新药情况见表3。2023年上市创新药涉及企业37家,其中获批最多的企业为浙江我武生物科技股份有限公司,上市了3个品种创新药,分别为白桦花粉变应原皮肤点刺液、黄花蒿花粉变应原皮肤点刺液和葎草花粉变应原皮肤点刺液。3款均为皮肤点刺系列诊断产品,用于皮肤点刺试验,辅助诊断与相关花粉致敏引起的I型变态反应性疾病。
该类产品与浙江我武公司已上市的“粉尘螨皮肤点刺诊断试剂盒”(国药准字S20080010)、“屋尘螨皮肤点刺诊断试剂盒”(国药准字S20190022)产品互为补充,可以满足更多过敏性疾病患者的过敏原检测需求。
贝达药业股份有限公司于2023年获批上市了2个品种化药创新药,分别为甲磺酸贝福替尼胶囊和伏罗尼布片。其5月底获批上市的甲磺酸贝福替尼胶囊,是贝达药业第5款获批上市的创新药,为第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),用于局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗,2018年12月,贝达与益方生物达成合作,获得贝福替尼在中国大陆、香港和台湾地区的权益,并可独家在合作区域内进行该产品的开发及商业化;2023年6月7日,再获批上市一款用于治疗晚期肾细胞癌(RCC)的化药伏罗尼布片,是具有全新化学结构的新一代多靶点激酶抑制剂,2017年,贝达药业通过全资子公司卡南吉医药科技(上海)有限公司取得伏罗尼布全部适应症的中国权益,其后,又通过控股子公司Xcovery Holdings, Inc.取得伏罗尼布肿瘤适应症的海外权益,2018年,贝达通过控股子公司Equinox取得伏罗尼布眼科适应症的海外权益。2023年NMPA共批准上市6个品种中药创新药,分别为6月获批的广东思济药业参郁宁神片,10月获批的江西青峰药业枳实总黄酮提取物/枳实总黄酮片、以岭药业通络明目胶囊、健民药业小儿紫贝宣肺糖浆,以及11月获批的台湾合一生技公司香雷糖足膏。
除这些1类创新药外,NMPA还于2023年7月27日公告批准第二个按古代经典名方目录管理的中药复方制剂(即中药3.1类新药)枇杷清肺颗粒上市(首个为2022年12月27日上市的康缘药业苓桂术甘颗粒),该药品处方来源于清·吴谦等《医宗金鉴》,已列入《古代经典名方目录(第一批)》,药品上市许可持有人为吉林敖东洮南药业股份有限公司。2023年11月17日,NMPA公告批准了济川药业集团有限公司申报的中药2.2类改良型新药小儿豉翘清热糖浆上市,该品种为儿童用药,剂型改良后顺应性明显提高,用于小儿风热感冒夹滞证。NMPA在2023年批准了4个品种用于治疗轻中度新型冠状病毒感染(COVID-19)成年患者的国产创新药上市,分别为先声药业的先诺特韦片/利托那韦片组合包装、旺实生物的氢溴酸氘瑞米德韦片、广东众生睿创生物的来瑞特韦片和福建广生中霖生物的阿泰特韦片/利托那韦片组合包装。4款药品均通过特别审批程序,附条件批准上市,后续需继续开展相关研究工作,限期完成附条件的要求。
表3 2023年NMPA批准的1类创新药获批列表
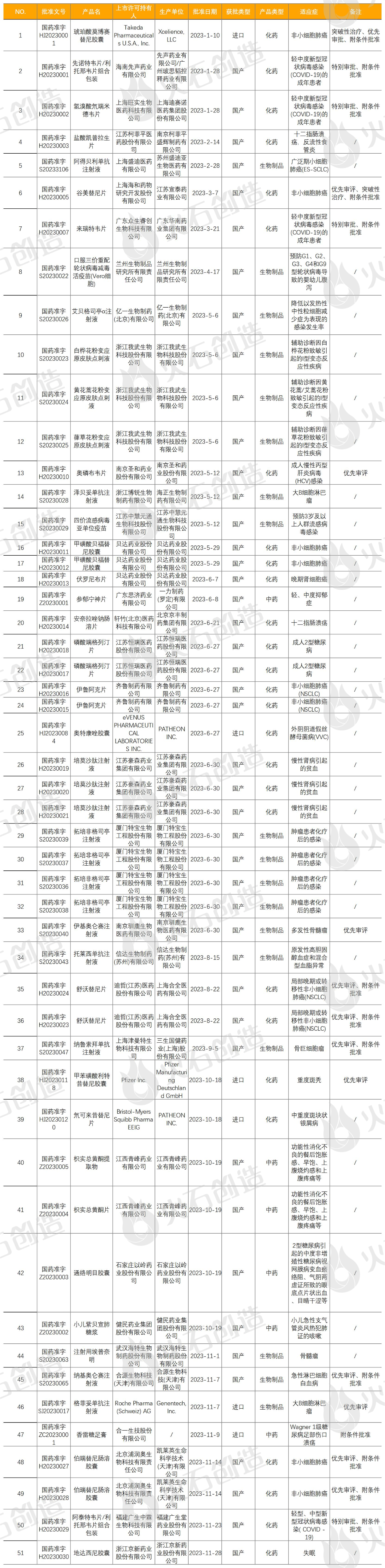
来源:火石创造产业数据中心
从地域分布上,2023年获批创新药企业最多的依次为江苏省(8家企业,持8个品种药品)、浙江省(4家企业,持7个品种药品)/上海市(4家企业,持4个品种药品)、北京市(3家企业,持3个品种药品)几个区域,见图3。
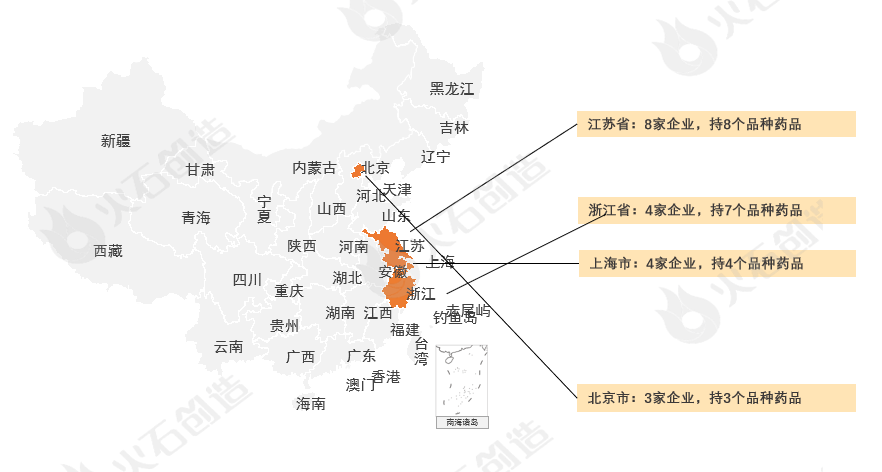
图3 2023年获批创新药区域分布 来源:火石创造产业数据中心
04 仿制药一致性评价情况
截至2024年1月9日CDE官网披露,CDE共承办药品一致性评价受理号5423个,2023年共新增承办1006个受理号。截至2024年1月9日,共7366个品规上市药品通过一致性评价(包含视同通过3620个品规),2023年共2104个品规的药品通过一致性评价(包含视同通过1275个品规),按剂型去重后,共608个药品品种。
目前一致性评价品种通过的注射剂共3037个品规(346个品种),2023年过评药品中共计1062个品规(234个品种)的注射剂。2018年至2023年通过一致性评价数量见图4。
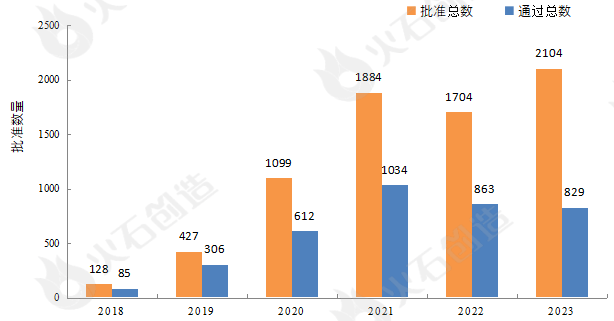
图4 2018年至2023年仿制药一致性评价批准数量变化情况 来源:火石创造产业数据中心

 产业资讯
产业资讯
 同写意
同写意  2025-10-01
2025-10-01
 40
40

 产业资讯
产业资讯
 辰小飞的log
辰小飞的log  2025-10-01
2025-10-01
 48
48

 产业资讯
产业资讯
 研发客
研发客  2025-10-01
2025-10-01
 42
42