 产业资讯
产业资讯
 药明康德
药明康德  2024-01-31
2024-01-31
 1361
1361
Ascidian Therapeutics今日宣布在研RNA外显子编辑疗法ACDN-01的IND申请已经获得美国FDA的许可,并被授予快速通道资格。新闻稿指出,ACDN-01是首个获美国FDA许可进入临床试验的RNA外显子编辑疗法,并且是首款专门针对Stargardt病遗传起源的临床期治疗方法。Ascidian预计在2024年上半年开始招募参与ACDN-01针对Stargardt病及其他ABCA4相关视网膜病变的1/2期临床试验STELLAR的患者。
ACDN-01是一种在体内编辑RNA外显子的RNA编辑疗法。它通过单一载体递送,已在非人类灵长类动物的体内实验以及人类视网膜的体外实验中显示出有效且持久的RNA外显子编辑。与其它只修改一个RNA碱基的RNA编辑器不同,ACDN-01的独特之处在于能够重新书写RNA序列,将导致疾病的RNA序列替换为功能正常的RNA序列,具有使用一种疗法,治疗多种基因突变导致的Stargardt病的潜力。
此外,RNA编辑疗法与基于CRISPR的基因组编辑疗法相比,由于不会对基因组序列产生永久影响,可能具有更高的安全性。
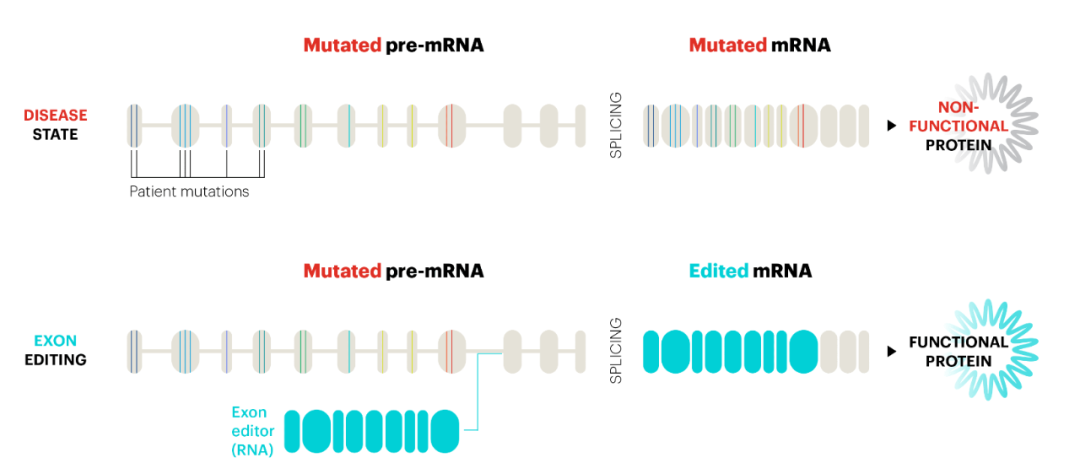
▲RNA外显子编辑疗法的作用机制(图片来源:Ascidian Therapeutics公司官网)
STELLAR是一项开放标签的1/2期试验,将评估一次性经视网膜下注射ACDN-01在患有Stargardt病和其他ABCA4相关视网膜病变的参与者中的安全性和有效性。
Stargardt病是最常见的遗传性黄斑变性,起因于ABCA4基因的变异。这些变异引发渐进性视网膜退化和视力损害,通常从儿童期或青少年早期开始。已知ABCA4基因有超过1000种变异导致Stargardt病。由ABCA4功能丧失引起的疾病,由于基因庞大或基因突变的显著多样性而无法通过常规基因替换或单碱基编辑解决。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 42
42

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 44
44

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 43
43