 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2024-02-01
2024-02-01
 2614
2614
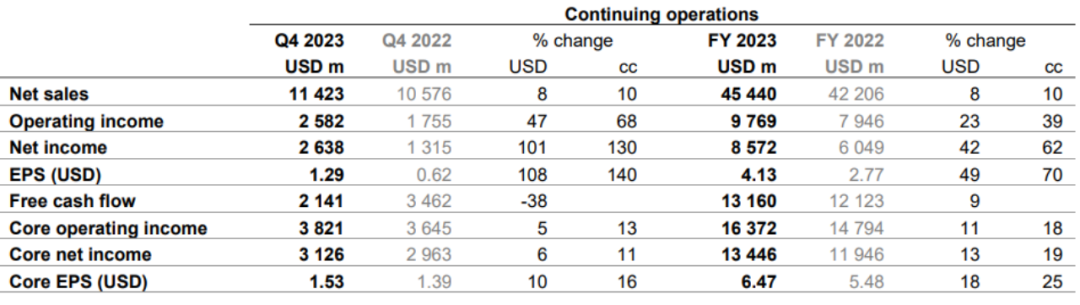
1月31日,诺华发布2023年报,2023年全球净销售额为454.4亿美元,同比增长10%。销售额增长主要得益于Entresto(+31%cc)、Kesimpta(+99% cc)、Kisqali (+75% cc)、Pluvicto (+261% cc) 和 Scemblix (+179% cc)的的持续强劲表现。第4季度净销售额达到114.23亿美元,增长10%,核心营业收入增长13%。
01 肾病领域捷报连连
2023年8月,诺华以32亿美元预付款完成对Chinook Therapeutics的收购,随后2024年1月,诺华全资收购由Chinook Therapeutics与数名国际领先的生命科学投资者于2021年12月共同设立的生物技术公司信瑞诺医药,加速其在肾脏疾病领域的布局。
诺华收购Chinook获得了两项处于III期研究的 IgA肾病(IgAN)资产:口服内皮素 A 受体拮抗剂atrasentan和抗 APRIL 单克隆抗体 zigakibart,收购信瑞诺医药获得了其在大中华区和新加坡拥有两项核心资产,包括atrasentan(3期)和BION-1301(2 期),除此之外诺华在肾病领域还有一款药物iptacopan(图1)[1]。

图1. 诺华在肾病领域管线布局
2023年12月6日,诺华宣布补体B因子抑制剂iptacopan已被FDA批准用于治疗阵发性夜间血红蛋白尿症(PNH)成人患者,成为首个治疗PNH的口服单药疗法[2]。
此次批准是基于 III 期 APPLY-PNH 试验,该试验针对残留性贫血(血红蛋白< 10 g/dL)的患者,尽管之前接受过抗 C5 治疗,但改用iptacopan治疗,患者在没有红细胞输注的情况下显示出血红蛋白改善和输血避免率优于继续接受抗 C5 治疗的患者。在补体抑制剂初治患者中进行的III期APPOINT-PNH研究也支持了该批准。
随后2023年12月11日,诺华宣布iptacopan治疗PNH成人患者的关键III期APPLY-PNH试验延长期结果:连续接收iptacopan(200 mg,每日两次)治疗 48 周,使血红蛋白水平持续升高至接近正常水平(12 g/dL或更高),避免输血,并减少大多数患者报告的疲劳,在扩展中,从抗 C5 治疗转向 iptacopan治疗的患者出现了类似的益处[3]。
除PNH之外,iptacopan目前也处于其他许多补体介导疾病(CMD)的关键研究阶段,包括C3肾小球病(C3G)、IgA肾病(IgAN)、狼疮性肾炎(LN)和冷凝集素病(CAD)等(图2)[4]。
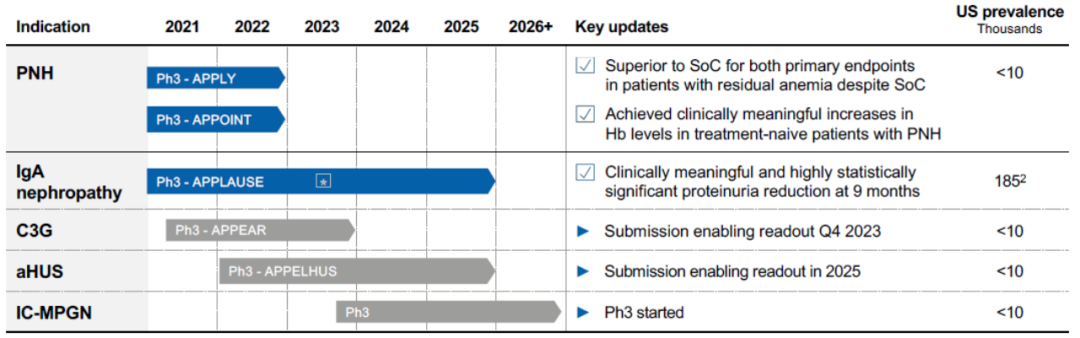
图2. Iptacopan的适应症布局
2023年10月2日,诺华宣布iptacopan的III期APPLAUSE-IgAN研究(NCT04578834)在9个月时的预先指定的中期分析取得了积极的顶线结果。该研究以双盲方式继续进行,通过测量 24 个月内估计的肾小球滤过率(eGFR) 斜率来评估 iptacopan 减缓 IgAN 进展的能力,这是研究结束时的主要终点,预计在 2025 年获得顶线结果(图3)[5]。
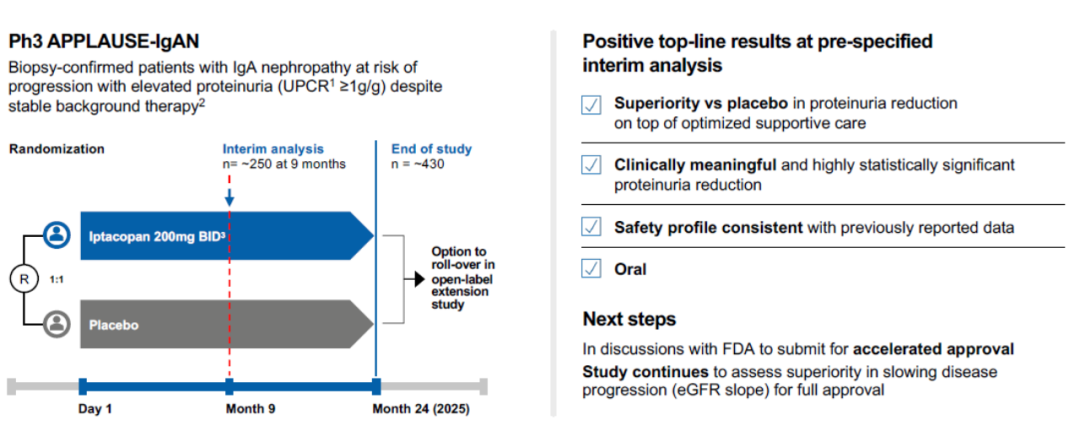
图3. APPLAUSE-IgAN研究结果
2023年12月11日,诺华宣布,iptacopan用于治疗C3肾小球病患者为期六个月双盲的III期APPEAR-C3G研究积极的顶线结果。该研究达到了其主要终点,与安慰剂相比,iptacopan(200 mg,每日两次)在蛋白尿减少方面具有临床和统计学意义,iptacopan的安全性与先前报告的数据一致[6]。
除了iptacopan之外,atrasentan在IgAN患者中的NCT04573478临床中期分析也取得积极结果:该研究在为期36周的中期分析中达到了其主要疗效终点,atrasentan显示出优于安慰剂的优势,在接受支持性治疗(最大耐受性和稳定剂量的肾素-血管紧张素系统 [RAS] 抑制剂)的 IgAN 患者中,蛋白尿具有临床意义和高度统计学意义的减少。根据这项中期蛋白尿终点分析的结果,诺华计划在2024年提交申请,以加速在美国获得批准[7]。
02 41.65亿美元,诺华扩充小核酸领域管线
2024年1月7日,诺华与舶望制药就RNAi疗法达成两项独家许可合作协议,将两款针对心血管疾病疾病开发的产品全球或者除大中华区以外全球许可给诺华,交易潜在总价值高达41.65亿美元。此外,诺华还将获得针对心血管疾病的最多额外2个靶点化合物的选择权(图4)。
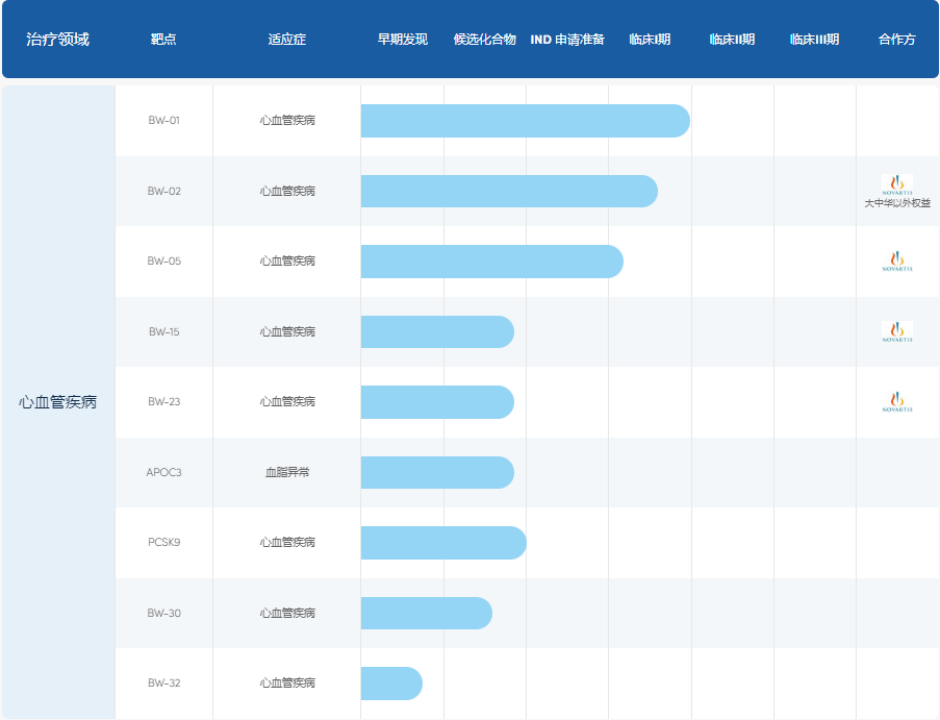
图4. 舶望制药部分研发管线
核酸药物可分为mRNA类药物和小核酸药物两类。小核酸药物则是由少量核苷酸组成的短链核酸,通过干预靶基因表达,实现治疗疾病的目的。小核酸药物类型中反义寡核苷酸(ASO)和小干扰RNA(siRNA)两种类型研究最多。
此前因为新冠使mRNA类药物爆火,小核酸药物备受冷落,近期,小核酸药物刮起一阵风,诺华的这项交易更是让小核酸领域达到高潮。
早期小核酸药物存在易被核酸酶降解、肾清除率高,脱靶效应明显等问题而进展缓慢,后来随着小核酸化学修饰和递送技术的改进,小核酸药物得以蓬勃发展。
与小分子或抗体药物相比,小核酸药物是直接靶向DNA或RNA,具有候选靶点丰富、研发周期短和临床开发成功率高等优点。
截止目前,全球有17款获批的小核酸药物(包括已退市的),80%都是在2016年之后获批上市,包括诺华的用于治疗高血脂症的药物Leqvio。
Leqvio是诺华于2020年12月斥资97亿美元收购The Medicine Company 公司所得的靶向PCSK9的长效降脂siRNA药物,相继于2021 年12月和2023年8月在美国和中国获批上市,是全球首款获批用于治疗常见慢性疾病小核酸药物,打破了小核酸药物仅能治疗罕见病的局限。
相对于获批的PCSK9单抗药物阿利西尤单抗和依洛尤单抗,Leqvio的优势在于给药频率上,在初次和第三个月给药之后,后续只需要半年给一次药,大大减少了给药频率,增加了患者的依从性,Leqvio自上市以来销售额急剧上升,2023年Leqvio销量增长217%,达到3.55亿美元(图5)[8]。
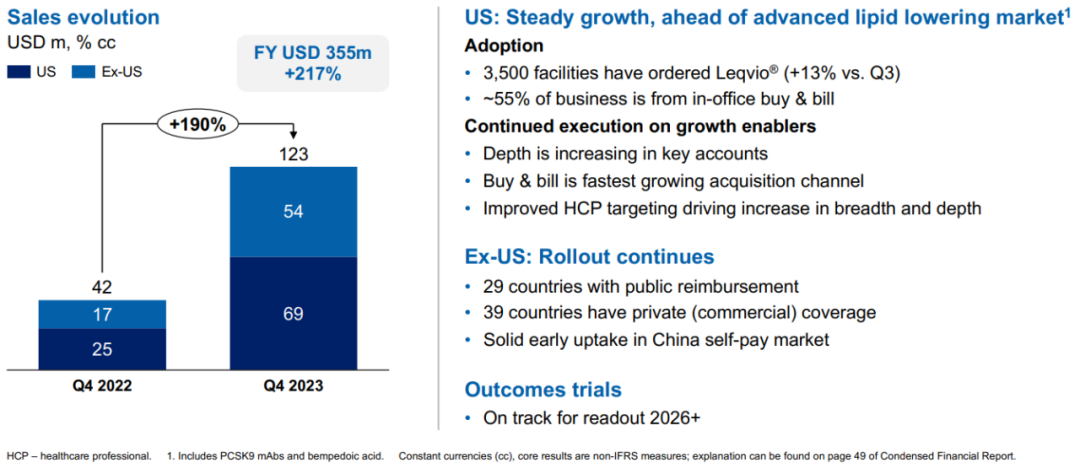
图5. Leqvio的销售额
03 Lutathera和Pluvicto引领核药狂潮
核药,又称放射性疗法,是一类含放射性核素,供医学诊断或治疗用的特殊药物,由放射性同位素与有机分子键组合而成。
核药主要分为诊断用放射性药物和治疗用放射性药物两大类,此前,市场上主要用的是诊断用放射性药物,直到2018年1月26日诺华的用于治疗生长抑素受体(SSTR)阳性的胃肠胰神经内分泌肿瘤患者核素偶联药物(RDC)Lutathera上市才打破这一市场规律。
Lutathera被FDA批准是基于NETTER-1(NCT01578239)试验结果,这是一项随机、多中心、开放标签、主动对照试验,涉及229名进行性、高分化、局部晚期/无法手术或转移性生长抑素受体阳性中肠类癌肿瘤患者。
研究结果表明:Lutathera组未达到中位无进展生存期(PFS),高剂量长效奥曲肽组为8.5个月[9]。
2023年9月25日,诺华宣布Lutathera组的III期NETTER-2试验达到了主要终点。与单独使用高剂量长效奥曲肽相比,Lutathera 联合长效奥曲肽一线治疗可显著改善新诊断的SSTR阳性、2 级和3级晚期胃肠胰神经内分泌肿瘤 (GEP-NET)患者的PFS(图6)[10]。
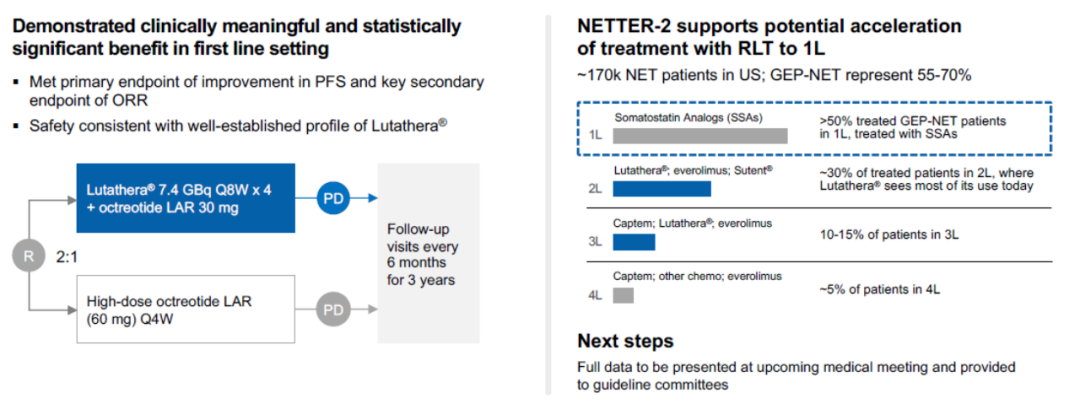
图6. NETTER-2试验方案和结果
Lutathera在上市首年营收达到了1.67亿美元,2019年增长到4.41亿美元,2022年营收为4.71亿美元,2023年销售额增长至6.05亿美元,同比增长28%[8]。
除了Lutathera,诺华还有一款重磅RDC药物Pluvicto,于2022年3月23日被FDA批准上市,用于治疗PSMA阳性转移去势抵抗性前列腺癌(mCRPC)患者。
2016年以来,FDA批准了11款RDC药物,其中只有2款治疗用RDC,即诺华的Lutathera和Pluvicto,它们也奠定了诺华在RDC领域的绝对领导地位[11]。
Pluvicto被FDA批准是基于VISION(NCT03511664)试验结果,这是一项随机(2:1)、多中心、开放标签试验,评估了Pluvicto联合最佳护理标准(BSoC)(n=551)或单独BSoC(n=280)治疗进行性PSMA阳性mCRPC男性。
试验结果显示:Pluvicto组总生存期(OS)和影像学无进展生存期(rPFS)的主要终点有统计学意义的改善。Pluvicto加BSoC与BSoC的OS风险比(HR)为0.62(95%CI:0.52,0.74;p<0.001)。Pluvicto联合BSoC组的中位OS分别为15.3个月,BSoC组的中位OS分别为11.3个月[12]。
2023年欧洲肿瘤内科学会(ESMO)大会上,诺华公布了Pluvicto的III期PSMAfore试验的数据:与雄激素受体通路抑制剂(ARPI)治疗组相比,Pluvicto组达到了其主要终点,在前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者中具有临床意义和统计学意义[13]。
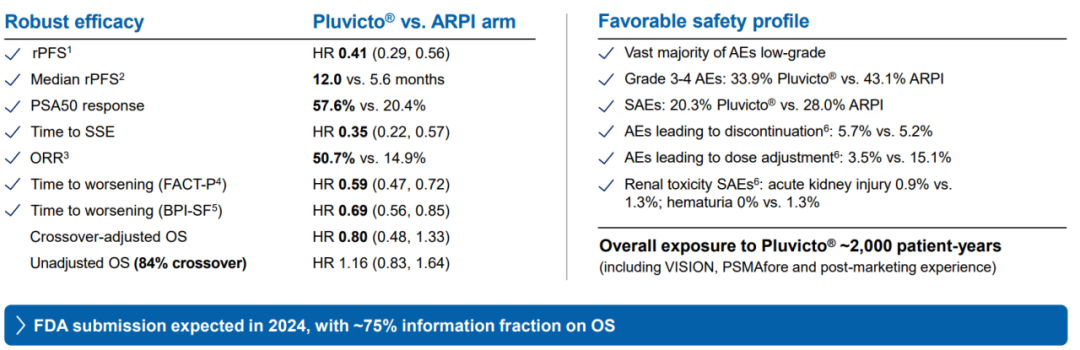
图7. PSMAfore试验结果
Pluvicto展现出比Lutathera更强的销售爆发力,上市当年即实现2.7亿美元销售额,2023年销售总额达9.8亿美元,同比增长261%(图8)[8]。

图8. Pluvicto的销售额
小结
2023年,诺华业务上进行大调整,剥离了仿制药业务山德士,成为一家完全专注于创新药物的公司。
诺华表示将专注于四大核心治疗领域,包括心血管-肾脏-代谢(CRM)、免疫学、神经科学、肿瘤,打造“2+3”技术平台,分别为化学、生物治疗、xRNA、放射性配体以及细胞与基因治疗,提供高价值药物,通过研发方面的技术领先地位和新的获取方法,减轻社会最大的疾病负担。
主要参考文献
1.Novartis Strategy & Growth Update Vas Narasimhan, CEO J.P. Morgan Healthcare Conference
2.Novartis receives FDA approval for Fabhalta® (iptacopan), offering superior hemoglobin improvement in the absence of transfusions as the first oral monotherapy for adults with PNH
3.Novartis presents new 48-week results from Phase III APPLY-PNH trial showing sustained efficacy and long-term safety of Fabhalta® (iptacopan) in adults with paroxysmal nocturnal hemoglobinuria (PNH)
4.novartis Q3 2023 Results Investor presentation
5.Novartis investigational iptacopan Phase III study demonstrates clinically meaningful and highly statistically significant proteinuria reduction in patients with IgA nephropathy (IgAN)
6.Novartis investigational iptacopan Phase III study demonstrates clinically meaningful and statistically significant proteinuria reduction in patients with C3 glomerulopathy (C3G)
7.Novartis investigational atrasentan Phase III study demonstrates clinically meaningful and highly statistically significant proteinuria reduction in patients with IgA nephropathy (IgAN)
8.Q4 2023 results Investor presentation January 31, 2024
9.FDA approves lutetium Lu 177 dotatate for treatment of GEP-NETS
10.Novartis radioligand therapy Lutathera® demonstrated statistically significant and clinically meaningful progression-free survival in first line advanced gastroenteropancreatic neuroendocrine tumors (GEP-NETs)
11.BiG生物创新社:核药:前世今生、市场规模、准入壁垒、研发热点
12.FDA approves Pluvicto for metastatic castration-resistant prostate cancer
13.Novartis Pluvicto™ shows clinically meaningful and highly statistically significant rPFS benefit in patients with PSMA-positive metastatic castration-resistant prostate cancer in the pre-taxane setting

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-10-13
2025-10-13
 19
19

 产业资讯
产业资讯
 药研网
药研网  2025-10-13
2025-10-13
 19
19

 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2025-10-13
2025-10-13
 19
19