 产业资讯
产业资讯
 广州罕见病基因治疗联盟
广州罕见病基因治疗联盟  2024-02-21
2024-02-21
 4220
4220
在基因治疗中,病毒载体技术是目前最主要的基因导入方式,近年来,腺相关病毒(AAV)载体掀起该领域的热潮,且发展势头越来越猛。
AAV作为一种小型无包膜细胞病毒在递送系统中有很多优势,比如无致病性、高效持续表达、易于操作以及免疫原性低等,被视为最有前途的基因治疗载体。AAV载体携带的治疗基因进入细胞后,能够将转录翻译为功能蛋白,从而达到治疗一系列疾病的目的。基因疗法的兴起,也给很多罕见病患者带来了根治的曙光。2021年以来,国内AAV基因疗法已经取得了较大的进展,似是迎来了一个“爆发潮”,据不完全统计,截至2024年2月8日已经有37款AAV基因治疗药物IND申报受理/批准,其中有3款进入临床3期(包括诺华AAV基因疗法Zolgensma),这也意味着中国的AAV基因疗法即将迈入下一阶段——商业化。

20、VGM-R02b
研发企业:上海天泽云泰生物医药有限公司
阶段:2023年4月28日,上海天泽云泰公司申报的VGM-R02b临床试验申请(IND)获CDE受理。7月13日,VGM-R02b获得国家药品监督管理局批准同意开展治疗戊二酸血症I型的临床试验。

适应症:戊二酸血症I型
相关介绍:VGM-R02b是一种防止婴幼儿及儿童期戊二酸血症造成严重或危及生命的疾病进展的潜在治疗方法,也是全球首个用于戊二酸血症I型(GA-I)的基因治疗产品。此前,该产品已获得美国FDA授予用于治疗戊二酸血症I型(GA-I)的罕见儿科疾病认定(RPDD)资格,这也是天泽云泰成立以来第三个获得临床许可的基因治疗项目。
21、AL-001
研发企业:北京安龙生物医药有限公司
阶段:2023年4月27日,北京安龙生物医药有限公司(以下简称“安龙生物”)宣布,公司的眼科基因治疗产品“AL-001眼用注射液”IND已获CDE批准。2023年5月29日,安龙生物发布消息称,该项目获得了研究组长单位北京协和医院机构项目立项和伦理委员会的批准,标志本项目正式进入了临床试验阶段。
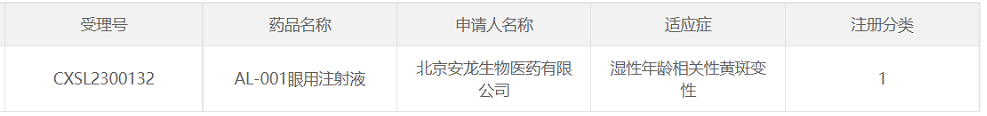
适应症:湿性年龄相关性黄斑变性(wAMD)
相关介绍:Luxturna利用腺相关病毒2载体(AAV2)将导致视网膜遗传病的RPE65基因直接引入到视网膜色素上皮(RPE)细胞中,让患者生成正常功能的蛋白来改善视力。它不但能治疗莱伯氏先天性黑蒙症,还能够治疗其他由RPE65基因突变引起的眼疾。但对于因病毒引起免疫反应等,这种药物只能在有限的时间内有效。
22、EXG102-031
研发企业:杭州嘉因生物科技有限公司
阶段:2023年6月1日,杭州嘉因生物科技有限公司(以下简称“嘉因生物”)的AAV基因治疗药物EXG102-031眼用注射液获CDE批准。
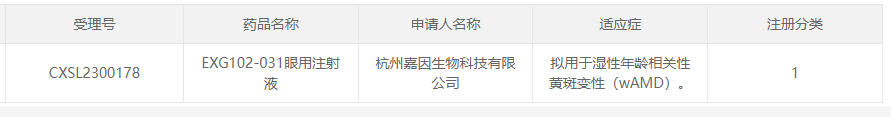
适应症:湿性年龄相关性黄斑变性( wAMD)
相关介绍:该疗法以AAV为载体过表达一种治疗性融合蛋白,能够结合/中和所有已知的血管内皮生长因子(VEGF)和血管生成素-2(ANG2)亚型,理论上一次给药长期有效。
23、ZS802
研发企业:四川至善唯新生物科技有限公司
阶段:2023年6月28日,四川至善唯新生物科技有限公司(以下简称“至善唯新”)针对血友病A的AAV基因治疗药物“ZS802注射液”获CDE批准,即将开展临床I/II期试验。

适应症:血友病A
相关介绍:ZS802是至善唯新自主研发的AAV基因治疗药物,采用公司自主开发的全球最小肝脏特异性启动子,解决了被包装基因容量大的难题,显著提高了产品质量,此外,ZS802采用了至善唯新优化改造的FVIII基因序列,有效提高了其药效。目前,ZS802项目已在中国医学科学院血液病医院展IIT研究,其研究结果初步证明了该药物的安全性和有效性。
24、NGGT001
研发企业:苏州诺洁贝生物技术有限公司
阶段:2023年7月5日,苏州诺洁贝生物技术有限公司(简称“诺洁贝生物”)的一款治疗结晶样视网膜变性(BCD)的AAV基因治疗药物“NGGT001 注射针””获CDE批准,即将开展临床I/II期试验。

适应症:结晶样视网膜变性(BCD)
相关介绍:NGGT001是一款基于rAAV2的基因疗法,通过表达密码子优化的人CYP4V2,用于治疗结晶样视网膜变性(BCD)。研究显示,在BCD相关细胞模型中,由NGGT001介导的CYP4V2表达有效地挽救了由CYP4V2突变引起的表型缺陷,表现出恢复自噬流活性,减少脂质积累和保持细胞活力,提供了通过CYP4V2基因增强恢复功能的治疗理念。
25、FT-004
研发企业:方拓生物科技(苏州)有限公司
阶段:2023年7月12日,方拓生物科技(苏州)有限公司(简称“方拓生物”)研发的针对血友病B(内源性FIX活性≤2%)的AAV基因治疗药物FT-004获得CDE临床试验许可。

适应症:血友病B(内源性FIX活性≤2%)
相关介绍:FT-004是一款基于AAV载体的基因治疗药物,临床前数据表明,FT-004可高效进入肝脏细胞,可持续、稳定表达及分泌功能性hFIX蛋白至血液中,能够长期有效地提高模型动物的凝血能力,且安全性良好。
26、BBM-H803
研发企业:上海信致医药科技有限公司、上海勉亦生物科技有限公司
阶段:2023年7月24日,信念医药公司(Belief BioMed,BBM)全资子公司上海信致医药科技有限公司和上海勉亦生物科技有限公司申报的“BBM-H803注射液”临床试验申请获临床试验默示许可,适应症为血友病A。
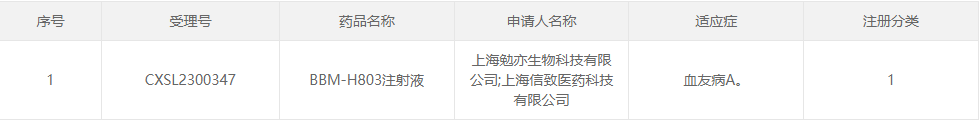
适应症:血友病A
相关介绍:BBM-H803是信念医药拥有自主知识产权的AAV基因治疗药物,通过静脉给药将人凝血因子Ⅷ基因导入血友病A患者体内,从而提高并长期维持患者体内凝血因子水平。
27、JNJ-81201887
研发企业:Janssen Research & Development, LLC
阶段:2023年8月2日,强生(Johnson & Johnson)旗下杨森(Janssen)申报的1类新药JNJ-81201887(AAVCAGsCD59)获CDE临床试验默示许可,拟开发用于治疗继发于年龄相关性黄斑变性的地图样萎缩成人患者。

适应症:用于治疗继发于年龄相关性黄斑变性的地图样萎缩成人患者
相关介绍:JNJ-1887是一种用于治疗地图样萎缩患者的基因疗法,杨森公司于2020年12月宣布与Hemera Biosciences公司达成合作,从而囊获这款一次性门诊玻璃体内注射疗法。该产品被设计用以增加水溶性CD59分子(sCD59)表达,以保护视网膜细胞并减缓或避免疾病进展。该疗法此前已经获得了美国FDA授予的快速通道资格,以及欧洲药品管理局(EMA)的先进治疗药物资格。
28、RRG001眼内注射液
研发企业:上海鼎新基因科技有限公司
阶段:2023年8月12日,上海鼎新基因RRG001眼内注射液临床试验申请(IND)获CDE受理。11月6日,RRG001眼内注射液的临床试验申请(IND)已获国家药品监督管理局(NMPA)默示许可批准。

适应症:新生血管性年龄相关性黄斑变性(nAMD)
相关介绍:RRG001眼内注射液是鼎新基因首款适用于新生血管性年龄相关性黄斑病变(nAMD)的基因治疗药物。是鼎新基因拥有自主知识产权的重组腺相关病毒(rAAV)基因治疗药物,通过视网膜下腔给药将血管内皮生长因子受体(VEGFR)Fc融合蛋白基因导入nAMD患者眼底,让眼底细胞成为蛋白工厂,不断表达患者需要的VEGF受体Fc融合蛋白,避免了传统抗VEGF抗体药物需要频繁玻璃体注射给药的弊端,以期达到“一次给药、长期获益”的治疗效果。
29、FT-002注射液
研发企业:方拓生物科技(苏州)有限公司
阶段:2023年8月15日,方拓生物科技(苏州)FT-002注射液IND申请获CDE受理。11月6日,FT-002注射液获得中国国家药品监督管理局药品审评中心(CDE)临床试验许可。
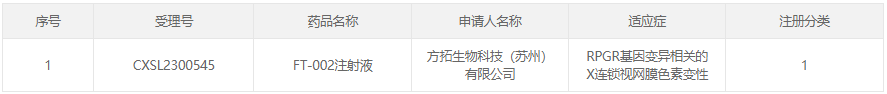
适应症:RPGR基因变异相关的X连锁视网膜色素变性
相关介绍:FT-002注射液是中国XLRP治疗领域首个获得CDE临床试验许可及开展人体试验的基因治疗药物,通过利用rAAV携带目的基因,经眼内注射,使视网膜细胞可以表达有活性的RPGR蛋白,参与光感受器纤毛运输功能,挽救由于RPGR基因变异所导致的光感受器细胞缺失并改善患者的视功能或者延缓视力损伤进展。
30、FT-003注射液
研发企业:方拓生物科技(苏州)有限公司
阶段:2023年8月21日,方拓生物科技(苏州)有限公司(简称“方拓生物”)的FT-003注射液获得CDE临床试验默示许可,适应症为糖尿病黄斑水肿。2023年4月,方拓生物的基因治疗药物FT-003注射液的临床试验申请(IND)获得CDE许可,适应症为新生血管性年龄相关性黄斑变性(nAMD),此次IND获批则意味着该产品又一适应症获批开展临床。

适应症:糖尿病黄斑水肿
相关介绍:FT-003注射液是一种新型重组腺相关病毒基因治疗药物。方拓生物已经完成的FT-003非临床研究结果显示,FT-003眼内注射,能有效靶向动物的视网膜组织细胞,使之持续稳定的分泌抗VEGF蛋白,从而减少模型动物眼底血管渗漏,降低渗漏面积和病变面积,并表现出良好的安全性。
31、SKG0106
研发企业:揽月生物医药科技有限公司
阶段:2023年10月19日,九天生物(Skyline Therapeutics)宣布旗下揽月生物医药科技有限公司自主研发的AAV眼科基因治疗药物SKG0106眼内注射溶液的临床试验申请(IND)获CDE批准,开展治疗新生血管性年龄相关性黄斑变性(nAMD)的新药临床试验。

适应症:新生血管性年龄相关性黄斑变性(nAMD)
相关介绍:SKG0106眼内注射溶液是一款创新眼科基因治疗药物,由新型重组腺相关病毒(rAAV)衣壳携带编码独特设计的抗血管內皮生长因子(VEGF)蛋白的转基因序列,通过单次玻璃体腔注射,在眼内高效转导视网膜细胞后持续表达具有抗新生血管生长功能的蛋白,从而抑制眼内新生血管增生、阻断血管渗漏和视网膜水肿,实现对nAMD的治疗。SKG0106于今年6月获美国食品药品监督管理局(FDA)的批准开展治疗新生血管性年龄相关性黄斑变性(nAMD)全球I/IIa期临床试验,全球临床试验已启动。
32、LY-M001注射液
研发企业:凌意(杭州)生物科技有限公司
阶段:2023年10月26日,凌意(杭州)生物科技LY-M001注射液IND申请获CDE受理。2024年1月24日,LY-M001注射液获美国食品药品监督管理局(FDA)的新药临床试验(IND)许可。
适应症:I型或III型戈谢病(Gaucher disease,GD)
相关介绍:LY-M001注射液是以重组腺相关病毒rAAV为载体的基因治疗产品。通过单次静脉输注给药后可特异性转导靶器官肝脏,并在肝细胞中长期稳定表达改良型葡糖脑苷脂酶。葡糖脑苷脂酶可以分泌到血液中并被其他脏器所吸收,患者体内各脏器蓄积的有害糖脂代谢物会被降解,从而有效治疗戈谢病。
33、ZS805注射液
研发企业:四川至善唯新生物科技有限公司
阶段:2023年11月11日,四川至善唯新ZS805注射液IND申请获CDE受理。

适应症:法布雷
相关介绍:ZS805是由至善唯新公司自主研发并拥有完全自主知识产权的rAAV基因药物,用于治疗法布雷病,ZS805的基因表达盒框架搭载了公司自主研发的肝脏特异性启动子和基因工程改造优化后的α-半乳糖苷酶A基因。保证α-半乳糖苷酶A蛋白在肝脏细胞中特意表达并高效分泌,提高了药物的安全性与有效性。
34、ZVS203e 注射液
研发企业:北京中因制药有限公司
阶段:2023年11月17日,北京中因制药ZVS203e注射液IND申请获CDE受理。

适应症:用于治疗携带RHO-R135W(RHO c.403C>T)突变的视网膜色素变性(Retinitis Pigmentosa, RP)患者。
相关介绍:ZVS203e注射液是一款基于基因编辑技术开发的1类创新药,用于治疗RHO基因变异导致的视网膜色素变性,是国内受理的首个体内AAV基因编辑治疗产品。
35、XMVA09注射液
研发企业:合肥星眸生物科技有限公司
阶段:2023年12月6日,合肥星眸生物XMVA09注射液IND申请获CDE受理。

适应症:湿性年龄相关性黄斑变性( wAMD)
相关介绍:XMVA09注射液是星眸生物首款基因治疗药物,也是国内首个玻璃体注射(IVT)感染视网膜色素上皮细胞(RPE)的湿性年龄相关性黄斑变性(wAMD)基因治疗产品。其具有创新性的AAV衣壳设计,能够在保证药物递送到新生血管灶的同时保障了术式的安全性,给患者和医生均带来了便利。另外,XMVA09注射液还具有VEGF、ANG-2双抗的融合设计,进一步提升了安全性和疗效,增加了对于VEGF不敏感患者的覆盖。
36、NGGT002注射液
研发企业:苏州诺洁贝生物技术有限公司
阶段:2023年12月29日,苏州诺洁贝生物技术有限公司(简称“诺洁贝生物”)的AAV基因治疗药物NGGT002注射液IND获CDE受理。在此之前,NGGT002项目的IIT研究已经完成低、中剂量的患者给药,初步结果表明了安全性与有效性。此外,NGGT002在2023年1月获得FDA的孤儿药资格认证。

适应症:成年苯丙酮尿症(PKU)
相关介绍:NGGT002 是一种基因治疗药物,适用于治疗患有PKU的成年患者。它是一种具有肝脏靶向性的重组 AAV8 载体,在肝特异性启动子的调控下,驱动密码子经过优化的 hPAH cDNA 的表达。该药物为单次用药(长期有效),用药方式为静脉输注。
37、RJK002
研发企业:上海瑞吉康生物医药有限公司
阶段:2024年2月8日,上海瑞吉康宣布其首个自主研发的AAV基因治疗药物RJK002的临床试验申请(IND)获得国家药品监督管理局药品审评中心(CDE)受理。

适应症:肌萎缩侧索硬化(ALS)
相关介绍:瑞吉康RJK系列药物可在生理层面实现聚集蛋白的“溶解”,恢复这类聚集蛋白的生理功能,从而实现对退行性疾病的治疗。RJK002是瑞吉康针对渐冻症的AAV基因治疗药物,其在临床前渐冻症模型动物实验中获得了显著的神经元保护和生存期延长的治疗效果。2023年10月,RJK002获美国FDA孤儿药资格认定(ODD)。中国IND获受理同时,瑞吉康也在积极准备RJK002美国IND申报。

 产业资讯
产业资讯
 康橙投资
康橙投资  2025-08-20
2025-08-20
 19
19

 产业资讯
产业资讯
 E药经理人
E药经理人  2025-08-20
2025-08-20
 18
18

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-08-20
2025-08-20
 20
20