 产业资讯
产业资讯
 康橙投资
康橙投资  2025-08-20
2025-08-20
 1820
1820
曾几何时,License-in几乎是中国创新药企难以绕行的“玉门关”。面对国内研发的鸿沟,挥舞天价支票、争相引进海外管线是行业常态,巨额的授权费用如同流向西方的“创新税”,成为彼时中国药企走向国际化必须支付的高昂代价。然而今天,驼铃的方向正在逆转!当资本狂沙退去、本土研发绿洲崛起,一个更具标志性意义的热词License-out正以前所未有的频率闪耀于行业头条。昔日挥舞支票的“买家”,正以令人瞩目的姿态,在全球舞台上华丽转身为手握核心技术的“卖家”。这不仅仅是一桩桩商业交易的转变,更是一场深刻的技术话语权与产业地位的乾坤挪移。中国药企,正在从技术的引进支付方,转变为创新的授权获益方。
一
数据与整体趋势
(一)交易金额与数量
数据统计显示,2021年至2024年间,License-out(对外授权)交易数量持续攀升。进入2025年,仅上半年创新药相关交易数量已突破50笔。与此同时,交易金额亦呈快速增长态势:仅2025年上半年,已披露创新药License-out交易的首付款总额便达到33亿美元,交易总金额达到484.84亿美元。
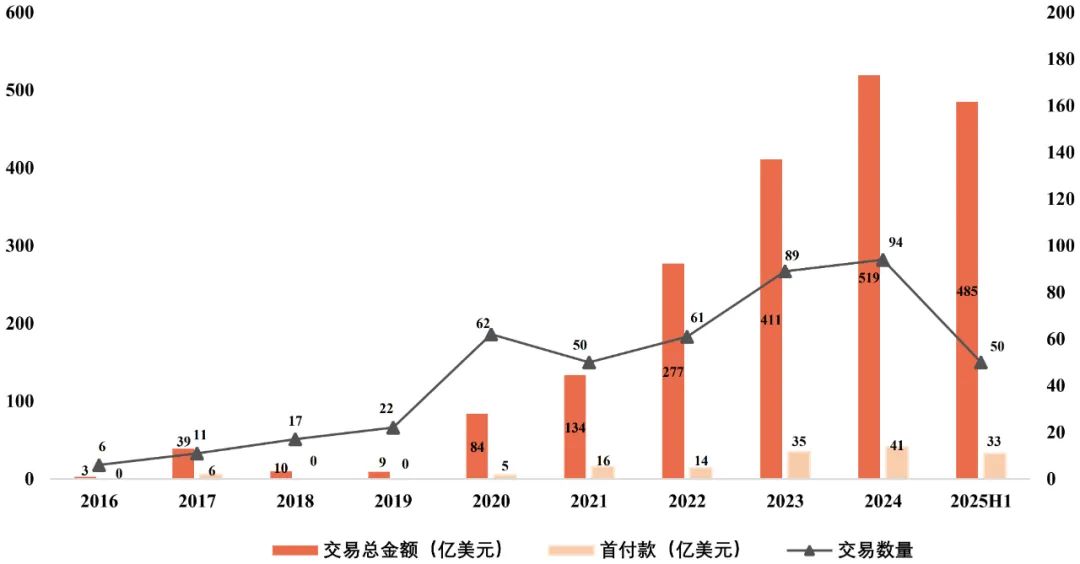
图1 我国创新药License out数量和交易总金额
数据来源:医药魔方 图片来源:康橙投资
(二)License-out项目类型
从License-out交易的类型来看,中国创新药出海已从“单点突破”迈向“多点开花”。在过去,交易主要集中于小分子化学药,近年来则迅速向生物制品拓展,涵盖单抗、双抗、多抗、细胞治疗、ADC(抗体药物偶联物)等多个前沿赛道。其中,中国在ADC领域已跻身全球创新前沿,根据Insight数据库全球新药研发数据,国产ADC新药约占全球管线的40%,已经成为全球ADC研发的核心参与者。此外,重磅ADC License-out交易持续达成,仅2025年上半年,ADC交易总金额接近200亿美元。
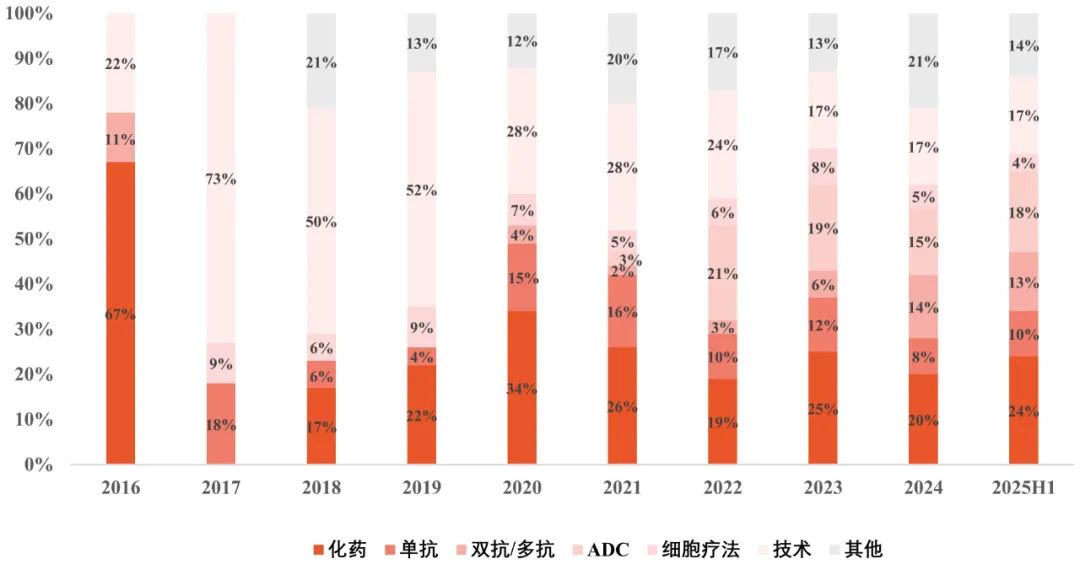
图2 License-out交易项目类型分析
数据来源:医药魔方 图片来源:康橙投资
(三)药品项目研发阶段
中国生物医药产业的国际化进程,清晰地反映在研发阶段分布上。回顾2020年之前,中国License-out的项目不仅总量相对有限,其研发阶段也呈现出明显的不均衡性,多集中在个别阶段。然而,这一格局在2020年及之后发生了显著转变。项目数量大幅攀升的同时,其研发阶段的覆盖范围也显著拓宽,实现了从临床前探索到后期确证性研究乃至申报上市的全阶段覆盖。
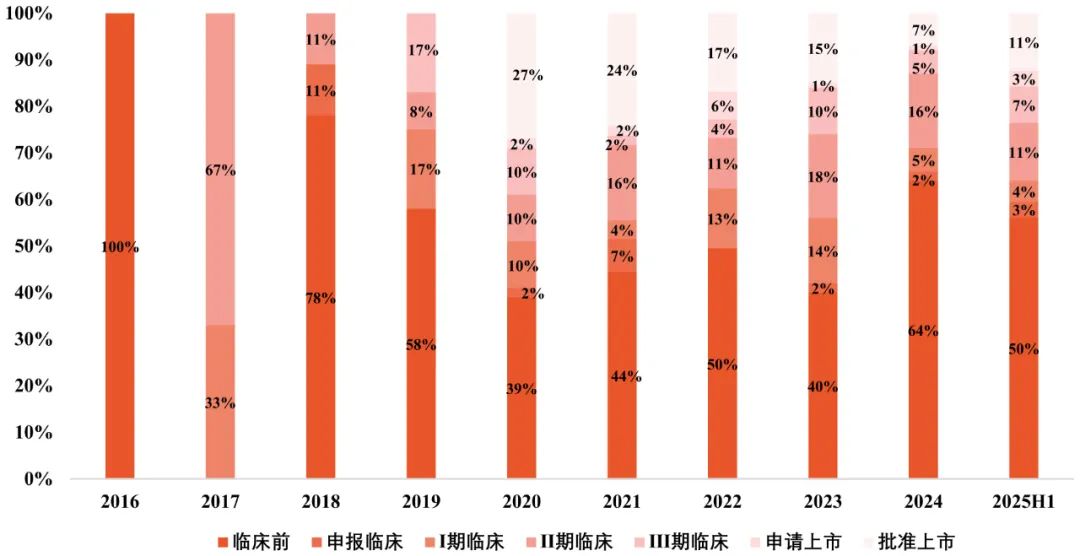
图3 License-out药品项目研发阶段分析
数据来源:医药魔方 图片来源:康橙投资
(四)疾病领域
肿瘤领域交易持续占据主导地位,仅2025年上半年即达成39项肿瘤领域License-out。与此同时,随着创新药研发的深入和国际药企对其他领域需求的增加,自身免疫、代谢、神经系统等疾病领域的License-out项目也在不断增加,说明中国企业的研发布局逐步走向多元化,其在国际市场的合作深度和广度也持续提升,进一步推动着全球创新药生态的发展。
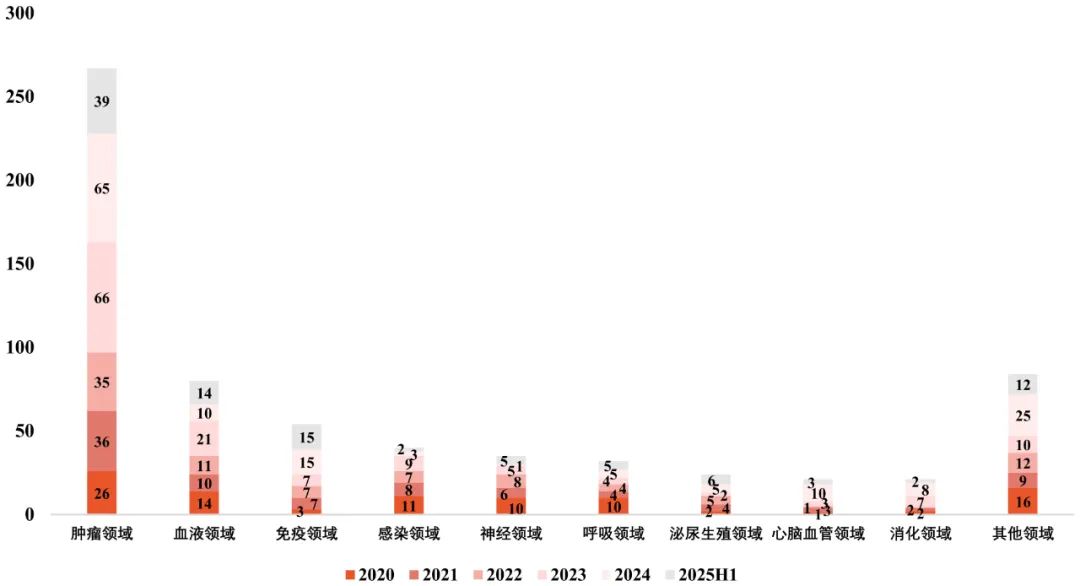
图4 License-out交易项目疾病领域分布
数据来源:医药魔方 图片来源:康橙投资
(五)受让方分布
美国作为中国License-out交易的主要受让方,交易数量持续居于前列。这一趋势反映了美国作为全球最大的药品市场,对中国创新药的高度认可。中国药企通过License-out模式,将创新药的海外权益授权给美国企业,利用美国市场的三重优势(强大的监管体系、研发环境和市场基础设施)进一步放大了中国创新药的全球价值。
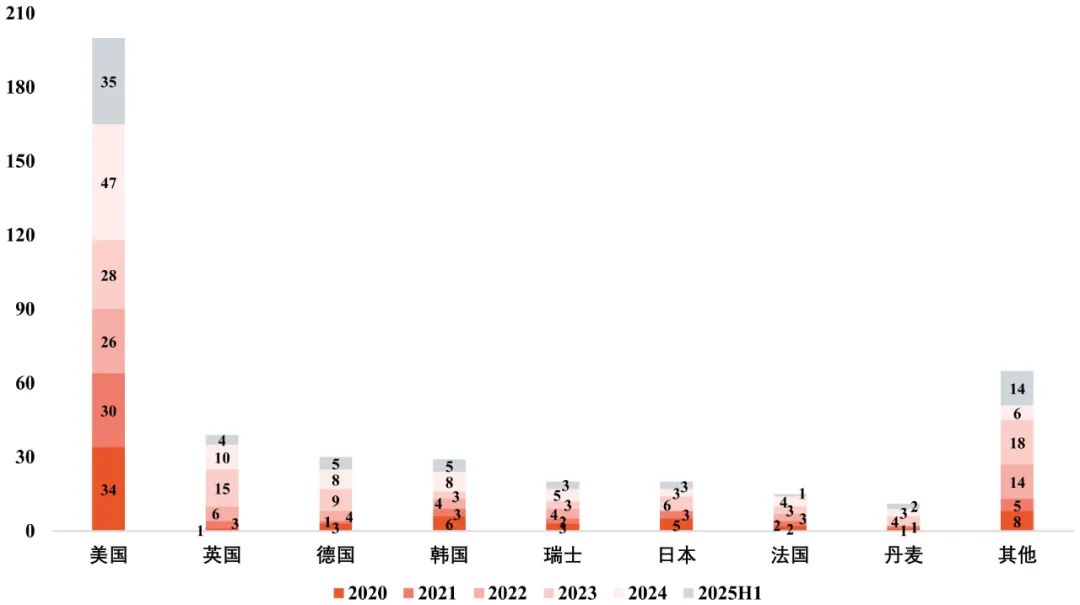
图5 License-out交易受让方国家/地区分布
数据来源:医药魔方 图片来源:康橙投资
二
“License-out”的黄金期与深层次原因剖析
(一)科研创新范式革命:从“Fast-follow”到“First-in-class”的质变
1、政策支持
自2024年《政府工作报告》首次提及“创新药”以来,中国创新药产业正迎来前所未有的政策红利期,一系列高含金量政策密集出台,形成了覆盖创新药研发、定价、支付、使用和国际化的全链条支持体系,推动我国创新药的发展,为License-out模式的广泛实施奠定了坚实的制度基础与政策环境。
表1 2024-2025年中国出台的促进创新药发展的相关政策
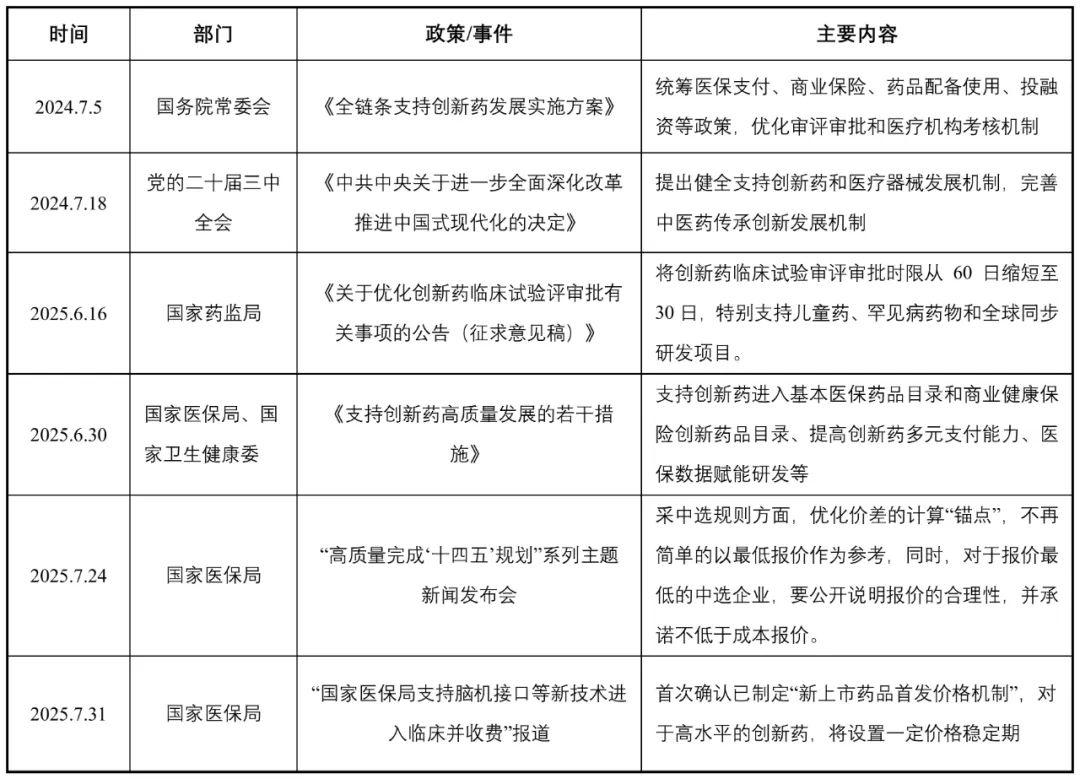
资料来源:公开信息
2、中国领跑全球的技术平台
过去十年,中国医药创新进入“从仿到创”的关键跃迁期,核心技术平台的建设与积累成为推动创新药崛起的战略支柱。例如2025年4月在港交所上市的映恩生物(09606.HK),通过构建多个具有全球知识产权的ADC技术平台(DITAC、DIBAC、DIMAC、DUPAC),已推动12款ADC候选药物进入研发管线,其中7款迈入临床阶段。其中基于DIBAC平台开发的双靶点ADC DB-1418(EGFR/HER3),在2025年1月以12亿美元总额(5000万美元首付款+11.5亿里程碑)授权给Avenzo Therapeutics,并于5月获FDA批准IND,即将启动全球多中心临床试验。因此,核心技术平台的快速发展不仅显著提升了新药研发效率与质量,也加速了成果的全球化输出。
表2 映恩生物ADC技术平台介绍

资料来源:映恩生物招股说明书
3、基础研究平台升级
中国医药产业的升级,正在经历从低附加值的原料药供应向高技术壁垒、高附加值的精密制造体系的战略跃迁。围绕生产效率、质量控制与自主可控能力的提升,产业链在多个关键环节实现了系统性突破:包括连续化生产工艺的加速应用、核心设备的国产替代、以及关键耗材的自主研发。这一系列纵深推进不仅重塑了中国生物药的成本结构与质量标准,更显著增强了生产体系的灵活性与规模转化能力。例如药明生物开发的WuXiUPTM平台,实现了连续细胞培养和生物药生产的重大突破。该平台在上游环节实现25天连续灌流培养,抗体表达期日均产量突破6 g/L,总产出达105 g/L;下游纯化采用连续捕获技术,Protein A至UF/DF阶段收率逼近80%,单批次(40 L培养规模)即可收获超3公斤目标蛋白。这一全流程连续化体系不仅将Protein A填料消耗量压缩至传统工艺的1/3,更通过集约式设备布局使厂房空间需求降低40%。
(二)国内市场生存压力倒逼全球化
1、医保谈判的“双刃剑”效应
国家医保谈判通过“以价换量”机制,显著提升了创新药的市场准入效率与患者可及性,有效促进了新药在国内的临床普及与应用广度。然而,医保控费带来的价格压缩也对企业的盈利构成压力。尤其对于尚未完成商业化规模放量的创新药企,药品价格的大幅下调叠加销售爬坡周期的延长,进一步加剧了研发投入与商业回报之间的失衡风险。在此背景下,License-out不再是锦上添花的全球化布局选项,而逐步成为在医保主导的定价体系下,实现技术价值外溢与融资平衡的“战略刚需”。
2、同质化竞争催生差异化战略
国内创新药领域的同质化竞争日益加剧,行业正深陷价格内卷与研发资源内耗的双重困境。国内市场PD-1/L1的年治疗费用已从2019年的约10万元降至2024年的3-5万元,而围绕同一靶点的临床试验多达数百项,导致患者资源高度分散、研发效率显著下降、临床证据高度重叠,整体开发价值逐步稀释。在此背景下,License-out正成为企业重塑价值的关键出口,借助海外授权,企业有望摆脱“中国折价”,实现从“低价跟随”向“高溢价输出”的转型升级,加速迈向全球价值链的中高端。
(三)跨国药企(MNC)的需求增加
MNC多款核心产品陆续步入专利到期时间,所面临的“专利悬崖”风险日益加剧。为维持业务连续性与收入增长,MNC对“外部创新”的依赖日益加深,纷纷通过License-in或战略合作加快引进高潜力资产,以填补管线空窗和技术空白。在此背景下,中国创新药企因具备卓越的研发效率与成本优势,正日益成为全球药企寻找高性价比项目的首选来源。
表3 部分MNC未来5年专利到期的重磅药物(销售额>20亿美元)
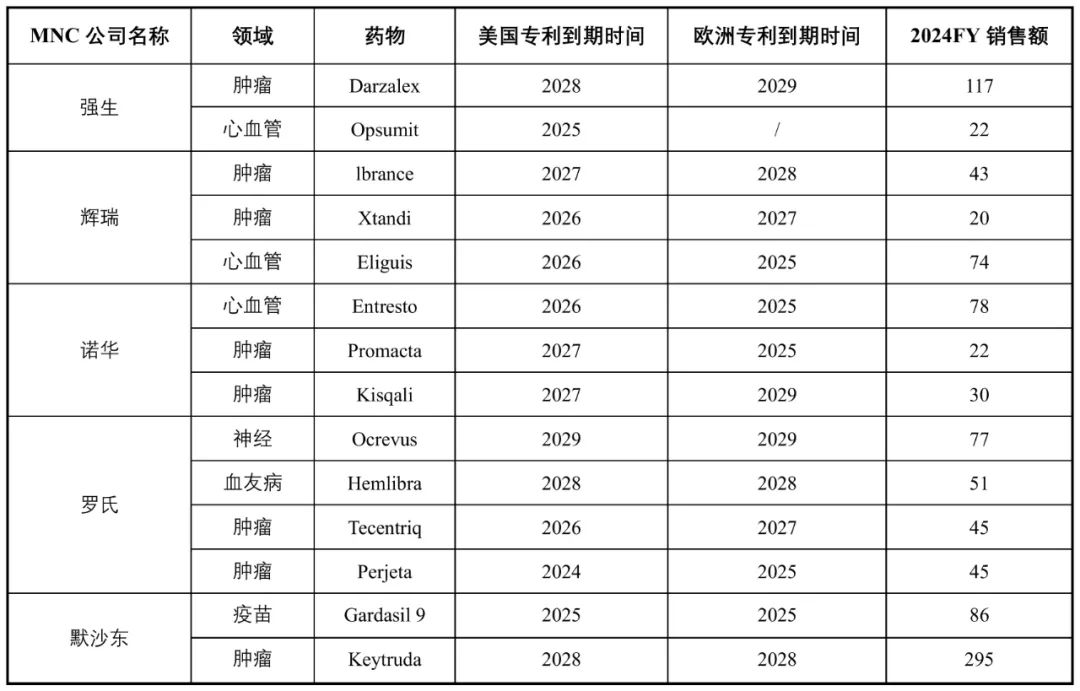
资料来源:公司公告,中信建投证券
(四)资本市场变动
医药行业的资本寒冬始于2021年下半年。此后,医药行业投融资热度骤降:投资人趋于谨慎,企业融资难度剧增。药企上市数量与募资总额也大幅下滑,Wind数据显示,2024年全年,仅5家药企成功登陆上交所、深交所和北交所,而同期主动撤回或终止IPO的药企则至少有24家。License-out作为一种相对低资本投入、快速变现的商业途径,成为该背景下破解创新药融资与产业化困境的现实选择。
2025年上半年,随着资本寒冬逐渐回暖,中国医疗健康领域融资活跃度提升,融资金额达506.9亿元人民币,同比增长10%。这一增长有效缓解了药企的现金流压力,从而保障研发投入、提升药品数据质量与资产价值;避免企业在资金短缺时被迫接受低价条款,增强License-out的谈判主动权;并通过自建专业国际团队,降低跨国药企合作风险。这一效应直接推动高价值BD交易涌现,典型的案例有2025年5月20日三生制药与辉瑞达成总额60.5亿美元的SSGJ-707双抗授权协议(12.5亿美元首付款+48亿美元里程碑付款),创下中国创新药出海首付款纪录,此外辉瑞还以1亿美元认购三生制药股份,成为战略投资者。
在此背景下,License-out的价值已超越单纯的“资金输血”,通过与海外药企合作,企业不仅能提升产品的市场价值与行业影响力,并且其作为“国际巨头真金白银背书”的权威价值验证,更能极大提振资本市场信心,提升其在资本市场的吸引力,显著降低后续融资难度并提升估值,并往往在二级市场获得实证反馈。例如三生制药公布与辉瑞BD合作消息公布当日,三生制药股价暴涨32.28%,子公司三生国健涨停。License-out已升级为中国创新药企主动布局全球、实现价值最大化和风险优化的核心商业策略。
(五)中国药企商业化能力与国际经验积累
1、国际化研发经验助力中国药企“走出去”
越来越多国内企业拥有FDA/EMA注册经验,具备国际多中心临床能力。这意味着中国药企不仅能够满足全球药政监管机构对临床试验设计、质量控制、GCP合规等方面的严格要求,也能够在项目立项初期就将注册策略全球化考虑,从而提升对licensee(被授权方)的吸引力。
2、专业配套体系赋能高效License-out
国内许多药企商业模式趋于成熟,在药品研发过程中同步构建完整的数据支持体系,包括符合ICH标准的临床试验数据库、高质量的CMC(化学、生产与控制)资料、可直接用于FDA/EMA审评的申报文件模板等,降低licensee进入壁垒。
三
暗流涌动:繁荣背后的挑战
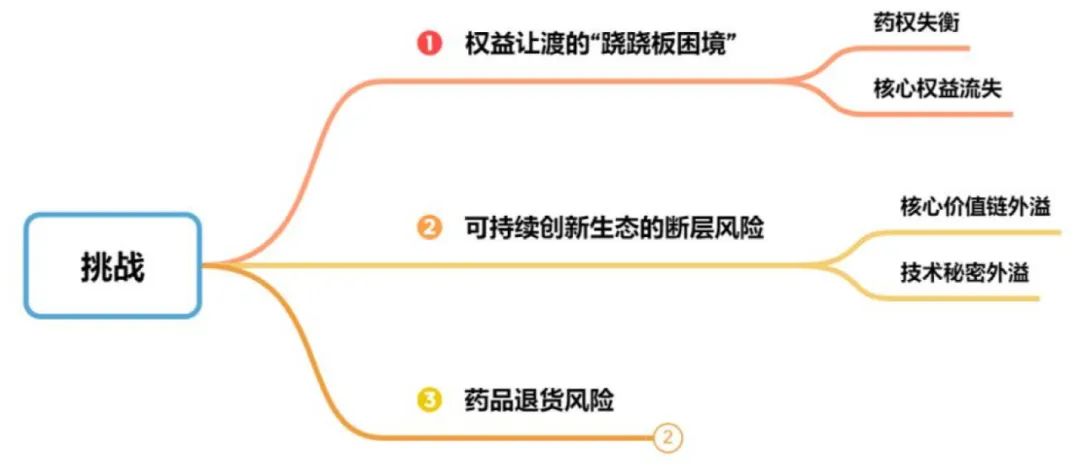
图6 繁荣背后的挑战
图片来源:康橙投资
(一)权益让渡的“跷跷板困境”
1、药权失衡
License out的交易总额中一般包括首付款、里程碑费用以及销售分成。然而中国创新药企在交易中面临严重的风险与收益结构性失衡:受资本约束和议价弱势影响,企业被迫接受“低首付比例”(占交易总值通常<15%)+“低分成率”+“高不确定性里程碑付款”的组合。这种结构导致一些困境:
(1)风险覆盖不足:当药品研发失败时,仅有的低额首付无法补偿研发成本,后续付款全部归零;
(2)长期价值折损:即使药品成功上市成为重磅药物,企业因低分成条款难以分享核心商业价值。
这种“高风险投入+低收益保障”的错配,正是当前License-out交易困局的根源。典型的案例发生在2025年6月初,百时美施贵宝与BioNTech就双特异性抗体BNT327(靶向PD-L1/VEGF)达成总值111亿美元的战略合作,迅速引发全球产业关注。而该药物实为中国药企普米斯生物原研的PM8002。回溯其商业化路径:2023年11月,BioNTech以5500万美元的首付款,以及超10亿美元的开发、注册和商业里程碑付款以及分级销售提成,获得该药在全球(大中华区除外)的开发、生产和商业化权利。2024年11月,BioNTech以9.5亿美元收购了普米斯,获得PM8002全球权益。该交易金额的价差鸿沟,揭露关于License-out价值分配失衡的事实:中国药企承担从0到1的死亡谷风险,却因定价权缺失被禁锢于价值链底端;而国际买方则通过二次交易获取了大部分商业红利。
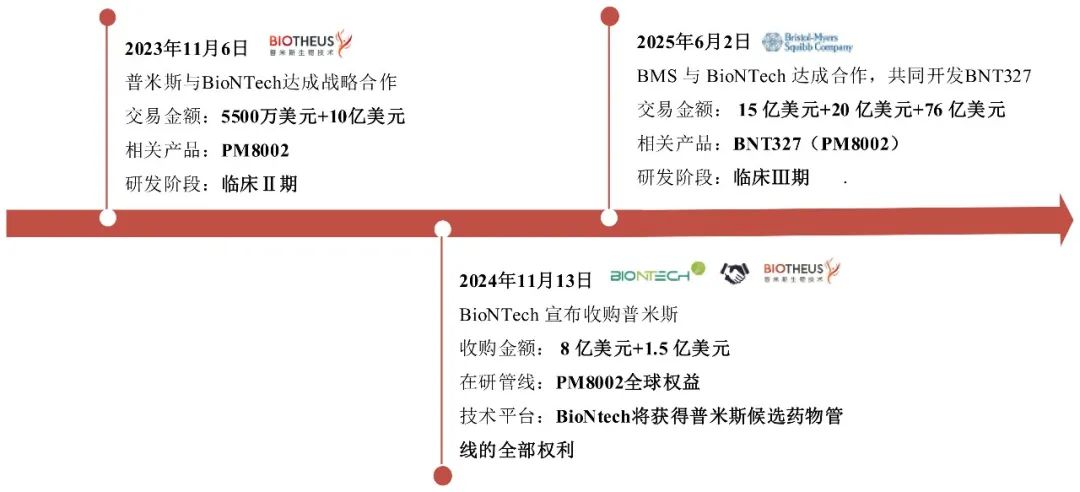
图7 PM8002(BNT237)交易时间轴
资料来源:公司公告,图片来源:康橙投资
2、核心权益流失
License-out的核心权益丢失,最直观的体现是国内药企对授权药品关键决策权和开发控制权的让渡。当药品纳入海外合作伙伴产品线后,原研方通常就失去了对其后续研发策略、适应症拓展、注册路径、上市时间表乃至商业化推广节奏的掌控,难以根据自身战略目标灵活调整资源配置。尤为严峻的是开发停滞风险:当Licensee因战略重心转移(转向更具潜力或更协同的业务)、资源竞争考量(为集中资源发展核心产品而放弃协同性不足的项目)或现金流危机(无力提供充足研发资金)而终止项目开发时,国内药企不仅丧失控制权,更将面临研发进程中断、预期收益落空的困境。
(二)可持续创新生态的断层风险
1、核心价值链外溢
在License-out模式中,尽管中国药企主导了前期的靶点发现与候选药物研发,但随着项目在临床早中期即授权出海,产品真正进入高附加值阶段(如III期全球临床、注册申报、商业化推广)时,其主导权已转移至海外合作方。这意味着企业难以参与市场化、全球化运营等核心价值链环节,其所对应的大部分经济价值也将随之流向海外体系。
这种“前端研发在中国、后端变现在欧美”的价值链分布模式,使国内企业难以在创新链条上实现能力闭环,也限制了中国医药产业向“全球整合型创新主体”的演进路径。长期依赖这种价值主导权让渡的模式,将导致中国药企始终停留在单点技术输出阶段,难以积累后端能力,进而使整个创新生态陷入“只输出候选分子、不沉淀体系能力”的结构性困境,真正意义上的自主创新将难以为继。
2、技术秘密外溢
在授权过程中,中方企业为满足合作方尽职调查与后续开发需求,被迫深度共享大量未公开的创新要素:从完整的IND资料包、揭示工艺开发底层逻辑的CMC细节、候选分子构效关系(SAR)优化机制,到核心药代/毒理数据,乃至内部的注册策略推演与临床试验排期规划。这种深度共享虽然是达成交易的必要前提,却也伴随着核心技术“外输化”与知识壁垒被动“去边界化”的高风险。不仅削弱中方企业的当期竞争力,更可能截断其技术演进的脉络,导致后续管线开发出现“断层式”脱节,最终侵蚀中国医药创新的可持续根基。
(三)药品退货风险
在药品License-out交易中,所谓的“退货”现象,指的是海外合作方在获得项目权益后,因战略重心调整、资源重新分配或临床数据未达预期,选择终止合作并将项目权利返还给原研企业。这一现象正逐渐成为中国创新药出海进程中不可忽视的系统性风险。据数据统计,在2020年已完成的62起license-out交易中,目前有25起已明确终止合作,“退货率”为40%。而2021年和2022年的“退货率”当前也已来到20%左右。
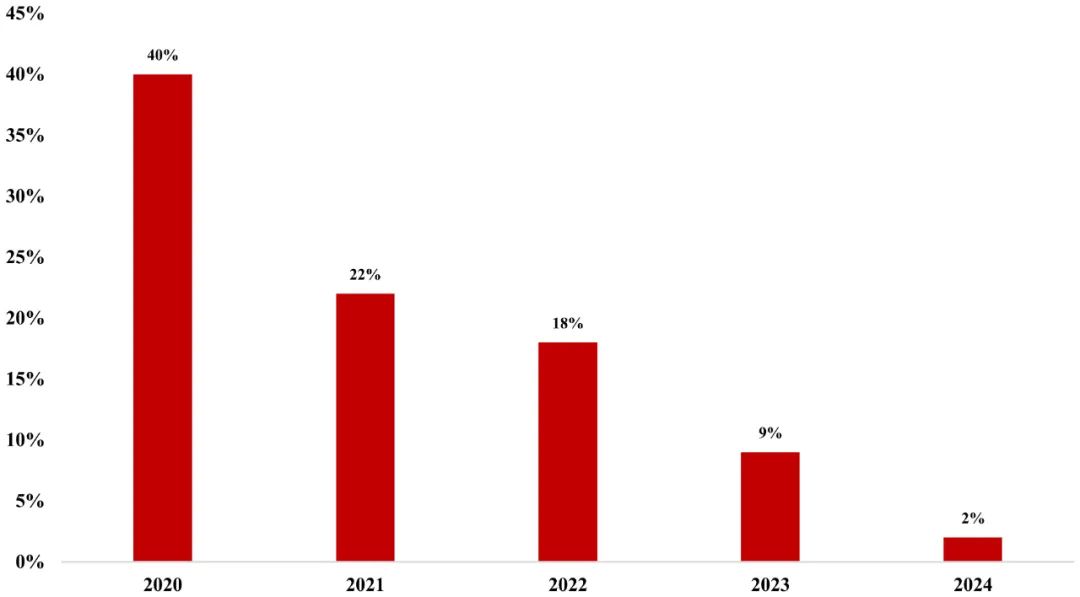
图8 2020-2024年中国药企licence-out“退货”率
资料来源:动脉网,图片来源:康橙投资
“退货”不仅意味着研发进度被迫中止、资产估值受挫,更严重削弱了中国药企在BD中的信誉与议价能力。2022年1月,君实生物(01877.HK)宣布与美国生物技术公司Coherus BioSciences达成战略合作协议,后者以3500万美元首付款、总交易金额可达2.9亿美元的条件,获得君实TIGIT单抗JS006在美国及加拿大市场的开发与商业化权利。然而,仅两年后,Coherus决定终止该合作并将JS006的相关权益“退还”给君实。主要原因是由于Coherus对公司研发管线进行了战略梳理和优先级重排,最终决定将有限资源聚焦于具有更高市场潜力或技术协同性的候选项目,Coherus选择中止该授权合作。对君实而言,虽保留了3500万美元首付款,但JS006的研发进度被拖慢。
四
未来演进:如何从交易黄金期到生态成熟期
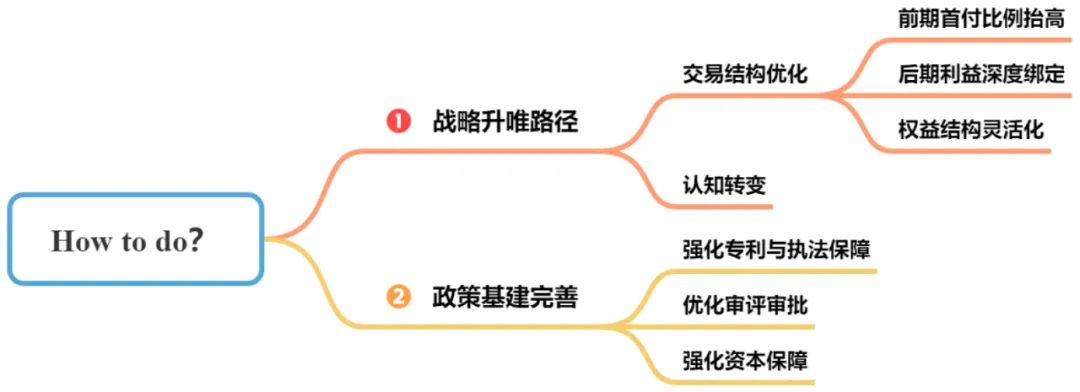
图9 License-out交易困境解决方案
图片来源:康橙投资
(一)战略升维路径
1、交易结构优化
优化License-out交易结构的本质在于提升原研方对全生命周期价值的参与度与控制力,实现从“交易对价博弈”向“合作价值共创”的机制升级。具体而言,应从以下两个层面系统优化:
(1)前期首付比例抬高:提升首付款在总交易金额中的占比,增加无条件、可即期确认的付款比例,有助于覆盖原研方在IND前/临床早期的沉没成本,并降低临床失败情况下的财务风险暴露;
(2)实现后期利益深度绑定是优化License-out模式的关键。相较于传统的固定销售分成,采用利润共享、联合开发或创新性的NewCo模式等替代路径,可使原研企业在产品全球上市后的商业价值释放过程中保留实质参与权,有效打破“早期转让、后端断裂”的价值流失格局。
其中,近期引发热议的NewCo模式,本质上是医药权益授权许可与股权交易的结合体。其核心优势在于:使原研企业得以在产品全生命周期中保留实质参与权并获取长期收益。一个典型的NewCo交易架构通常包含以下核心步骤:
(1)设立NewCo与注资:由授权方(原研企业)与投资方共同设立NewCo(或由投资方设立NewCo后向授权方发行新股),投资方负责提供资金及后续运营支持。
(2)权益授权与对价获取:授权方通过授权许可协议,将特定管线在目标区域(如海外市场)的开发权利(涵盖早期研发资产及相关知识产权,包括但不限于专利、技术诀窍及商业秘密)授予NewCo。作为对价,授权方获得NewCo的股权及约定的许可费用。这种架构通过股权纽带,将原研方与产品的长期商业成功深度绑定。
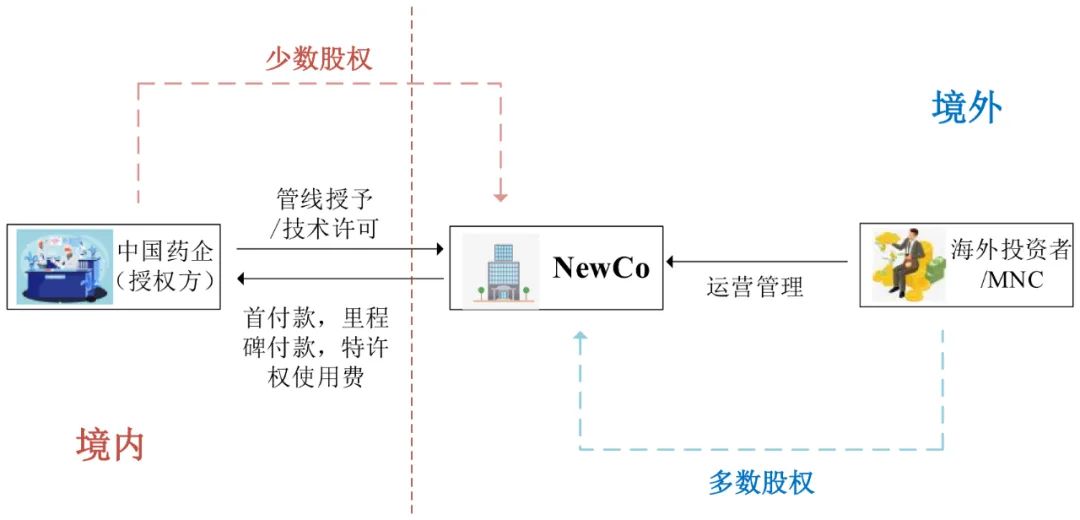
图10 NewCo交易结构
图片来源:康橙投资
(3)权益结构灵活化:在合同设计中明确保留原研方对特定适应症拓展、联合用药路径或区域权益的开发权,或设定回收条款与最低开发义务,以降低被动“退货”或项目搁置带来的系统性风险。
2、对License-out认知转变
在全球化竞争日益加剧的背景下,中国药企亟需转变对License-out的认知:其不应被视作企业商业化的终点,而应被战略性地定位为融资工具与能力建设平台。通过License-out交易所获得的首付款与里程碑收入,企业应优先用于补强自身在早期研发及系统能力方面的关键短板,包括强化基础研究与靶点发现能力、构建高通量筛选平台、完善CMC工艺与质量体系,以及搭建具备全球注册视野与合规执行力的专业团队。通过资金的结构性“反哺”,企业可持续提升研发自主性与风险应对能力,夯实长线发展基础。
进一步而言,License-out是企业提升全球化运营能力的关键途径。企业应深度参与海外临床、监管沟通与市场准入设计,掌握区域规则并构建国际化运营框架。同时,需建立知识管理体系,将注册策略、定价模型等高价值经验转化为组织能力资产,为成为全球创新企业奠定基础
(二)政策基建完善
1、强化专利与执法保障
为构建有利于创新药国际输出的制度环境,应进一步健全知识产权保护机制,为企业License-out提供坚实的法律支撑与市场回报预期。同时,应强化知识产权执法与司法保护,完善快速、有效的维权机制,提升侵权行为的法律成本,切实维护企业在License-out交易中的核心技术资产与谈判地位。
2、优化审评审批,支持创新药全球布局
随着我国创新药企积极拓展国际市场,审评审批制度的完善成为提升药品全球竞争力的关键环节。同时,应推动我国与主要国际药监机构建立临床试验数据互认机制,尤其在伦理标准、试验设计及数据采集规范等方面加强协调,降低企业跨国临床试验的重复成本和合规负担,显著缩短新药的全球注册周期。
3、强化资本保障
资金支持是推动创新药License-out的关键保障。一方面,建议设立国家级创新药研发及出海专项基金,重点支持具备自主知识产权和国际市场潜力的项目。另一方面,应鼓励社会资本加大投入。可通过税收减免、财政补贴等政策工具,引导风险投资、私募股权等资金流向创新药领域,形成“政府引导+市场参与”的多元资本支持格局,为License-out提供长期、稳定的资金保障。
五
小结与展望
近年来,从License-out交易数量与金额的显著攀升,到产品类型和研发阶段的全链条覆盖,再到多个超10亿美元量级的高价值授权项目诞生,标志着中国医药产业从技术输入到价值输出的历史性跨越。这一趋势的核心驱动力源于多重因素的交织共振:科研实力的提升;国内市场环境变化;跨国药企的管线饥渴与中国药企的研发效率及成本优势,共同创造了巨大的跨境合作势能。然而,繁荣的背后也隐藏着权益流失、技术外溢、退货风险等结构性隐忧,亟需在交易结构设计、知识产权保护、政策支持体系等方面进行系统升级。
中国创新药的全球化征途已迈过“玉门关”,未来能否从“黄金期”跃升至“生态繁荣”,关键在于解决当前挑战,构建以自主创新为牵引、以全球商业化为导向、以长期可持续发展为支撑的系统性竞争新格局,唯有如此,中国医药产业才能在高质量发展的轨道上行稳致远。

 产业资讯
产业资讯
 药明康德
药明康德  2025-12-19
2025-12-19
 35
35
 产业资讯
产业资讯
 药智网
药智网  2025-12-19
2025-12-19
 35
35

 产业资讯
产业资讯
 高特佳投资
高特佳投资  2025-12-19
2025-12-19
 45
45