 产业资讯
产业资讯
 药明康德
药明康德  2024-05-09
2024-05-09
 1063
1063
今日,礼来(Eli Lilly and Company)宣布,美国FDA外周和中枢神经系统药物咨询委员会(PCNS)将于2024年6月10日召开会议,讨论其阿尔茨海默病(AD)抗体疗法donanemab用于治疗早期症状性阿尔茨海默病的上市申请。除了直接影响donanemab的最终批准,许多专家认为这次咨询委员会议的结果也将为整个AD领域疗法的开发带来深远影响。药明康德内容团队今日结合公开资料,向广大读者们介绍在即将召开的咨询委员会议当中,可能关注、讨论的焦点。
Donanemab上市申请的依据
阿尔茨海默病是老年人中最常见的神经退行性疾病,而淀粉样蛋白沉积是患者大脑的标志性特征。靶向淀粉样蛋白是阿尔茨海默病新药开发的重要方向之一。Donanemab与名为N3pG的淀粉样蛋白亚型特异性结合,通过靶向这一亚型,donanemab能够特异性地与大脑中的淀粉样斑块相结合,从而促进淀粉样斑块的清除。
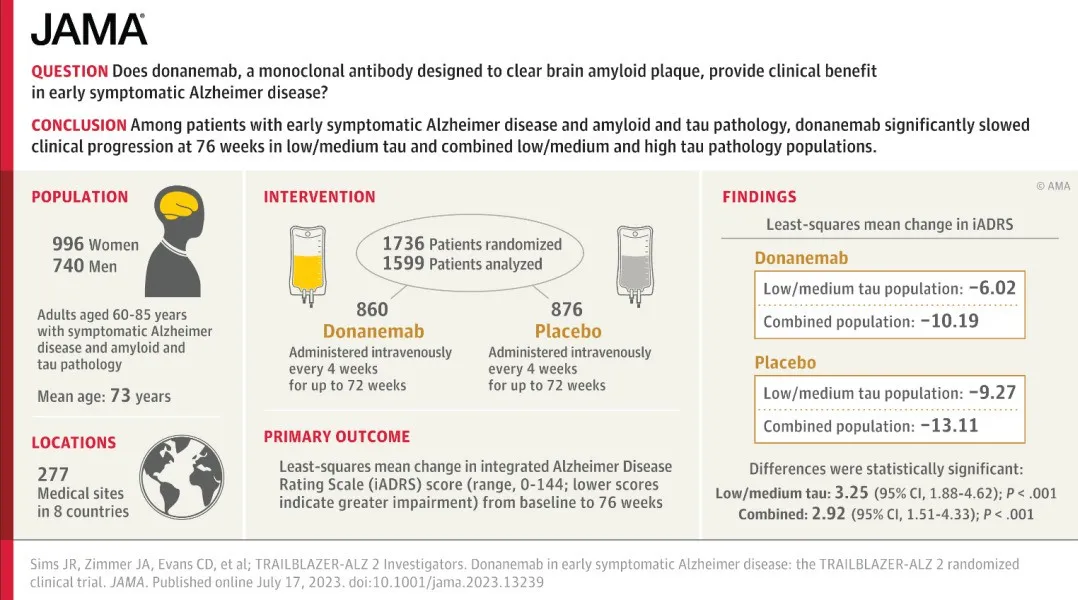
▲TRAILBLAZER-ALZ 2试验设计与结果摘要(图片来源:参考资料[4])
Donanemab的上市申请主要基于3期研究TRAILBLAZER-ALZ 2的结果。该试验是一项双盲、安慰剂对照研究,旨在评估donanemab对60-85岁、具有确认AD神经病理学特征的早期症状性AD患者的安全性和有效性,这些患者具有轻度认知障碍或AD导致的轻度痴呆。受试者按照其正电子发射断层扫描(PET)成像所显示的tau水平,分为低-中等tau组或高tau组(疾病进展的后期病理阶段)。然后,所有受试者都通过衡量认知和功能的量表进行18个月的评估,包括综合阿尔茨海默病评级量表(iADRS)和临床痴呆评级-框架总和(CDR-SB,评分越高意味着患者临床功能越低)。该试验共招募了来自8个国家的1736名受试者。
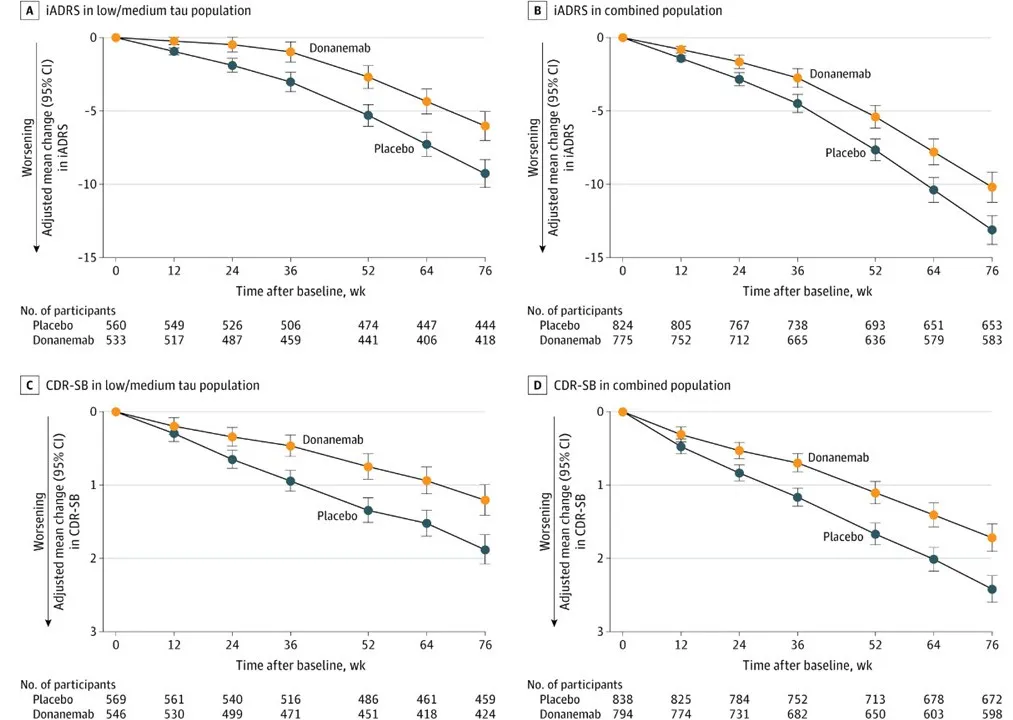
▲试验患者自基线至76周的iADRS与CDR-SB变化(图片来源:参考资料[4])
之前公布结果显示,低-中等tau组患者(n=1182)在接受donanemab治疗后,分别显著改善患者iADRS与CDR-SB指标达35%与36%。在所有淀粉样蛋白阳性的早期症状性AD患者中(n=1736),使用donanemab分别显著改善其iADRS与CDR-SB指标达22%与29%。其中,在轻度认知障碍患者(n=214)中,donanemab治疗导致其iADRS指标改善达60%,此数值在CDR-SB上为46%。
咨询委员会议当中可能关注的问题
Donanemab在试验中所展现的积极结果使得业界普遍认为该疗法最终会获FDA批准上市,然而由于donanemab临床试验设计的独特性,FDA在进行审评时显得更为谨慎,该疗法最终获批的药物标签被认为是这次即将召开咨询委员会议的焦点。除了直接影响donanemab的审评外,纽约市西奈山阿尔茨海默病研究中心副主任Samuel Gandy博士认为,该会议的结果也将对整个抗淀粉样蛋白类别的AD疗法带来重要影响。这次会议将可能围绕以下几个主题进行讨论:
Donanemab的安全性根据礼来,FDA特别关注donanemab的安全性,这是由于与类似机制药物的临床试验相比,接受donanemab治疗患者出现淀粉样蛋白相关成像异常(ARIA)的比率更高。ARIA是与淀粉样斑块清除抗体类疗法有关的不良反应,通常表现为大脑某个或多个区域的暂时性肿胀(ARIA-E)或微出血(ARIA-H),可以通过核磁共振成像(MRI)检测到。ARIA是由于药物刺激免疫系统清除大脑血管附近堆积的淀粉样蛋白所引起。虽然ARIA并不总是伴有临床症状的出现,但也可能致命。礼来报告其试验中发生了3例与ARIA相关的死亡病例,此数值与现有获批疗法相当。
咨询委员会会议上的一个大问题可能是,donanemab临床试验中ARIA发生几率的不同是由于药物本身,还是由于临床试验的差异造成的。例如,这可能是由于礼来的试验倾向于纳入淀粉样蛋白水平较高、认知障碍测试得分稍差的患者。
“这些差异可能只是由于人们体内淀粉样蛋白的数量不同,”礼来顾问、退伍军人事务波士顿医疗保健系统认知与行为神经学主任Andrew Budson博士在接受行业媒体Endpoints News采访时说道,“因为如果你的大脑中有更多的淀粉样蛋白,你的免疫反应可能会更强烈。”
停药对AD患者的影响为何根据现有的AD标准治疗,患者一旦开始进行治疗,通常会终生使用该药物以控制临床症状。而在礼来的试验中,一旦PET扫描显示该药物已基本清除患者颅脑淀粉样斑块,患者便可停止服用donanemab。阿尔茨海默病药物研发基金会联合创始人兼首席科学官Howard Fillit博士认为,与长期使用相比,这不仅带来潜在的经济效益,对无需继续接受治疗的患者来说也带来了巨大的临床效益,这是donanemab最大的潜在优势之一。
由于临床试验仅持续了18个月,这也让部分专家思考,那些停药患者如果持续接受治疗,是否会获得长期的临床益处。
“我认为咨询委员会将要讨论的一件大事是,仅仅因为PET扫描没有发现淀粉样蛋白就停止服用该药物是否合适。”Budson博士说道。
此外,在现实世界中,患者不太可能像在临床试验当中那样频繁地接受颅脑扫描,因此尚不清楚医生如何知道何时停止进行颅脑扫描。
Tau生物标志物的重要性在donanemab临床试验设计中,除了针对大脑中淀粉样蛋白进行研究外,礼来也将大脑tau蛋白纳入分析。几十年来,淀粉样蛋白假说是解释AD发病机制的重要假说。即大脑中β淀粉样蛋白(Aβ)的积累,最终形成称为斑块的团块是导致这种疾病的主要原因。淀粉样斑块触发大脑中的tau蛋白聚集在一起并在神经元内部扩散。通常当患者进入这一阶段,就会开始出现记忆丧失等症状。
礼来发现,donanemab对75岁以下、tau水平为低至中等的患者效果更好,可将认知能力下降速度减缓近50%。而tau水平较高、病情较为严重的患者从该药物中获益不大,仅将病情减缓了约20%。
专家们对礼来的tau分析大加赞赏,该分析证实了长期以来的假说,即tau含量较低的人身体状况更好。但如果美国FDA要求医生在给患者用药前检测tau水平,这可能会为患者与医生带来额外的负担和限制,部分原因在于tau成像目前尚未普及。虽然礼来在患者入组时对其进行tau水平的检测,但该公司认为在现实世界当中并不需要这么做,这是由于在donanemab相关的TRAILBLAZER项目开发计划当中,试验结果显示无论患者的tau水平为何,患者皆可从donanemab治疗中获益。
礼来在donanemab开发过程中的创新举措可能为整个AD治疗领域带来重要的改变,这次咨询委员会议预计也将对其他AD在研疗法的开发带来不同程度的影响,包含礼来另一款AD抗体疗法remternetug,以及艾伯维的淀粉样蛋白靶向抗体ABBV-916。期待这些专家在会议中的讨论最终将为整个AD领域带来正面积极的影响,让AD患者接受更为有效、安全的治疗。

 产业资讯
产业资讯
 药明康德
药明康德  2025-12-19
2025-12-19
 16
16
 产业资讯
产业资讯
 药智网
药智网  2025-12-19
2025-12-19
 16
16

 产业资讯
产业资讯
 高特佳投资
高特佳投资  2025-12-19
2025-12-19
 24
24