 研发追踪
研发追踪
 药明康德
药明康德  2024-08-12
2024-08-12
 1920
1920
今日,美国FDA官网显示,FDA已经批准诺华(Novartis)公司的潜在重磅疗法Fabhalta(iptacopan)扩展适应症,用于降低成人IgA肾病(IgAN)患者的蛋白尿水平,这些患者有疾病迅速进展的风险。诺华此前的新闻稿表示,Fabhalta是首个针对替代补体通路的IgAN疗法。
这一批准主要基于随机双盲,含安慰剂对照的3期临床试验APPLAUSE-IgAN的积极结果。这项试验在518名成人原发性IgAN患者中评估Fabhalta的疗效和安全性。该研究的两个主要终点分别为患者24小时尿蛋白与肌酐比率(UPCR)和24个月内估计的肾小球滤过率(eGFR)斜率。
此前发布的中期分析数据显示,与接受安慰剂和支持性治疗的患者相比,Fabhalta治疗组患者在接受治疗9个月后蛋白尿减少38.3%(p<0.0001),达到试验主要终点。该试验的另一项主要终点是通过测量24个月内年度eGFR斜率来评估Fabhalta减缓IgAN进展的能力,该数值预计在2025年研究完成时公布。这项研究同时表明Fabhalta的安全性与耐受性良好,与之前报告的安全性特征一致。
Fabhalta是一种口服特异性替代补体通路因子B抑制剂,能高效抑制补体替代通路中因子B。它可能在治疗多种替代通路功能异常导致的疾病同时,不影响其它补体通路介导的对微生物入侵的免疫反应,降低患者受到感染的风险。
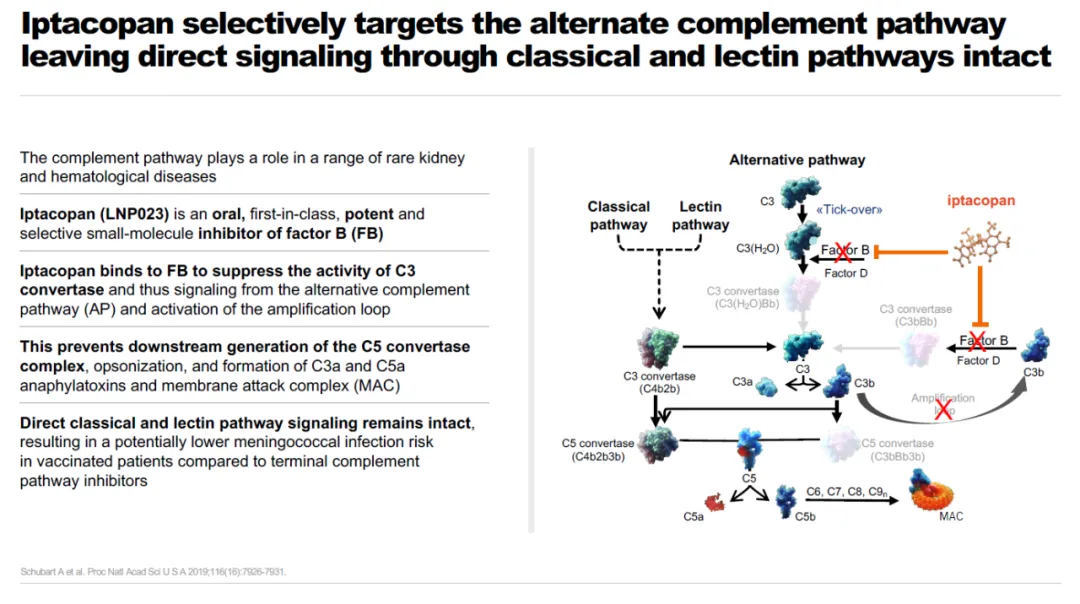
▲Fabhalta(iptacopan)简介(图片来源:诺华公司官网)
Fabhalta是诺华公司的重点开发项目之一,具有治疗多种适应症的潜力。它在2023年12月获得美国FDA批准上市,成为治疗成人阵发性夜间血红蛋白尿症(PNH)的首个口服单药疗法。
此前公布的3期临床试验APPEAR-C3G中期结果显示,在C3肾小球病(C3G)患者中,Fabhalta与安慰剂相比,在治疗6个月时将患者的蛋白尿水平降低35%。诺华公司在2024年第二季度财报中表示,Fabhalta在治疗12个月时的疗效与6个月一致,具体数据将在近期的医学会议上公布。诺华预计在2024年下半年递交Fabhalta治疗C3G的监管申请。
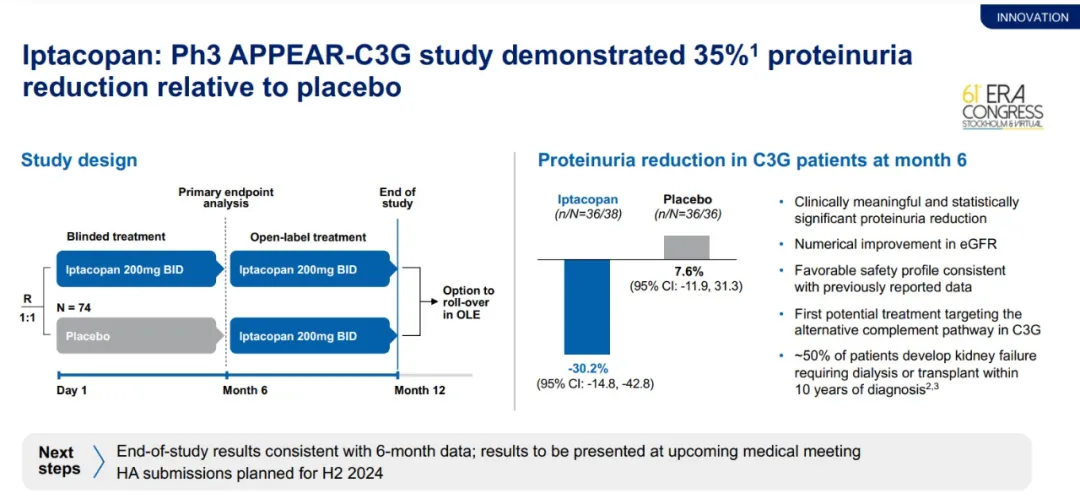
▲Fabhalta显著降低C3G患者的蛋白尿水平(图片来源:诺华公司官网)
诺华公司还在开展多项临床试验,评估Fabhalta治疗狼疮性肾炎、免疫复合物介导的肾小球肾炎(IC-MPGN),非典型溶血性尿毒症综合征(aHUS),重症肌无力等适应症的疗效。这款疗法曾被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 20
20

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 20
20

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 18
18