 产业资讯
产业资讯
 ANLONG医学
ANLONG医学  2024-09-13
2024-09-13
 3621
3621
据公开资料显示,2024年7-8月共有FDA批准新适应症5条,NMPA批准新适应症5条。靶向药物新获批主要针对ALK、HER2、IDH1/2、EGFR、KRAS等靶点基因。
详细7-8月获批上市药物及药物新获批适应症见下文。
Part.1
新药速递(概括版)
Part.2
新药速递(详细版)
1. 阿来替尼
商品名:安圣莎
通用名:阿来替尼
适应症:ALK阳性的IB期至IIIA期非小细胞肺癌
临床试验:ALINA
原研公司:罗氏
获批日期:2024.06.28
获批机构:NMPA
2024年6月28日,NMPA批准阿来替尼用于ALK阳性的IB期至IIIA期非小细胞肺癌(NSCLC)患者术后辅助治疗。此前,NMPA已批准阿来替尼用于治疗ALK阳性的局部晚期或转移性NSCLC。此次阿来替尼新适应症的获批,填补了国内ALK阳性早期肺癌治疗领域的空白,也标志着阿来替尼成为了目前国内首个同时覆盖早期和晚期的ALK-TKI。
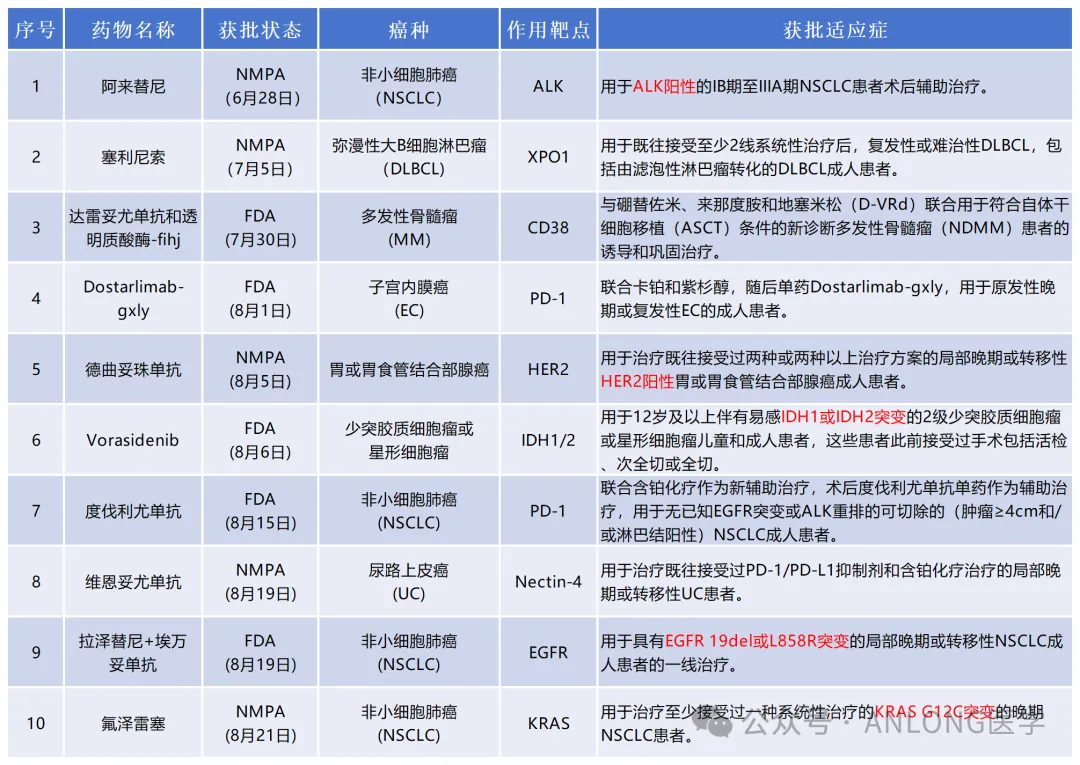
本次获批是基于一项国际多中心、开放标签、随机、III期临床试验ALINA,旨在评估阿来替尼对比含铂化疗辅助治疗术后ALK阳性的NSCLC患者的疗效和安全性。研究共纳入了257例IB-IIIA期且成功接受手术切除的ALK阳性NSCLC患者,以上患者随机1:1分配到阿来替尼辅助治疗组和含铂化疗辅助治疗组。研究主要终点为研究者评估的无病生存期(DFS),其他终点包括中枢神经系统无病生存期(CNS-DFS)、总生存(OS)及安全性。
结果显示,阿来替尼2年DFS率和3年DFS率都优于化疗组(2年:93.6%vs. 63.7%;3年:88.7%vs. 54%),对比辅助化疗,阿来替尼辅助治疗可降低ALK阳性早期NSCLC患者76%的复发或死亡风险(HR:0.24,P<0.001);其次,阿来替尼在颅内也展示着优越的疗效,可以降低中枢神经系统78%的复发或死亡风险(HR:0.22)。安全性方面,阿来替尼展现出了完全可控的安全性特征:治疗期间只有5%的患者因不良事件退出治疗;健康相关生活质量(HRQoL)分析结果显示,接受阿来替尼治疗的患者,心理状态和生理状态都得到快速恢复;在2年治疗中,心理和生理状态均保持改善,与健康人群无异。
ALINA研究数据
2. 塞利尼索
商品名:希维奥
通用名:塞利尼索
适应症:复发性或难治性弥漫性大B细胞淋巴瘤
临床试验:SEARCH
原研公司:德琪医药
获批日期:2024.07.05
获批机构:NMPA
2024年7月5日,NMPA批准塞利尼索用于既往接受至少2线系统性治疗后,复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL),包括由滤泡性淋巴瘤转化的DLBCL成人患者。塞利尼索是一款口服选择性核输出蛋白(XPO1)抑制剂。通过抑制核输出蛋白XPO1,塞利尼索可促使肿瘤抑制蛋白和其他生长调节蛋白的核内储留和活化,并下调细胞浆内多种致癌蛋白水平,从而达到抗肿瘤的效果。此前,NMPA已批准塞利尼索用于既往接受过治疗且对至少一种蛋白酶体抑制剂,一种免疫调节剂以及一种抗CD38单克隆抗体药物难治的复发/难治性多发性骨髓瘤(R/R MM)成人患者。
本次获批基于一项中国注册性临床试验SEARCH (NCT03992339),该研究共入组60例中国DLBCL患者,所有受试者由中心放射影像实验室评估的总体缓解率(ORR)达到试验预设的主要终点。研究结果表明,塞利尼索单药口服在中国受试者中具有明确的临床疗效,包括显著的缓解率、持久的缓解时间和生存期。
3. 达雷妥尤单抗和透明质酸酶-fihj
商品名:Darzalex Faspro
通用名:达雷妥尤单抗和透明质酸酶-fihj
适应症:新诊断多发性骨髓瘤
临床试验:PERSEUS
原研公司:强生
获批日期:2024.07.30
获批机构:FDA
2024年7月30日,FDA批准达雷妥尤单抗和透明质酸酶-fihj与硼替佐米、来那度胺和地塞米松(D-VRd)联合用于符合自体干细胞移植(ASCT)条件的新诊断多发性骨髓瘤(NDMM)患者的诱导和巩固治疗。
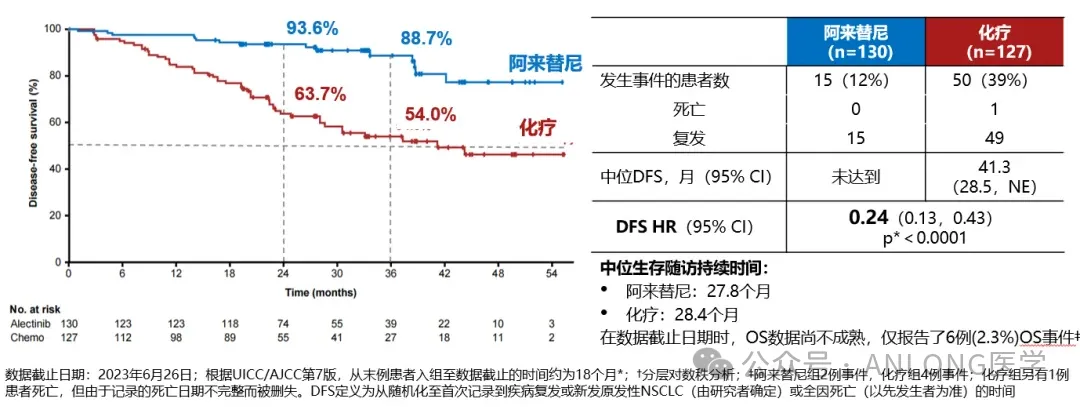
本次获批是基于一项随机、开放标签的临床试验PERSEUS (NCT03710603),研究纳入了70岁及以下的符合自体干细胞移植条件的新诊断多发性骨髓瘤患者,随机1:1分配到达雷妥尤单抗和透明质酸酶-fihj联合硼替佐米、来那度胺和地塞米松治疗组(D-VRd)及硼替佐米、来那度胺和地塞米松治疗组(VRd),主要疗效结果指标是独立审查委员会(IRC)基于国际骨髓瘤工作组(IMWG)缓解标准评估的无进展生存期(PFS)。
结果显示,D-VRd组的PFS优于VRd组,两组中位PFS均未达到;与VRd相比,D-VRd治疗可使疾病进展或死亡风险降低60%(HR [95% CI]: 0.40 [0.29, 0.57];p<0.0001);此外,D-VRd组的完全缓解率(CR)为44.5%,高于VRd组的34.7%;D-VRd组的微小残留病灶(MRD)阴性率显著高于VRd组(57.5%vs. 32.5%)。安全性方面,接受 D-VRd 治疗的患者最常见的(≥20%)不良反应为周围神经病变、乏力、水肿、发热、上呼吸道感染、便秘、腹泻、肌肉骨骼疼痛、失眠和皮疹。
PERSEUS研究数据
4. Dostarlimab-gxly
商品名:Jemperli
通用名:Dostarlimab-gxly
适应症:原发性晚期或复发性子宫内膜癌
临床试验:RUBY
原研公司:葛兰素史克(GSK)
获批日期:2024.08.01
获批机构:FDA
2024年8月1日,FDA批准Dostarlimab-gxly联合卡铂和紫杉醇,随后单药Dostarlimab-gxly,用于原发性晚期或复发性子宫内膜癌(EC)的成人患者。此前,FDA已批准Dostarlimab-gxly联合卡铂和紫杉醇,随后单药Dostarlimab-gxly,用于dMMR/MSI-H的原发性晚期或复发性子宫内膜癌患者。此次获批扩大了Dostarlimab-gxly联合化疗的适应症,涵盖了pMMR/MSS肿瘤患者,这类患者占子宫内膜癌的70~75%,且治疗选择有限。
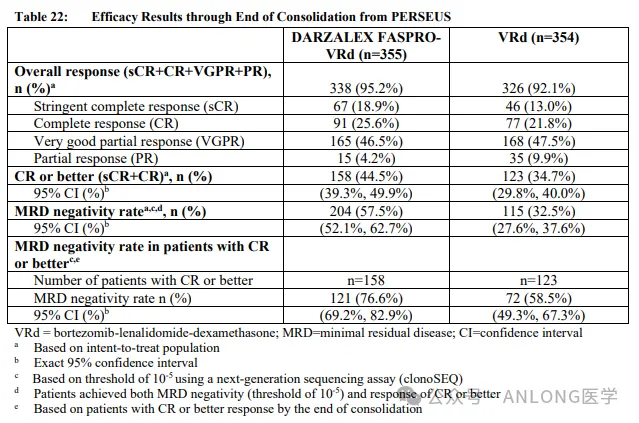
本次获批基于一项多中心、随机、双盲、安慰剂对照的临床试验RUBY(NCT03981796),研究纳入494例原发性晚期或复发性EC患者,随机1:1分配到Dostarlimab-gxly组(先Dostarlimab-gxly联合卡铂和紫杉醇,随后Dostarlimab-gxly单药治疗)及安慰剂组(先安慰剂联合卡铂和紫杉醇,随后安慰剂治疗),该研究主要疗效结局指标是根据RECIST v1.1评估的无进展生存期(PFS)及总生存期(OS)。
结果显示,不考虑MMR和MSI状态情况下,Dostarlimab-gxly组的中位OS显著高于安慰剂组(44.6个月vs. 28.2个月);Dostarlimab-gxly组和安慰剂组的中位PFS分别为11.8个月和7.9个月。针对pMMR/MSS的EC患者,Dostarlimab-gxly组的中位OS也高于安慰剂组(32.5个月vs. 28.2个月),中位PFS也相对较长(9.8个月vs. 7.9个月)。安全性方面,Dostarlimab-gxly组的安全性特征与已知的各个单一药物的安全性特征总体一致;接受Dostarlimab-gxly联合化疗治疗的患者中,最常见的治疗相关不良事件(≥20%)包括恶心、脱发、疲劳、周围神经病变、贫血、关节痛、便秘、腹泻、肌痛、皮疹、低镁血症、食欲减退、周围感觉神经病变和呕吐。
RUBY研究数据
5. 德曲妥珠单抗
商品名:优赫得
通用名:德曲妥珠单抗
适应症:HER2阳性胃或胃食管结合部腺癌成人患者
临床试验:DESTINY-Gastric06
原研公司:阿斯利康、第一三共
获批日期:2024.08.05
获批机构:NMPA
2024年8月5日,NMPA批准德曲妥珠单抗用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性胃或胃食管结合部腺癌成人患者。这是德曲妥珠单抗在国内获批的第3项重磅适应症。此前,NMPA批准其单药用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性乳腺癌成人患者;NMPA批准其单药用于治疗既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的,不可切除或转移性HER2低表达(IHC 1+或IHC 2+/ISH-)乳腺癌成人患者。
本次获批基于一项开放标签、单臂、II期的中国桥接试验DESTINY-Gastric06(NCT04989816),研究纳入了95例既往接受过至少两种治疗方案(包括氟嘧啶和铂类药物)的HER2阳性(IHC3+或IHC2+/ISH+)晚期胃/胃食管结合部腺癌患者,以上患者接受德曲妥珠单抗治疗,主要研究终点为独立中心评审(ICR)根据RECIST v1.1评估确认的客观缓解率(ORR),次要终点包括研究者评估(INV)确认的ORR、缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)以及安全性和耐受性。
结果显示,中位随访时间8.0个月时,ICR确认的德曲妥珠单抗治疗组的ORR为28.8%,INV确认的ORR为35.6%;中位DoR、OS和PFS分别为7.9个月、10.2个月和5.7个月。安全性方面,3.2%的患者因药物相关AE而停止治疗,5.3%患者因COVID-19相关AE而停止治疗;与药物相关的间质性肺病/肺炎发生率为3.2%,且均为1-2级。
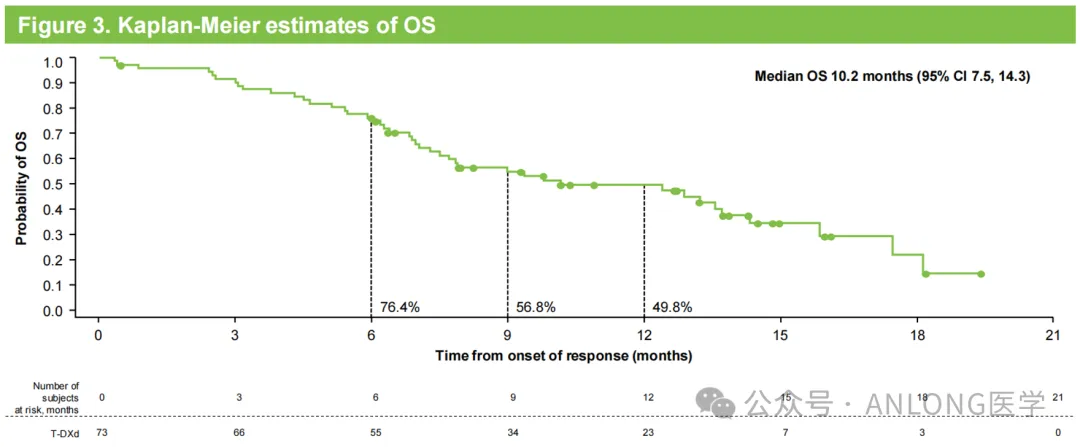
DESTINY-Gastric06研究数据
6. Vorasidenib
商品名:Voranigo
通用名:Vorasidenib
适应症:IDH1或IDH2突变的2级少突胶质细胞瘤或星形细胞瘤
临床试验:INDIGO(Study AG881-C-004)
原研公司:施维雅
获批日期:2024.08.06
获批机构:FDA
2024年8月6日,FDA批准Vorasidenib用于12岁及以上伴有易感IDH1或IDH2突变的2级少突胶质细胞瘤或星形细胞瘤儿童和成人患者,这些患者此前接受过手术包括活检、次全切或全切。这是FDA首次批准的可用于这类患者的全身疗法。
本次获批是基于一项随机、多中心、双盲、安慰剂对照的临床试验INDIGO(NCT04164901),研究纳入了331伴有IDH1或IDH2突变的2级少突胶质细胞瘤或星形细胞瘤患者,他(她)们之前进行过手术(包括活检、次全切除术或全切除术),以上患者随机1:1分配到Vorasidenib治疗组和安慰剂治疗组,主要疗效终点是无进展生存期(PFS),关键次要终点为至下一次干预时间(TTNI)。
结果显示,对比安慰剂治疗组,Vorasidenib治疗能够显著延长患者PFS(27.7个月vs. 11.1个月;HR=0.39;95% CI:[0.27, 0.56],p<0.0001)。此外,Vorasidenib组中位TTNI未达到,安慰剂组的中位TTNI为17.8个月(HR=0.26;95% CI:[0.15, 0.43],p<0.0001)。安全性方面,研究最常见的(≥15%)不良反应是疲劳、头痛、covid-19感染、肌肉骨骼疼痛、腹泻、恶心和癫痫发作;最常见的3级或4级实验室异常(>2%)是丙氨酸氨基转移酶升高、天冬氨酸氨基转移酶升高、GGT升高和中性粒细胞减少。

INDIGO研究数据
7. 度伐利尤单抗
商品名:英飞凡
通用名:度伐利尤单抗
适应症:无EGFR突变或ALK重排的可切除非小细胞肺癌围手术期治疗
临床试验:AEGEAN
原研公司:阿斯利康
获批日期:2024.08.15
获批机构:FDA
2024年8月15日,FDA批准度伐利尤单抗联合含铂化疗作为新辅助治疗,术后度伐利尤单抗单药作为辅助治疗,用于无已知EGFR突变或ALK重排的可切除的(肿瘤≥4cm和/或淋巴结阳性)NSCLC成人患者。
本次获批是基于一项随机、双盲、安慰剂对照、多中心试验AEGEAN( NCT03800134 ),根据AJCC第8版标准,研究纳入了未经治疗、可切除且不携带已知EGFR突变或ALK重排的IIA至IIIB期NSCLC患者,以上患者随机1:1分配到实验组(度伐利尤单抗联合含铂化疗新辅助治疗,度伐利尤单抗辅助治疗)和对照组(安慰剂联合含铂化疗新辅助治疗,安慰剂辅助治疗),研究的主要终点是由盲法中心病理实验室确定的病理学完全缓解率(pCR)和盲法独立中心审查(BICR)确定的无事件生存期(EFS)。
结果显示,实验组的中位EFS未达到(95%CI,31.9-NR),对照组的中位EFS为25.9个月(95%CI,18.9-NR)(HR=0.68;95%CI,0.53-0.88);对比对照组,实验组的pCR更优(17.2%vs. 4.3%),两组反映出绝对差异为12.9%(95% CI,8.7%-17.6%;P< 0.0001)。安全性方面,两组3-4级不良事件的发生率相当(42.4%vs. 43.2%),最常见的不良反应(≥20%)是贫血、恶心、便秘、疲劳、肌肉骨骼疼痛和皮疹;在接受度伐利尤单抗新辅助治疗的患者中,1.7%因不良反应而无法接受手术,而安慰剂组为1%。
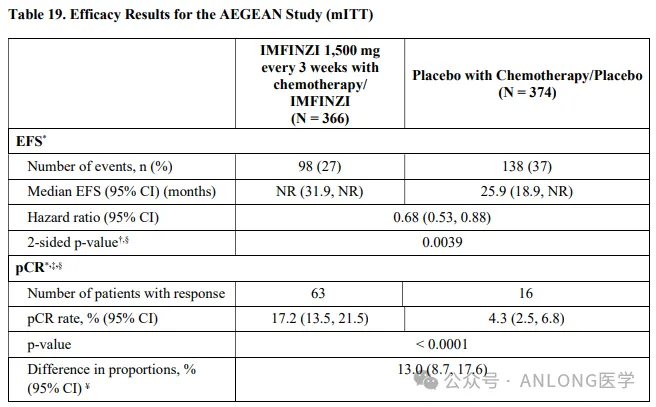
AEGEAN研究数据
8. 维恩妥尤单抗
商品名:Padcev
通用名:维恩妥尤单抗
适应症:接受过PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌
临床试验:EV-203
原研公司:安斯泰来、辉瑞
获批日期:2024.08.19
获批机构:NMPA
2024年8月19日,NMPA批准维恩妥尤单抗用于治疗既往接受过PD-1/PD-L1抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌(mUC)患者。维恩妥尤单抗是全球首个获批的Nectin-4靶向ADC药物,此前,国外已经获批其用于局部晚期或转移性尿路上皮癌患者中,本次获批也使其成为了首个在国内获批的Nectin-4靶向ADC药物。
本次获批是基于一项在中国开展的单臂、开放标签、多中心的II期桥接临床试验EV-203 (NCT04995419),该研究纳入了40例既往接受过含铂化疗和PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌中国患者,旨在评估维恩妥尤单抗治疗以上患者的疗效、安全性和药代动力学特征,主要终点是独立审查委员会(IRC) 确认的客观缓解率(ORR)。
结果显示,IRC评估的ORR为37.5%,其中1位患者达到完全缓解(CR),14位患者达到部分缓解(PR),IRC 评估的疾病控制率(DCR)为 72.5%;研究者评估的ORR为42.5%,DCR为 82.5%。安全性方面,研究中未发现新的安全性信号,大多数治疗相关的不良反应多为1-2级,2例患者因治疗相关不良反应(急性冠状动脉综合征和高血糖/皮疹)而停药。

EV-203研究数据
9. 拉泽替尼+埃万妥单抗
商品名:Leclaza+Rybrevant
通用名:拉泽替尼(Lazertinib)+埃万妥单抗(Amivantamab-vmjw)
适应症:EGFR 19del或L858R突变的局部晚期或转移性非小细胞肺癌
临床试验:MARIPOSA
原研公司:强生
获批日期:2024.08.19
获批机构:FDA
2024年8月19日,FDA批准拉泽替尼(Lazertinib) 联合埃万妥单抗(Amivantamab-vmjw)用于具有EGFR 19del或L858R突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
本次获批基于一项随机、阳性药物对照、多中心的III期临床试验MARIPOSA(NCT04487080),研究纳入了1074例既往未经治疗的EGFR 19del或L858R突变的局部晚期或转移性NSCLC患者,随机2:2:1分配到拉泽替尼+埃万妥单抗治疗组、奥希替尼单药治疗组或拉泽替尼单药治疗组,研究的主要终点是由独立盲法中心评估的无进展生存期(PFS),次要终点包括客观缓解率(ORR)、缓解持续时间(DoR)和安全性。
结果显示,拉泽替尼+埃万妥单抗组和奥希替尼组的中位PFS分别为23.7个月和16.6个月(HR=0.70,P<0.001);无论患者是否伴脑转,拉泽替尼+埃万妥单抗组的PFS获益一致(HR均为0.69);拉泽替尼+埃万妥单抗组和奥希替尼组的ORR分别为78%和73%;在确认达到缓解的患者中,拉泽替尼+埃万妥单抗组的中位DoR优于奥希替尼组(25.8个月vs. 16.7个月)。安全性方面,联合治疗组和奥希替尼组因治疗相关不良事件(TRAE)导致停药的发生率分别为10%和3%,联合治疗组最常见的AE包括甲沟炎(68%;≥3级为11%)和输液相关反应(63%;≥3级为6%);静脉血栓栓塞(VTE)是特别关注的AE,多为1-2级,且大多数VTE发生在拉泽替尼+埃万妥单抗治疗开始后4个月内,并通过抗凝治疗得到了有效控制。
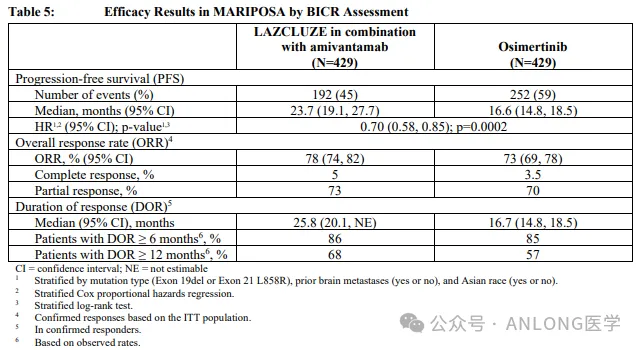
MARIPOSA研究数据
10. 氟泽雷塞
商品名:达伯特
通用名:氟泽雷塞
适应症:至少接受过一种系统性治疗的KRAS G12C突变的晚期非小细胞肺癌
临床试验:NCT05005234
原研公司:信达生物、劲方医药
获批日期:2024.08.21
获批机构:NMPA
2024年8月21日,NMPA批准氟泽雷塞用于治疗至少接受过一种系统性治疗的KRAS G12C突变的晚期非小细胞肺癌(NSCLC)。截至到目前,全球范围内目前共有3款KRAS G12C抑制剂获批上市,分别为安进的索托拉西布(Sotorasib)、百时美施贵宝的阿达格拉西(Adagrasib)、信达/劲方医药的氟泽雷塞(Fulzerasib)。本次获批药物氟泽雷塞不仅是首个在国内获批的KRAS抑制剂,也是全球范围内首个获批上市的国产KRAS抑制剂。
本次获批是基于一项在中国开展的临床II期单臂注册研究(NCT05005234),旨在评估氟泽雷塞单药在标准治疗失败或不耐受且携带KRAS G12C突变的晚期NSCLC患者中的安全性、耐受性和疗效。
结果显示,经独立影像学评审委员会(IRRC)评估的患者的客观缓解率(ORR)达 49.1%,高于此前已获批的两款KRAS G12C抑制剂的ORR(Sotorasib:32.7%;Adagrasib:43%);疾病控制率(DCR)达 90.5% ;中位缓解持续时间(DoR)未达到;中位无进展生存期(mPFS)为 9.7 个月;中位生存期(OS)尚未达到。亚组分析显示,各亚组在氟泽雷塞单药治疗中基本取得一致获益,包括预后较差的脑转移患者,35例(30.2%)基线脑转移患者经IRRC确认的ORR为48.6%,DCR为94.3%;81例基线无脑转移患者经IRRC确认的ORR为49.4%,DCR为88.9%,两者肿瘤应答状况相似;与脑转移患者相比,基线无脑转移患者的mPFS较好(10.4个月vs. 6.4个月)。安全性方面,患者总体安全性良好,共有90.5%(105/116)的受试者发生治疗相关不良事件(TRAE),大部分为1-2级,最常见的TRAEs为贫血、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、乏力和蛋白尿,40.5%的受试者发生3级及以上TRAEs。
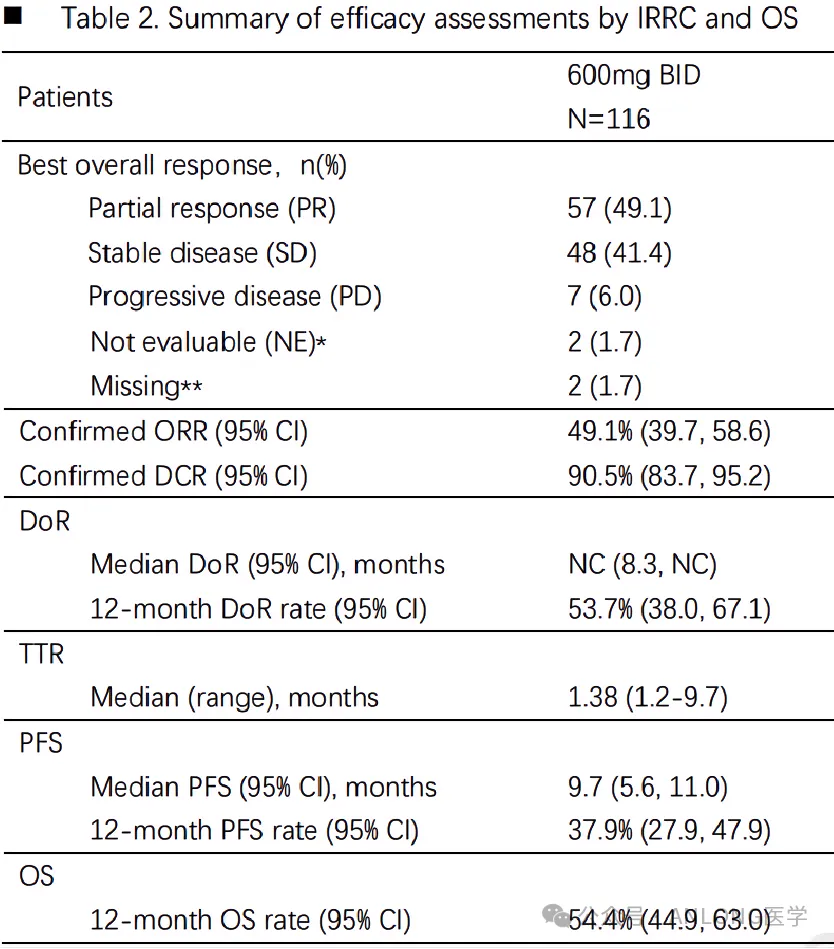
临床研究数据

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 99
99

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 89
89

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 78
78