 产业资讯
产业资讯
 药通社
药通社  2024-09-27
2024-09-27
 2865
2865
9月25日,CDE承办了磷酸芦可替尼乳膏进口上市申请,受理号JXHS2400073,持有人Incyte Biosciences,从康哲药业公告看出此次申报的是白癜风适应症。


补充一下,康哲药业是2022年底从Incyte引进磷酸芦可替尼乳膏中国权益,算是根据企业(康哲美丽)自身优势和战略发展License in的典型案例之一。

因为是全球进展最快的白癜风药物,笔者跟踪过这个药物已有七八年,发表的三期临床文章显示其安全且有效,是目前欧美国家唯一批准的外用白癜风复色药物。

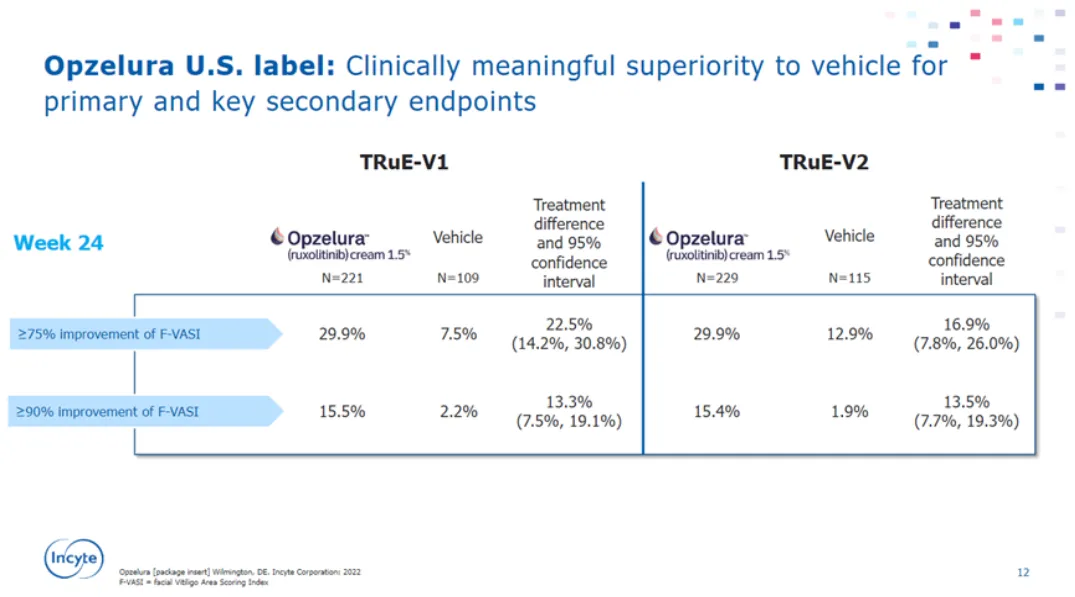
根据康哲药业公告:“芦可替尼乳膏在中国真实世界研究中取得了积极结果。治疗组主要疗效指标第24周达到F-VASI 75的患者比例为49.5%(有效性绝对百分数高于海外,预计是用药人群基线皮损面积低于海外),显著高于目标值14.1%(P<0.0001)(参考《药物真实世界研究设计与方案框架指导原则(试行)》中目标值对照的定义),研究达到了主要终点,证明产品能够有效治疗非节段型白癜风患者,缩小皮损面积,恢复肤色。
所有的次要疗效指标均显示出与主要疗效指标一致的获益趋势,且治疗时间越长,患者的白癜风治疗效果持续改善。不良反应的严重程度大部分均为1级或2级,未发生导致停药或退出的不良事件(AE),未发生研究药物相关的严重不良事件(SAE)。”根据康哲半年报:“已超过3200例患者使用了芦可替尼乳膏进行治疗”。预计是原研基于白癜风治疗真实世界研究,干预性研究实用临床试验(Pragmatic Clinical Trial,PCT)单臂设计,获得药物的有效性和安全性信息,为新药注册上市提供支持性证据。受益于国家赋予海南自由贸易港、博鳌乐成国际医疗旅游先行区(先行先試)特许政策外,同时看到Incyte和康哲美丽在CDE登记了白癜风和特应性皮炎两个适应症的注册性三期临床研究(CTR20241697、CTR20240457)。
1)真实世界研
究国家药监局药品审评中心自2018年开始启动真实世界研究相关工作,近几年在制定技术指导原则、开展应用试点以及建立工作机制等方面取得积极成效,如:《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》、《药物真实世界研究设计与方案框架指导原则(试行)》、《用于产生真实世界证据的真实世界数据指导原则(试行)》、《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》、《真实世界证据支持药物研发与审评的指导原则(试行)》;已批准多个完全基于真实世界研究申报上市的新药,如:氟轻松玻璃体植入剂、普拉替尼等。
2)仿制扎堆
就凭中国有约1400万白癜风患者,约2300万轻中度特应性皮炎患者,兼有医美概念,市场潜力巨大,企业扎堆是必然的。磷酸芦可替尼乳膏算是近两年企业立项布局的重点品种,无论是传统外用企业,如重庆华邦制药有限公司、江苏知原药业股份有限公司,还是高效率产出的CXO,如苏州高迈、杭州领业、长沙晶易、南京樟益等,笔者猜测都应该在做了吧!该品种除了Q1、Q2、Q3研究难度外,临床开发路径也是很多仿制企业一直很关心的问题。
3)临床怎么做
目前原研正在申请进口中,仿制分为3类和4类。临床试验设计与前两年的热门品种克立硼罗做过健康人的BE是不一样的。重庆华邦制药有限公司抢先一步已按3类境内申请人仿制境外上市但境内未上市原研药品的药品申请临床,由于芦可替尼乳膏在健康人皮肤给药预计没有暴露,按3类申请取得临床试验通知书后需要做验证性三期临床,由于原研有多个适应症,理论上应该每个适应症都需要做验证性临床。方案设计可以参照目前原研在中国开展的临床试验。
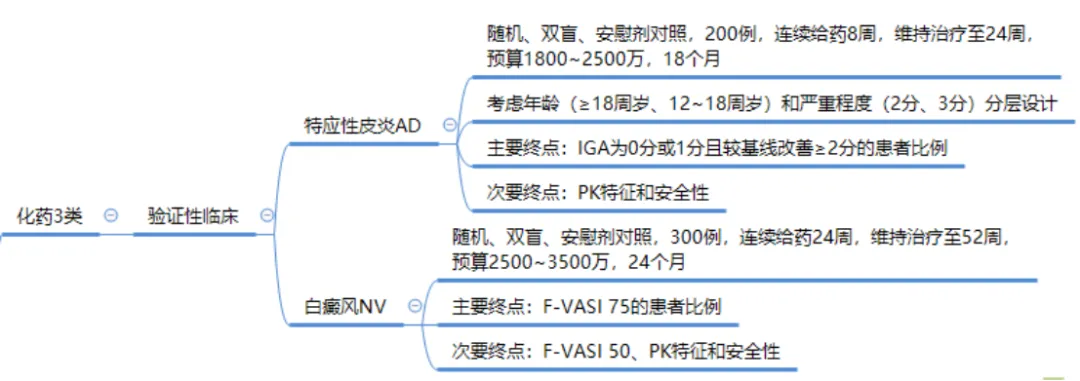
笔者认为原研此次申请进口上市是可以申请优先审评,预计一年时间左右批准,大多数企业可能要按照4类境内申请人仿制已在境内上市原研药品的药品申请了。可以参考FDA个药指南《Draft Guidance on Ruxolitinib Phosphate November 2023 》进行临床终点BE试验。由于原研先申请白癜风适应症,如果明年顺利获批,后续企业可能需要做白癜风的临床终点BE三臂试验,费用和周期较3类仿制是没有优势的,估计多数仿制药企业在此可能会项目终止。所以仿制企业还是赶在原研批准之前赶紧申报吧!

注:以上设计是笔者基于对该品种和现有法规的认知进行推测,有不对之处,请行业老师批评指正。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 114
114

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 103
103

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 93
93