 产业资讯
产业资讯
 猎药人俱乐部
猎药人俱乐部  2024-10-15
2024-10-15
 1755
1755
2024年6月,根据复旦大学药学院披露,该学院联合华东师范大学与生物制药公司Supercede Therapeutics(简称“Supercede”)就抗肿瘤恶病质与增肌领域的创新药物达成一项全球权益合作。基于本次合作,Supercede将获得复旦大学和华东师范大学共同研发的处于临床前的小分子抗肿瘤恶病质肌萎缩、肌少症和增肌创新药物(STX-001)全球开发和商业化权益,复旦大学和华东师范大学将有资格获得最高可达近1亿美元的首付款和开发、监管和商业化里程碑付款,以及未来基于全球年度销售净额的梯度特许权使用费。
恶性肿瘤已成为危害人类健康最严重的疾病之一,且发病率呈不断上升趋势;随着肿瘤治疗相关研究的不断进步和发展,肿瘤患者的生存率和生存期都得到了显著提高,趋于“慢病化”。治疗重点从延长患者的生存时间,逐步演变为提高患者的生活质量。作为一种常见的并发症,恶病质常见于晚期恶性肿瘤患者,以及严重消耗疾病患者,例如类风湿关节炎、充血性心衰、败血症、慢性肾病、慢性肠炎以及慢性阻塞性肺炎等。其中,以各种恶性肿瘤患者并发的恶病质最为常见,称为肿瘤恶病质。
临床表现
作为一种进行性的代谢紊乱综合征,肿瘤恶病质患者往往伴随着体重急速下降、肌肉与脂肪组织的持续丢失以及多器官功能障碍;绝大多数都会出现消瘦、贫血、食欲减退以及精神颓废等现象,不仅严重影响了患者的生存质量,且很大程度上削弱限制了化、放疗的效果,甚至缩短患者的生存期。因此,肿瘤恶病质作为恶性肿瘤患者的主要并发症,严重威胁着众多肿瘤患者的生存,逐渐成为肿瘤综合治疗领域中不可或缺的一环。
发病人数及市场情况
据统计,在晚期恶性肿瘤患者中,约50%-80%的患者会经历不同程度的恶病质,其中胰腺癌与胃癌发生率最高,达80%;其次是肺癌、结肠癌以及前列腺癌,约为50%,而白血病与乳腺癌相对较低,约为40%。据统计报告显示,约30%的肿瘤患者死因可直接归结为肿瘤恶病质,这也使肿瘤恶病质成为了众多肿瘤患者死亡的主要原因。
研究表明,在美国和欧洲,恶病质患病率在肿瘤人群中高达30%,针对恶病质的癌症药物将成为癌症患者的基础、长期用药;按每位病人每年1.6万美元(欧美)和0.4万美元(中国)计算,中美欧市场规模超过248亿美元。
致病机制
全身多个器官都直接或间接地参与到肿瘤恶病质的发生发展过程中,主要涉及能量代谢紊乱、食欲减退、骨骼肌与脂肪损耗、系统炎症反应以及多器官综合症。其中,促恶病质因子可以通过增加骨骼肌细胞的凋亡,损伤细胞的再生能力以及激活泛素化蛋白酶系统(UPS)促进骨骼肌细胞蛋白的分解代谢,从而诱导骨骼肌发生萎缩;同时,被异常激活的脂肪酶,如激素敏感性脂肪酶(HSL)、脂蛋白酶(LPL)以及甘油三酯脂酶(ATGL)等,会促进脂肪的分解;而线粒体的能量代谢异常则会促进白色脂肪褐色化,加剧脂肪动员,进一步介导机体脂肪的丢失。肿瘤恶病质患者的摄食中枢受到抑制,导致食欲减退,从而影响患者的摄食量;患者出现的肠道菌群失调而导致的胆汁酸代谢异常,也会诱发恶病质的发生;肿瘤恶病质患者也经常出现严重的心肺功能紊乱现象,包括疲劳乏力、呼吸短促以及运动耐力受损等。肿瘤恶病质的致病机理十分的复杂多样,对肿瘤恶病质发病机理进行全面而深入的研究,有助于推动抗肿瘤恶病质新药研发工作。
关于Skysona
虽然肿瘤恶病质得到越来越多的重视与关注,但针对性的治疗策略和新药的研发尚无突破性的进展,整体治疗现状不容乐观,除2021 年在日本被批准上市的阿拉莫林外,目前为止尚无其他特异性针对肿瘤恶病质的药物被批准上市。
目前,临床上通常采取营养补充、食欲刺激以及对促恶病质因子(主要是促炎因子)的抑制等常规手段,来缓解肿瘤恶病质。例如,临床上应用Omega-3 脂肪酸对头颈癌患者进行营养补充,孕激素(如甲地孕酮与甲羟孕酮等)常被临床上用来达到刺激食欲的目的,然而这些常规的干预手段对肿瘤恶病质的治疗效果却十分有限。除此以外,通过靶向促恶病质炎症因子开发的特异性药物,如针对TNF-α开发的单抗infliximab以及针对IL-6开发的单抗clazakizumab亦不能有效改善肿瘤恶病质。
据统计,目前肾上腺素β受体阻滞剂、选择性雄性激素受体(AR)激动剂、胃饥饿素受体(GHSR)激动剂以及肌肉生长抑制素(myostatin)拮抗剂、GDF15/GFRAL等都是该领域的研究热点。
目前处于临床以上阶段的研究药物
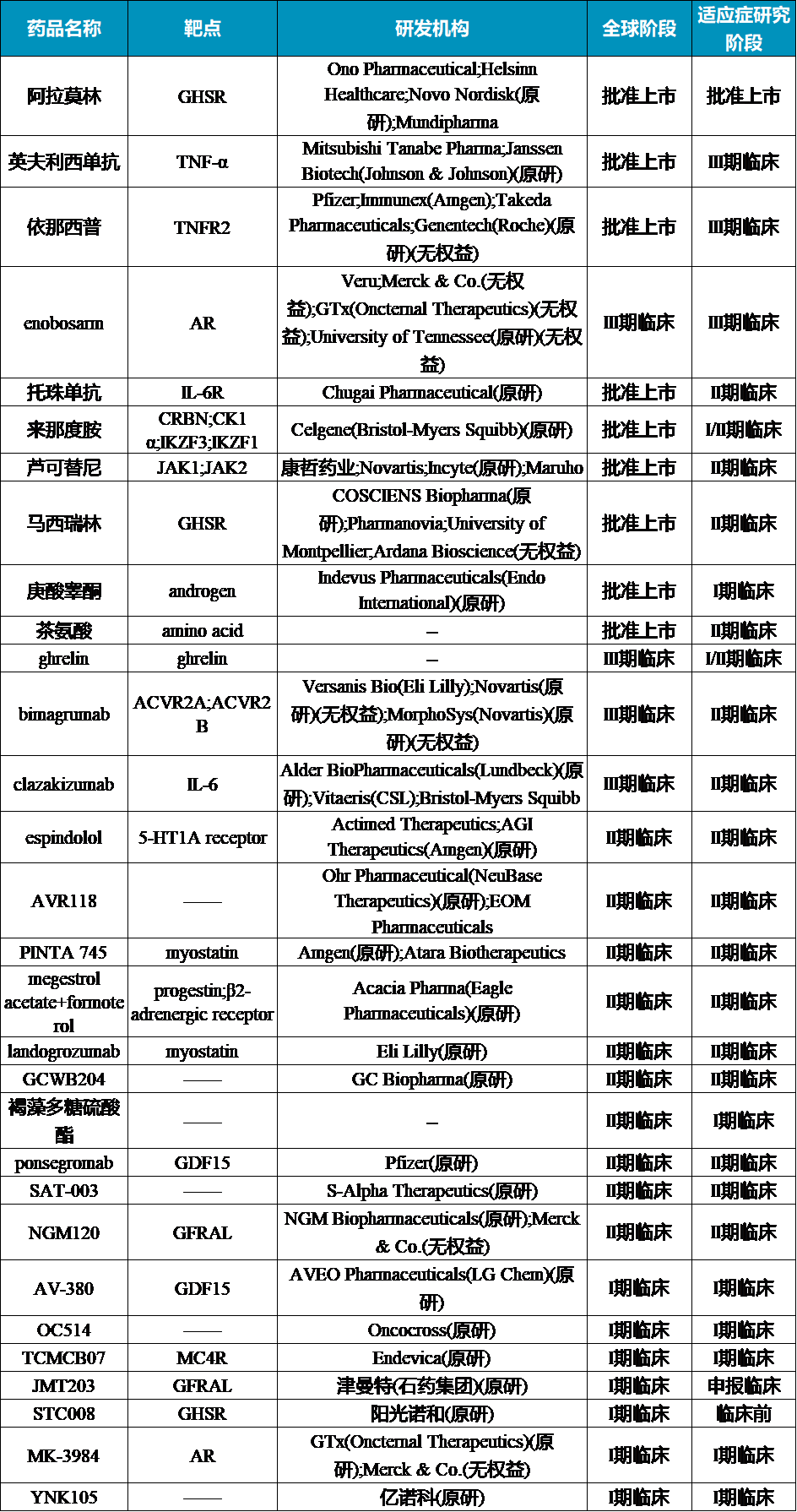
部分药物的最新进展
(1)GHSR激动剂:阿拉莫林
阿拉莫林是一种高效的选择性胃饥饿素(Ghrelin)受体激动剂,通过激活胃饥饿素受体来促进食欲,同时促进肌肉蛋白质合成,有助于增加体重和肌肉质量。该药物于2020年12月获得日本厚生劳动省的正式批准,适用于治疗非小细胞肺癌、胃癌、胰腺癌以及结直肠癌伴随的恶病质症状,并在2021年4月正式在日本市场上市。
阿那莫林的批准是基于在日本进行的两项关键临床研究的结果。其中一项针对非小细胞肺癌患者的II期多中心、随机、双盲、安慰剂对照的平行组研究(ONO-7643-04),显示与安慰剂组相比,接受阿那莫林治疗的患者肌肉组织含量在12周内显著增加,从第3周开始,阿那莫林治疗组患者的肌肉增量相较于安慰剂组增加1.56公斤。此外,患者从治疗的第一周开始体重就有明显增加,且这种增加在整个治疗期间持续进行;与安慰剂组相比,体重增加更为显著。
(2)ActRII药物:bimagrumab、STX-001
Bimagrumab(M24625)是一种靶向Activin 受体 II 型 (ActRII) A/B 的全人源单克隆抗体,通过与ActRIIB结合,阻止肌肉生长的负调节因子Myostatin与其受体ActRIIB的相互作用,进而促进肌肉细胞的生长和分化。该药物最早由Versanis Bio开发,后该公司被礼来以20亿美金收购。Ⅱa 期研究发布的48周数据显示,bimagrumab使肥胖和2 型糖尿病患者的瘦体重(肌肉)增加了4.5%,同时脂肪量减少了21.9%。
而2024年6月,Supercede斥资近1亿美元获得的由复旦大学和华东师范大学共同研发的临床前的小分子药物STX-001,也是一款ActRII抑制剂。
(3)β1/β2受体拮抗剂:espindolol
Espindolol 是一种非特异性的β1/β2受体拮抗剂,与β肾上腺素能和中枢5-羟色胺1α受体相互作用,发挥促合成代谢、抗分解代谢和刺激食欲的功能。II 期ACT-ONE 试验评估了espindolol在 III 期或 IV 期结直肠癌或非小细胞肺癌相关恶病质患者中的疗效,主要终点是评估16 周内高剂量 espindolol 和安慰剂之间体重变化率的差异 ;结果显示espindolol产生了具有统计学和临床意义的体重增加,其中高剂量 espindolol 使瘦体重增加具有统计学意义,不同剂量治疗组之间的安全信号或生存率没有临床显着差异。
(4)GDF15单抗:ponsegromab
Ponsegromab(PF-06946860)是一种强效、高选择性的人源化单克隆抗体,可与循环生长分化因子15(GDF-15)结合,从而抑制其与神经营养因子家族受体α样蛋白(GFRAL)受体的相互作用。GDF-15是一种应激诱导细胞因子,可与后脑中的神经胶质细胞衍生的GFRAL结合;GDF-15-GFRAL通路已成为厌食症和体重调节的主要调节因子,且与恶病质的发病机制有关。
一项在11个国家的74个地点进行的随机、双盲、安慰剂对照、剂量范围试验,将患者按1:1:1:1的比例随机分配接受100 mg、200 mg或400 mg剂量的ponsegromab或接受安慰剂,每4周皮下注射一次,共注射3次;结果显示:(1)12周时,ponsegromab组患者的体重增加显著高于安慰剂组,100 mg组、200 mg组和400 mg组的组间差异中位数分别为1.22公斤、1.92公斤和2.81公斤。(2)与安慰剂组相比,400 mg ponsegromab组的食欲和恶病质症状以及身体活动均有所改善。(3)Ponsegromab组有70%的患者报告了各种原因的不良事件,而安慰剂组有80%的患者报告了各种原因的不良事件。
(五)GFRAL单抗:JMT203
JMT203是石药集团津曼特生物开发的抗GDNF家族受体蛋白(GFRAL)重组人源化单克隆抗体,能有效拮抗GDF15-GFRAL/RET信号,具有食欲和代谢调节作用,可潜在逆转或者减轻由肿瘤以及化疗药物引起的体重降低、厌食和肌肉萎缩等恶病质症状,从而有效提高肿瘤病人的生活质量。临床前研究显示JMT203具有良好的安全性,可显著抑制恶病质小鼠的体重下降、增加非空腹血糖和前爪握力从而改善恶病质症状,进而提高恶病质小鼠的带瘤存活率;与抗肿瘤治疗联用显著增加治疗耐受性及延长生存期。
参考资料
1、顾晓帆.抗肿瘤恶病质化合物Z526临床前药理药效学研究[D].华东师范大学,2024.DOI:10.27149/d.cnki.ghdsu.2024.000304.
2、各企业官网
3、BioArtMED

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 85
85

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 74
74

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 67
67