 产业资讯
产业资讯
 药融圈
药融圈  2024-12-06
2024-12-06
 804
804
药融圈获悉:Keros Therapeutics是美国一家临床阶段的生物制药公司,专注于开发和商业化新型疗法,以治疗各种患有与TGF-β(转化生长因子-β)蛋白家族信号功能障碍相关的疾病的患者。
Keros的董事长兼CEO Jasbir Seehra博士在英国南安普敦大学获得生物化学博士学位,并在麻省理工学院完成了博士后工作。在加入Keros之前,他曾担任Ember Therapeutics的首席科学官,也曾是Acceleron Pharma(TGF-β先驱公司,被默沙东115亿美元收购)的联合创始人兼首席科学官。此前,他还曾担任惠氏生物化学副总裁,并在生物技术公司Genetics Institute(被惠氏13亿美元收购)领导了小分子先导化合物发现工作,在那里他帮助建立了小分子药物发现能力,包括药物化学、高通量筛选和结构生物学。Seehra博士是100项美国专利的发明人或共同发明人,其中包括与FDA批准的两种药物相关的专利。
2020年3月,Keros Therapeutics完成5600万美元C轮融资;2020年4月,Keros在纳斯达克上市,被视为新冠疫情期间美国第一家IPO的生物技术公司,募得资金额9600万美元。
自2015年成立以来,Keros一直专注于研究TGF-β蛋白家族的作用,对于其功能有着非常深入的理解。TGF-β蛋白家族是一个广泛而复杂的生物学领域,由30多种配体、12种受体、许多共受体和分泌调节分子组成,在组织发育和内稳态中起关键作用,是许多组织(包括血液、骨骼、骨骼肌、脂肪和心脏组织)生长、修复和维持的主要调节因子。
目前,Keros已经围绕TGF-β蛋白家族建立起了横跨血液病学、肺病学和心血管,以及肥胖和神经肌肉疾病的蛋白质疗法管线。虽然Keros还没有产品获批上市,但该公司市值已经超过了20亿美元,截至成文时2024年11月4日收盘为22.49亿美元。发稿前市值为27.46亿美元。

血液病
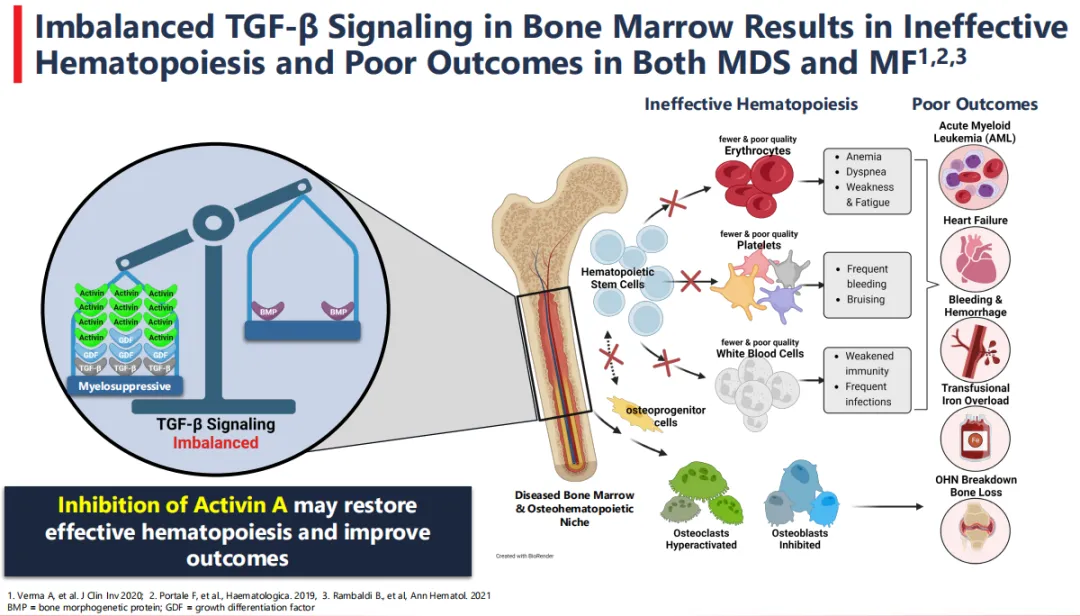
Keros首个候选产品Elritercept(KER-050),是一种“工程化的配体捕获体”,由经修饰的TGF-β受体(即激活素受体IIA型,ActRIIA)配体结合区域与人源抗体的Fc区域融合而成。KER-050正在被开发用于骨髓增生异常综合征(MDS)患者和骨髓纤维化(MF)患者血细胞减少(包括贫血和血小板减少)的治疗。
TGF-β超家族的信号转导在造血调节中十分重要,骨髓中TGF-β通路信号的失衡会导致无效造血和临床血细胞减少。KER-050旨在结合并抑制参与造血调节的TGF-β配体的信号传导,包括激活素A、激活素B和生长分化因子11,这些配体限制造血祖细胞继续分化并发育成具有特殊功能的成熟细胞。临床前研究表明,KER-050介导了针对这些调节因子的抑制作用,刺激祖细胞走向成熟,从而增加血液中成熟细胞的数量,进而有望恢复患者的有效造血并改善疾病预后。
Keros围绕Elritercept(KER-050)开展了一项分为两部分的开放标签、多次剂量递增的2期临床试验,以评估Elritercept治疗极低危、低危或中危骨髓增生异常综合征(MDS)患者贫血的疗效,无论这些患者既往是否接受过红细胞生成刺激剂治疗(NCT04419649);以及一项分为两部分的开放标签、多剂量递增的2期临床试验,以评估Elritercept作为单药疗法或与JAK抑制剂芦可替尼联合治疗骨髓纤维化(MF)患者相关血细胞减少症的疗效(RESTORE试验;NCT05037760)。
2024年6月,Keros公布了上述两项2期临床试验的额外数据。
在针对骨髓增生异常综合征(MDS)患者开展的2期试验中,患者基于前期研究推荐的2期剂量每四周一次皮下注射给药,截至2024年4月3日,有87例患者至少接受了一剂给药,其中57.5%(n=50)为高输血负担(HTB)患者,25.3%(n=22)为低输血负担,17.2%(n=15)为未输血(NT),研究观察到Elritercept在这些患者中普遍耐受性良好,治疗期间不良事件(TEAE)主要为腹泻、疲劳、呼吸困难、头晕、COVID-19、恶心和贫血。没有患者进展为急性髓系白血病。
纳入疗效分析的81例患者中,55.6%(n=45/81)的患者在治疗的最初24周内达到血液学改善-红系(HI-E)或输血独立(TI)反应(ORR),而基线促红细胞生成素(EPO)<500U/L的患者ORR达到了60.6%(n=40/66)。
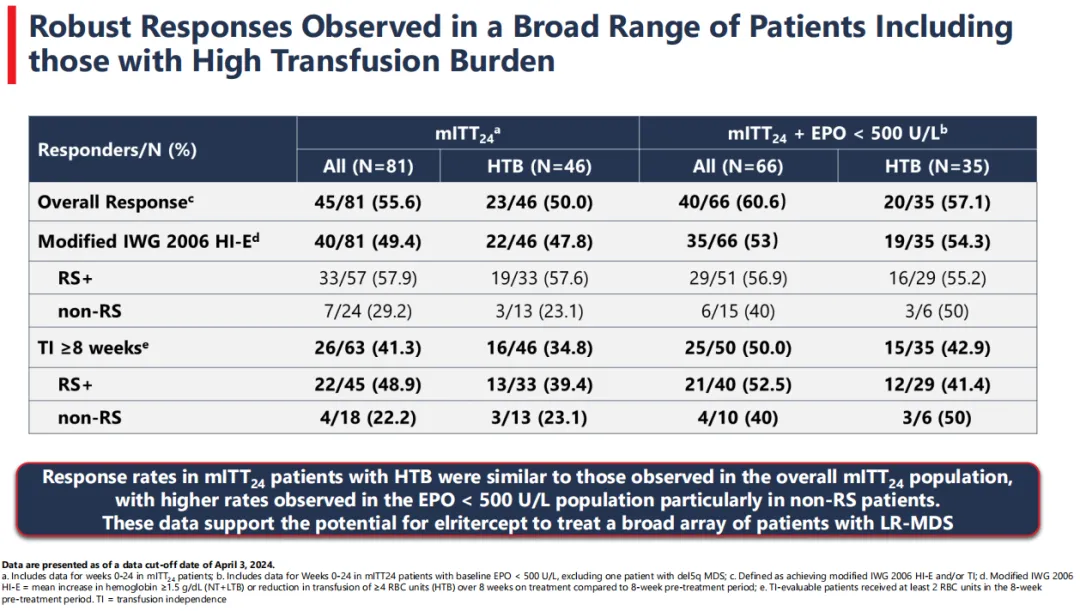
研究在广泛的低危MDS患者中继续观察到持久的TI反应,包括HTB(高输血负担)患者,这支持了Elritercept改善MDS患者多个谱系无效造血的可能性。达到TI的患者在FACIT-疲劳评分方面也显示出具有临床意义的改善,表明Elritercept有望改善低危MDS患者的生活质量。Keros预计将在2024年第四季度报告该试验的第2部分的更多数据。
据披露,Keros已经收到了来自美国FDA关于Elritercept用于治疗MDS项目的积极反馈,拟在LR-MDS患者中开展的关键性3期临床试验的设计和终点设置已经与FDA达成了总体一致。

在针对骨髓纤维化(MF)患者开展的2期RESTORE试验中,54例患者在数据截止日期之前接受了至少1剂Elritercept,这些患者对Elritercept总体耐受性良好,最常报告的治疗期间不良事件(TEAE)是血小板减少症和腹泻。
在较高剂量下,观察到患者红细胞生成标志物的增加通常更显著;单药治疗组和联合治疗组均观察到Hgb(血红蛋白浓度)升高;在两组中观察到的输血负荷降低进一步支持了Elritercept解决芦可替尼相关贫血以及潜在骨髓纤维化(MF)相关贫血的潜力。在接受3mg/kg或更高剂量Elritercept联合芦可替尼治疗的可评估患者中,45.5%(5/11)达到TI(输血独立)。在基线血小板减少症患者中观察到血小板计数改善,特别是接受Elritercept联合芦可替尼治疗的患者。
在治疗第24周时,53%(9/17)可评估患者(2/8单药,7/9联合)显示脾脏大小有所缩小,其中33%(3/9)的患者减少35%及以上。另外,第24周时,65%(13/20)可评估患者的症状评分有所降低。以上这些数据支持Elritercept在改善无效造血、解决MF引起的血细胞减少,以及改善芦可替尼相关的血细胞减少方面的潜力,并为患者提供了更广泛的临床益处。Keros预计将在2024年第四季度报告该试验的更多数据。
2021年12月,Keros与翰森制药宣布签订了独家许可协议,授予翰森制药在中国大陆、香港和澳门地区的开发、生产和商业化Elritercept(KER-050)的独家权益。根据协议条款,Keros在2022年1月收到了1800万美元的预付款,并有望获得高达1.705亿美元的开发和商业里程碑付款,以及产品净销售额的分级特许权使用费。2023年10月,CDE官网显示,Keros Therapeutics申报的1类新药HS-20106(KER-050)注射液获得临床试验默示许可,拟开发用于治疗各种原因导致的血细胞减少症。药物临床试验登记与信息公示平台显示,一项HS-20106在IPSS-R极低危、低危或中危骨髓增生异常综合征(MDS)贫血受试者中的II期临床研究正在进行中。(豪森药业)
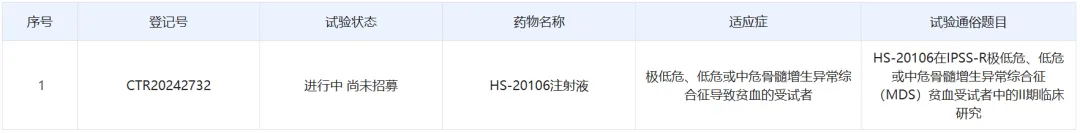
截图自药物临床试验登记与信息公示平台
肺病学与心血管
Keros的第二个候选产品Cibotercept(KER-012)是一种经修饰的激活素受体IIB(ActRIIB)配体陷阱,旨在优先抑制特定的配体(激活素A、激活素B、GDF8和GDF11),以重新平衡TGF-β超家族信号传导,这些配体刺激血管内皮、平滑肌细胞和成纤维细胞的增殖。Keros认为Cibotercept(KER-012)有望通过抑制激活素A和激活素B信号传导来增加骨形态发生蛋白(BMP)通路的信号传导,从而治疗与BMP信号传导减少(包括BMP受体失活突变)相关的疾病,如肺动脉高压(PAH)。
Cibotercept正在被开发用于治疗肺动脉高压(PAH)和心血管疾病。在PAH的临床前模型中,KER-012(RKER-012)可防止血管增厚并降低血管阻力和心脏肥大。此外,RKER-012减少了炎症、纤维化和血管平滑肌肥大的标志物,与类似的第三方分子相比,没有观察到红细胞的剂量限制性增加。临床前研究还提供了支持数据,表明RKER-012具有心脏保护作用机制。
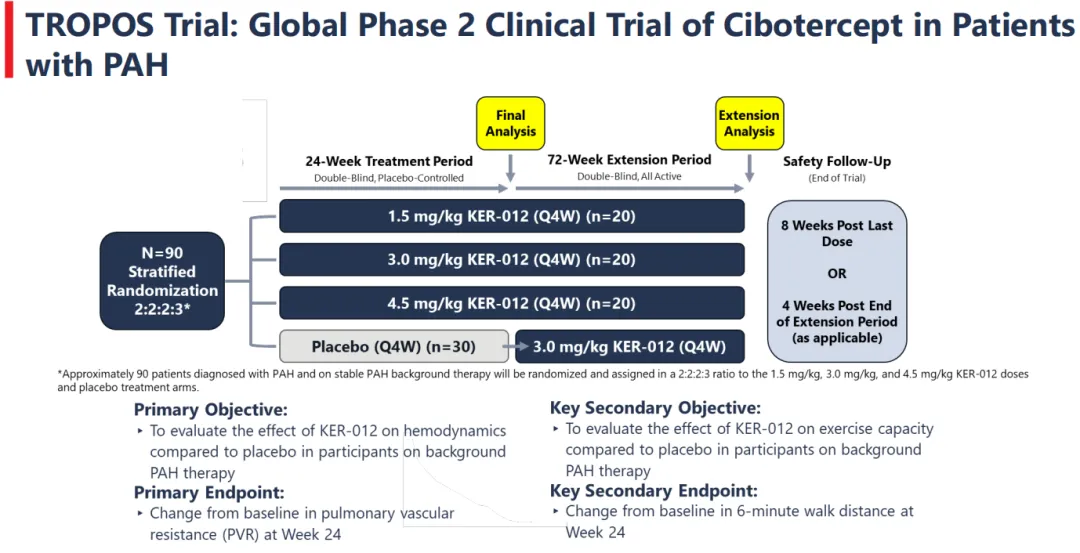
目前Keros开展了一项随机、双盲、安慰剂对照的全球2期临床试验,旨在评估Cibotercept联合标准治疗针对肺动脉高压(PAH)患者的疗效(TROPOS试验;NCT05975905)。2024年9月,该公司宣布TROPOS试验已经完成了患者筛选,预计将在2025年第二季度提供初步数据。
肥胖和神经肌肉疾病
肥胖会导致身体脂肪增加、骨骼肌流失和骨骼流失。胰高糖素样肽-1受体激动剂(GLP-1RA)是近年来的新型降糖减重药物,但是GLP-1RA介导的体重减轻会导致瘦体重显著减少。
与GLP-1RA的作用机制不同,KER-065是一种经修饰的激活素受体IIA(ActRIIA)和激活素受体IIB(ActRIIB)配体陷阱,被设计用于结合并抑制TGF-β配体,包括肌肉生长抑制素(GDF8)和激活素A,它们是肌肉、骨量和骨强度的负调节因子。通过抑制这些TGF-β配体,Keros认为KER-065有望增加骨骼肌并通过增加能量消耗来减少脂肪量,提高胰岛素敏感性并改善心脏功能。此外,与肠促胰岛素联合使用,KER-065或可改善肌肉流失,进一步减少脂肪量并直接改善心脏健康。

KER-065正在被开发用于治疗肥胖症和治疗神经肌肉疾病。在临床前研究中,KER-065对参与肌肉和骨骼稳态调控的配体具有高度亲和力和强效抑制作用。在饮食诱导的小鼠肥胖模型中,KER-065(RKER-065)治疗组增加了瘦体重并减少了脂肪量;司美格鲁肽+RKER-065联合治疗组增加了瘦体重,并在减少脂肪量方面具有协同作用。在杜氏肌营养不良(DMD)的临床前模型中,与对照治疗的DMD小鼠相比,RKER-065增加了瘦体重,增强了前肢抓握力和小梁骨。
目前Keros已经在健康成人志愿者中启动了KER-065的1期临床试验,预计将在2025年第一季度宣布该试验的初步数据。在该试验完成后,公司计划在肥胖患者中启动KER-065的概念验证试验。
【在国内,来凯医药自主研发的ActRIIA单克隆抗体LAE102正在开展针对超重/肥胖的1期临床试验,2024年10月16日,来凯医药宣布单次剂量递增(SAD)研究的皮下注射(SC)部分已启动。】
Keros通过结合ActRIIA和ActRIIB的序列开发了一个专有的ActRII配体陷阱文库,除上述候选产品之外,目前还有20多种独特变体处于临床前开发中。
财务状况
由于尚未有产品获批上市,Keros当前的收入仅来自于研究合作或知识产权许可。2023年度Keros公司净亏损为1.53亿美元,当年收入为15万美元,来自于Keros与翰森制药签订的制造技术转让协议,全年研发费用1.353亿美元,一般和管理费用为3480万美元。
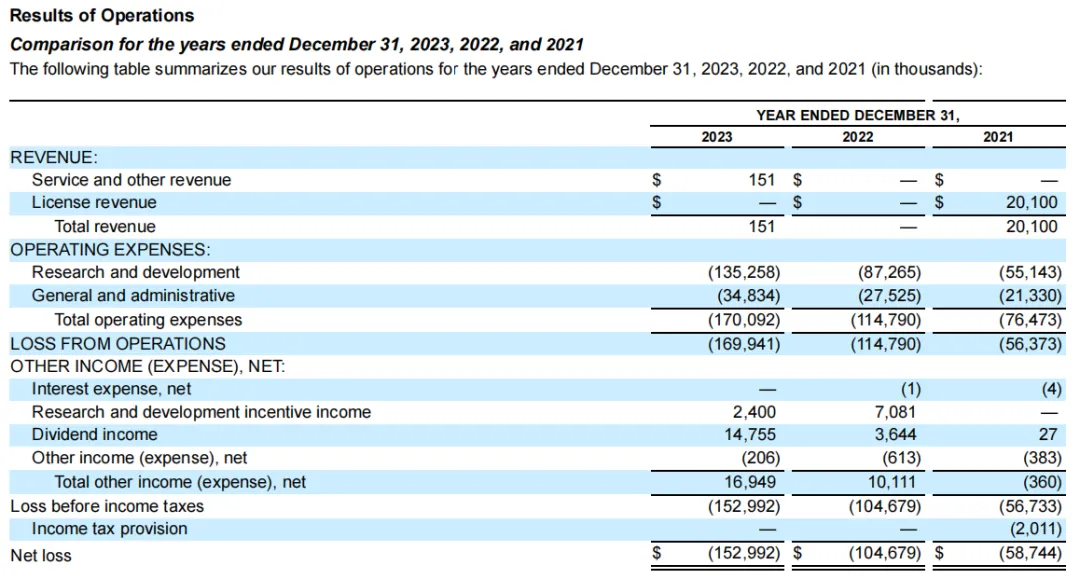
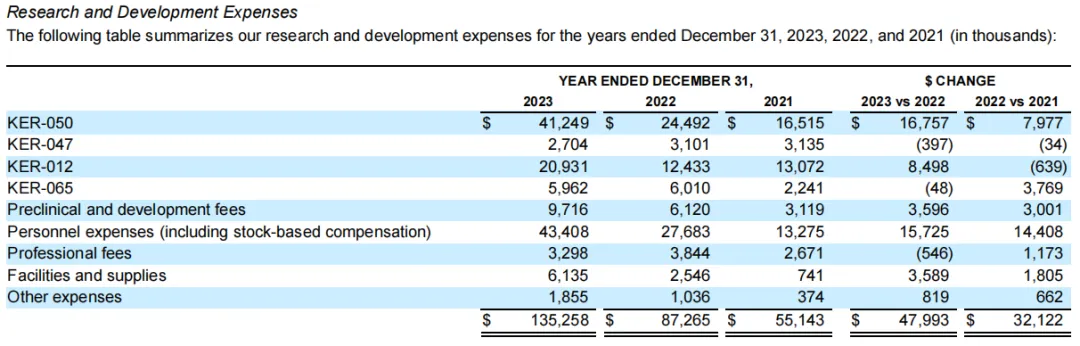
2023年该公司各项目研发开支分布如下:
2024年上半年,Keros公司净亏损8840万美元,上半年服务收入12万美元,来自公司与翰森制药的协议,上半年研发费用7880万美元,一般和管理费用为2030万美元。
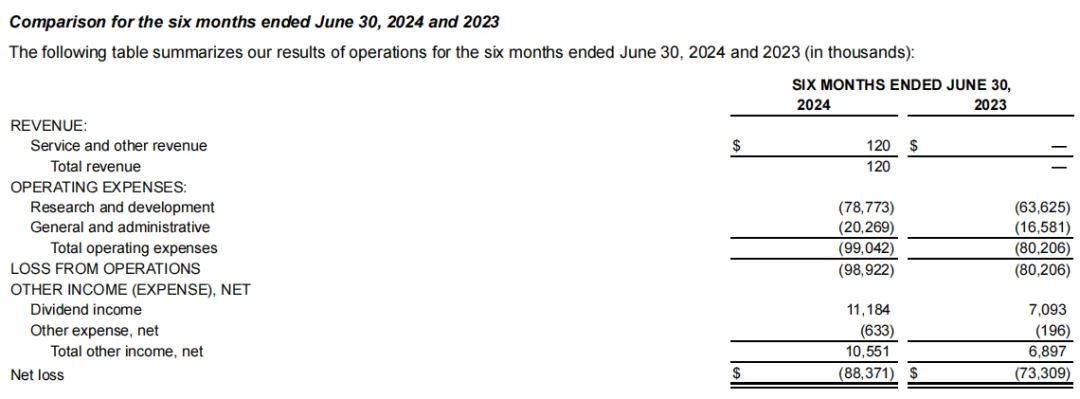
2024年1月,Keros宣布完成普通股的大规模公开发行,净收益约为1.513亿美元。截至2024年6月30日,Keros拥有现金和现金等价物共4.059亿美元,能够为其到2027年的运营费用和资本支出需求提供资金。
2024年12月4日,Keros 宣布与武田制药达成一项独家全球开发和商业化许可协议,以推进elritercept的开发。根据BD协议条款,武田将获得全球进一步开发、生产和商业化elritercept的独家许可(不包括中国内地,香港和澳门地区)。自协议生效之日起,武田将负责elritercept的所有开发、生产和商业化工作。根据协议内容,Keros将收到2亿美元的首付款,并有资格获得超过11亿美元的开发、注册监管及商业里程碑付款。
参考:
NMPA/CDE;
药融云数据www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);
https://kerostx.com/;
Verma, Amit et al. “Biological basis for efficacy of activin receptor ligand traps in myelodysplastic syndromes.” The Journal of clinical investigation vol. 130,2 (2020): 582-589. doi:10.1172/JCI133678;
https://www.fiercebiotech.com/biotech/keros-upsizes-ipo-raising-96m-for-blood-and-musculoskeletal-trials;
https://www.hansoh.cn/news/news-detail-9780.htm;等等

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 114
114

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 103
103

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 93
93