 产业资讯
产业资讯
 中国食品药品监管杂志
中国食品药品监管杂志  2024-12-17
2024-12-17
 1009
1009

引用本文
JUAN LARA,MAGDA BUJAR,ADEM KERMAD,NEIL MCAUSLANE,ANNA SOMUYIWA.2014~2023 年六大监管机构新药审评情况分析:不断演变的监管环境与监管促进路径[J]. 曾亚莉,编译.李丹,整理.中国食品药品监管.2024.11(250):60-73.
2014~2023 年六大监管机构新药审评情况分析:不断演变的监管环境与监管促进路径
Analysis of New Drug Approvals by Six Major
Authorities (2014-2023): Evolving Regulatory
Landscape and Facilitated Regulatory Pathways
Juan Lara
国际监管科学创新研究中心(CIRS)
Centre for Innovation in Regulatory Science(CIRS)
Magda Bujar
国际监管科学创新研究中心(CIRS)
Centre for Innovation in Regulatory Science(CIRS)
Adem Kermad
国际监管科学创新研究中心(CIRS)
Centre for Innovation in Regulatory Science(CIRS)
Neil McAuslane
国际监管科学创新研究中心(CIRS)
Centre for Innovation in Regulatory Science(CIRS)
Anna Somuyiwa
国际监管科学创新研究中心(CIRS)
Centre for Innovation in Regulatory Science(CIRS)
编译/曾亚莉
科睿唯安信息服务(北京)有限公司
ZENG Ya-li
Clarivate Analytics Information Services(Beijing) Company Ltd.
整理/李丹
《中国食品药品监管》杂志社
LI Dan
China Food & Drug Administration Magazine
摘 要Abstract
本文介绍了国际监管科学创新研究中心(CIRS)对六大监管机构批准的新活性物质(NAS)的年度审评情况,重点分析了2023 年NAS 批准情况,回顾了2014~2023 年的审评情况。通过分析可以看出,虽然各监管机构的中位批准时间仍存在显著差异,但从递交到科学审评时间的差异在逐渐缩小。美国食品药品监督管理局依然是批准NAS 最多的机构,欧洲药品管理局批准数量显著增加,罕见病药占比整体呈上升趋势,这主要与各企业申报策略和规模、未满足的医疗需求、监管审评速度,基于风险的审评路径以及采用合作或共享审评机制等有关。
This article presents the annual analysis results of new active substance (NAS) approvals by the Centre for Innovation in Regulatory Science (CIRS), with a focus on the 2023 NAS approvals and a review of the trends from 2014 to 2023. The analysis shows that while there are still significant differences in median approval times across the six regulatory authorities the variation in time from submission to the end of scientific assessment has narrowed. The FDA remains the agency with the highest number of NAS approvals and the EMA has shown a notable increase in approvals. The proportion of orphan drugs has generally shown an upward trend, which can be attributed to factors such as company submission strategies and scale,unmet medical needs, regulatory review speed, the use of risk-based review pathways, and collaborative or work-sharing review mechanisms.
关键词Key words
新活性物质;监管;批准时间;监管促进路径;罕见病药
new active substance; regulation; approval time; facilitated regulatory pathway; rare disease drugs

1 六大监管机构新活性物质(NAS)批准的总体情况
本文介绍了国际监管科学创新研究中心(Centre for Innovation in Regulatory Science,CIRS) 对六大监管机构批准的新活性物质(newactive substance,NAS)的年度分析结果,其中六大监管机构包括:欧洲药品管理局(European Medicines Agency,EMA)、美国食品药品监督管理局(Food and Drug Administration ,FDA)、日本药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,PMDA)、加拿大卫生部(Health Canada,HC)、瑞士医药管理局(Swissmedic) 和澳大利亚药品监督管理局(Therapeutic Goods Administration,TGA)。2014~2023 年六大监管机构的NAS 中位批准时间,如图1 所示。
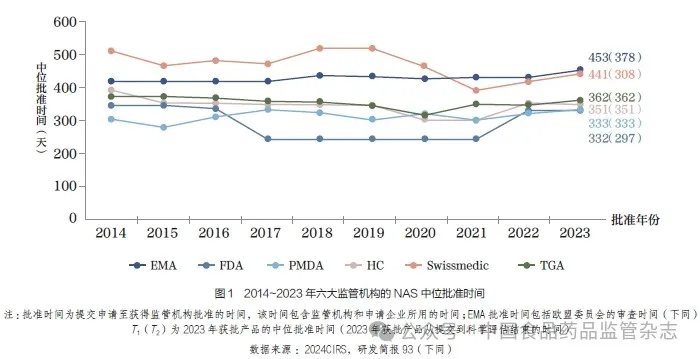
上市许可中位批准时间出现差异归结于多种因素,包括监管机构的因素、产品因素和企业策略等。监管机构因素包括规定时间线的现行法律框架、提交或滚动提交前的程序、监管促进途径(例如加速评审)、机构间的工作共享( 例如Access 和Orbis)以及科学评估后的活动(例如行政程序或标签谈判)。产品因素包括各机构受理或审查的NAS 有所差异。企业策略包括提交申请时间不同,数据包有所差异。
过去20 年,六大监管机构批准NAS 的时间逐渐趋于一致,但六大监管机构之间的中位批准时间仍存在显著差异(例如PMDA和EMA 之间相差121 天)。此外,从提交申请到科学评估结束的中位时间来看,六大监管机构之间的差异相对缩小(PMDA 和EMA 之间相差81 天),如图1 所示。对于FDA、HC 和TGA 而言,总体批准时间和科学评估结束的时间几乎一致,这表明与EMA或Swissmedic 相比,其在科学评估后进行的活动非常有限。与2022 年的结果相比,EMA 的中位批准时间延长了23 天,这主要是由于企业时间增加所致,其中位数从117 天[ 四分位距(interquartile range, IQR) 为70 天] 攀升至127 天(IQR 为106 天)。相比之下,FDA 和HC的中位批准时间依然高于2022年前的水平,而Swissmedic 的中位批准时间自2021 年以来一直保持上升趋势。
2023 年,FDA 批准的NAS数量位居首位(61 款),其次是Swissmedic(35 款)、HC(34款)、EMA(31 款)、TGA(27款)和PMDA(21 款),如图2所示。尽管FDA 在过去10 年间批准的NAS 数量一直多于其他监管机构,但并非所有NAS 都进入国际市场,或者NAS 在其他国家和地区上市过程中耗费了大量时间。
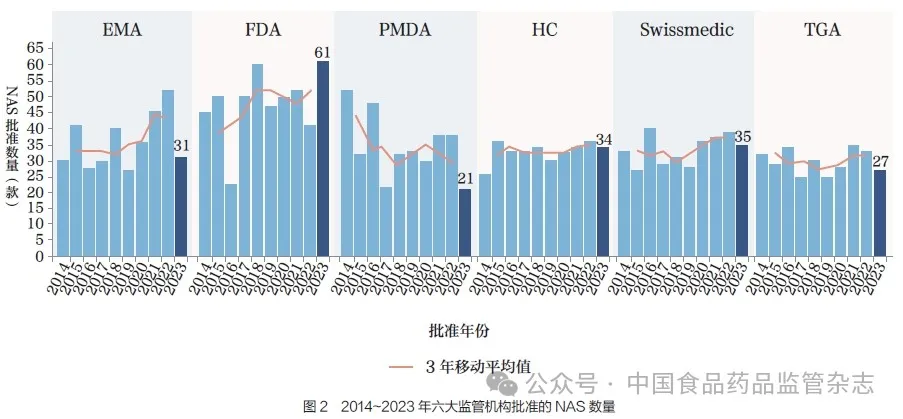
比较2014~2018 年和2019~2023 年这2 个5 年期间NAS的批准数量, 发现增幅最大的是EMA(13%), 其次是FDA(10%)、Swissmedic(9%),而HC 仅增加3% ;相比之下,PMDA 和TGA 的批准数量分别减少了14% 和1%。各监管机构批准产品数量的差异可能由多种因素造成,包括针对各监管机构采取不同的申报策略、企业规模、未满足的医疗需求、审评速度,基于风险的审评路径以及采用合作或共享审评机制等。
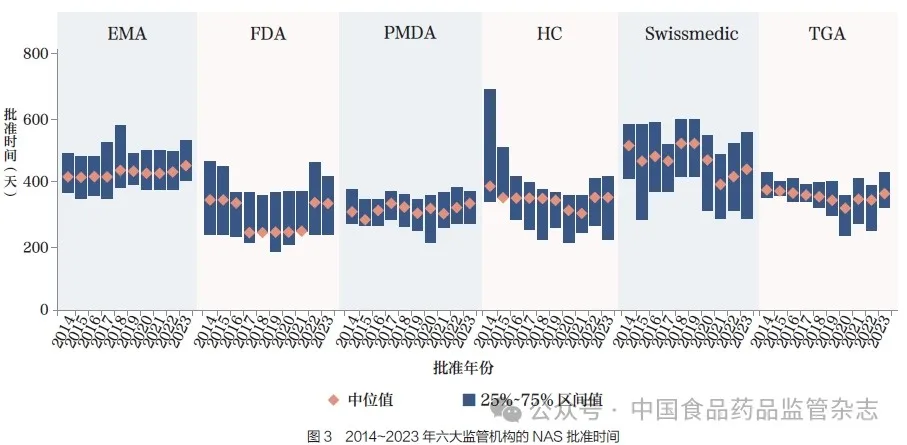
2023 年,PMDA 的中位批准时间最短,为332 天,其IQR也最短, 仅为83 天。其次是FDA中位批准时间为333天(IQR为170 天),HC 中位批准时间为351 天(IQR 为183 天),TGA中位批准时间为362 天(IQR 为95 天),Swissmedic 中位批准时间为441 天(IQR 为259 天),EMA 中位批准时间为453 天(IQR 为119 天),如图3 所示。
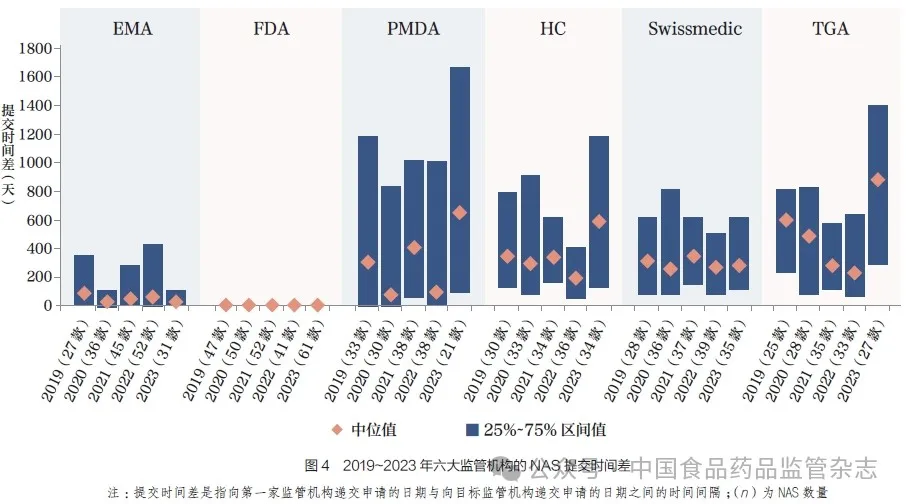
2 六大监管机构NAS提交时间差
2023 年,FDA 的中位提交时间差最短,为0 天,这反映出相关企业倾向于首先向FDA 提交申请,其次是EMA 为25 天、Swissmedic 为291 天、HC为593 天、PMDA 为644 天和TGA 为886 天, 如图4 所示。与2022 年相比,EMA 的中位提交时间差减少了44 天,FDA 保持不变,Swissmedic增加了21 天。此外,HC、PMDA 和TGA 的中位提交时间差分别增加了388 天、548天和657 天。对提交时间差的分析还涵盖了中位数和IQR 的差异。对于EMA,提交时间差的75% 分位数已从2022 年的420 天减少到2023 年的85 天。同样,PMDA、HC、Swissmedic 和TGA 中位提交时间差的增加也能够反映在其25% 分位数和75% 分位数上。值得注意的是, 在2019~2023年,PMDA 的IQR 与其他5 个机构相比范围最宽。这种提交时间差(中位数和方差)的变化,可能预示着相关制药企业战略方向的转变,也可能是由于特定年份批准的既有产品的影响,亦或与该年度提交产品的制药企业规模有关。一般而言,企业规模越小,时间差通常越大。
通过比较NAS 是否仅由单一监管机构(而非其他5 个机构)批准,可以分析产品的国际化程度。结果显示,2023 年,FDA批准的NAS 中有高达57% 的产品当年仅在美国获得批准。虽然这一比例在2019~2022 年间相对较低,但其中部分产品很可能在后期获得其他机构的批准。2023 年没有出现仅由PMDA 批准的NAS,见表1。
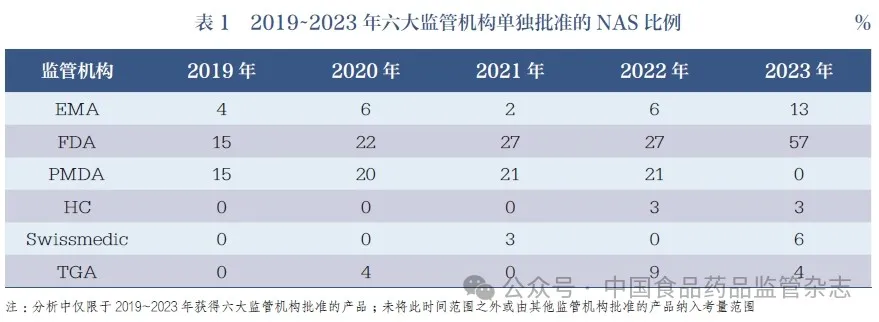
3 六大监管机构共同批准情况
为准确评估监管工作绩效基准,本文回顾所有获得六大监管机构全部批准的NAS。为了识别趋势, 本文将2014~2023 年划分为两个时间段,即2014~2018年和2019~2023 年进行了评估。在2 个五年周期内,在六大监管机构均获批准的产品数量呈下降趋势,从2014~2018 年的52 款NAS 减少到2019~2023 年的38 款,如图5 所示,该趋势在近年来的分析中也有所体现。这与前几年分析中呈现的增长趋势形成了对比,表明国际化步伐可能正在放缓。此外,近期观察到的提交时间差增大可能成为另一阻碍因素,预示着在未来相似时间段内,获得所有机构批准的NAS数量或将继续减少。
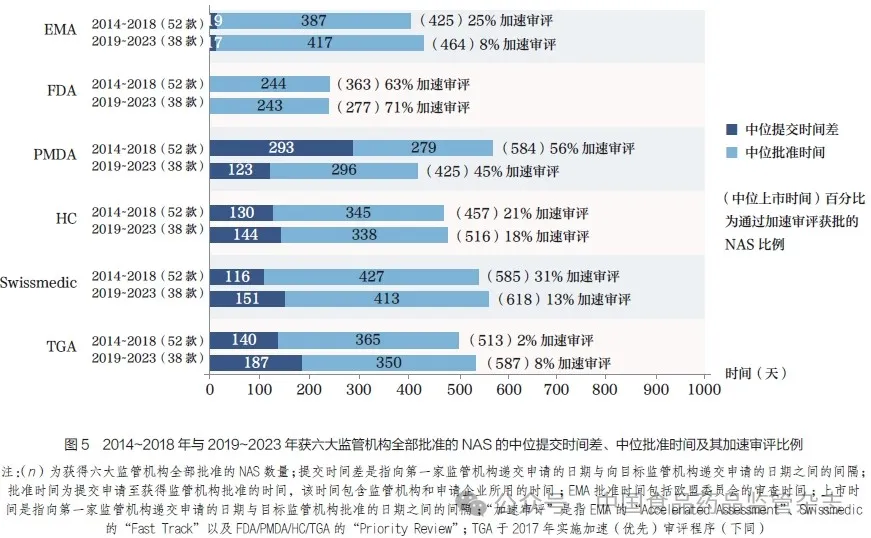
上市时间, 即提交时间差和批准时间的总和, 受多种因素影响, 包括企业的提交策略以及为应对未满足的医疗需求而采用的加速审评通道等。2019~2023 年,FDA 凭借着制药企业首先向其提交的优势以及更广泛地使用加速审评(占已批准NAS 的71%), 实现了最快的总体中位上市时间,仅为277 天。紧随其后的是PMDA, 为425 天,EMA 为464 天,HC 为516 天,TGA为587 天, 而Swissmedic最长为618 天, 如图5 所示。向EMA 的提交几乎与FDA 同时进行,随后是PMDA、HC、Swissmedic 和TGA。与过去的报告相比, 本文呈现出向各监管机构提交的顺序发生了变化。以往,提交给PMDA 的时间通常晚于HC、Swissmedic和TGA,但现在其提交时间已更加接近这些机构。具体而言,向PMDA 提交的中位提交时间差已从2014~2018 年的293天显著缩短至2019~2023 年的123 天。
4 影响六大监管机构NAS 批准的因素
4.1 审评类型
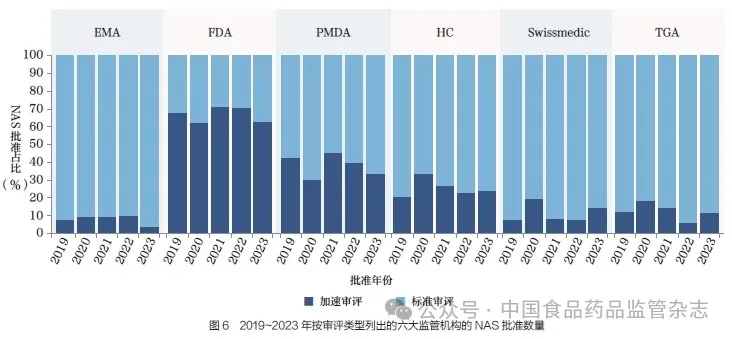
六大监管机构均已设立加速审评程序, 以加快具有前景的NAS 审评过程, 如图6 所示。2023 年,FDA 的加速审评比例最高, 达到了62%, 紧随其后的是PMDA(33%)、HC(24%)、Swissmedic(14%)、TGA(11%) 和EMA(3%)。与2022 年相比,2023 年六大监管机构的加速审评比例基本持平。2023 年,EMA 仅通过加速审评程序批准了1 款NAS,部分原因在于如果无法满足法定时限,该机构可将审评类型恢复为标准审评。例如, 在2023 年, 有2 款最初被EMA 指定为加速审评的NAS 恢复为标准审评,同时,还有3 款NAS 的申请人请求加速审评,但并未被EMA 认定为符合加速审评的条件。
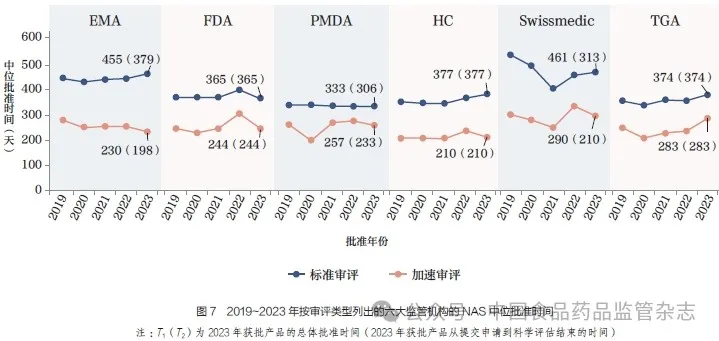
2023 年,EMA 加速审评和标准审评之间的中位审评时间差最大,达到了225 天,相比之下,PMDA 的差异最小,仅为76 天。Swissmedic 标准审评与加速审评之间相差171 天,HC 为167天,FDA 为121 天, 而TGA 则为91 天,如图7 所示。2023 年,通过EMA 加速审评获批的NAS从递交到科学评估结束的中位时间为198 天,相比标准审评获批的NAS,时间缩短了181 天。在上市许可阶段(由欧盟委员会审批),通过加速审评获批的NAS的中位时间为32 天,而标准审评则为76 天。同样在2023 年,尽管由Swissmedic 进行加速审评的药品从提交到科学评估结束的中位时间为210 天,但由于后续的标签审查程序,还需要额外80天才能获得上市许可。为应对这一情况,EMA 和Swissmedic均积极采取措施,力求进一步加快上市许可流程。
4.2 罕见病药品
2023 年, 六大监管机构批准的NAS 中, 获得罕见病药品资格的比例都较高, 其中Swissmedic 达到63%,FDA为56%,TGA 为44%,EMA为35%, 而PMDA 则为29%,如图8 所示。2019~2023 年,尽管罕见病药品的比例每年有所波动,但总体上相较于2014~2018年有所增加。2014~2018 年,获得罕见病药品资格的NAS 获批比例在不同监管机构间有所不同,其中Swissmedic 为32%,FDA 为49%,TGA 为29%,EMA 为39%,PMDA 为34%。这可能是由于疾病分层和制药企业不断扩大研发管线, 以及与各监管机构为解决未满足的医疗需求而做出的更多承诺相关。各监管机构之间罕见病药品比例的差异受多种因素影响,例如监管机构罕见病药品认定标准的差异以及申请人提交的适应症不同等。
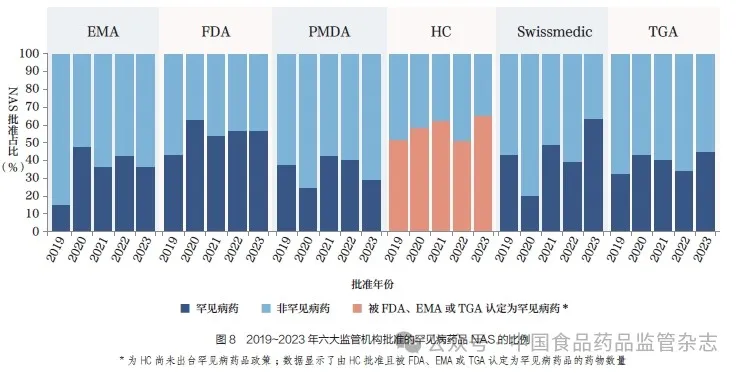
本文对2019~2023 年六大监管机构的罕见病药品和非罕见病药品批准时间线进行了比较,如图9所示。2023 年,PMDA 凭借其所有罕见病药品均通过加速审评流程的策略,实现了罕见病药品批准的最少中位时间(265 天),彰显了PMDA 积极应对未满足的医疗需求的决心。FDA 以332 天的罕见病药品中位批准时间位居第二,其次是Swissmedic(344 天)、TGA(346 天)和EMA(441 天)。对于EMA 和TGA 来说,2019~2023 年,罕见病药品和非罕见病药品的中位批准时间大致相同,这可能是因为两者都使用了类似的快速审评通道,无论是否被指定为罕见病药品。至于HC,虽然目前尚未出台罕见病药品相关政策,但其在2023 年批准了22种被FDA、EMA 或TGA 归类为罕见病药品的NAS,中位批准时间为274 天。

4.3 监督促进路径(FRP)
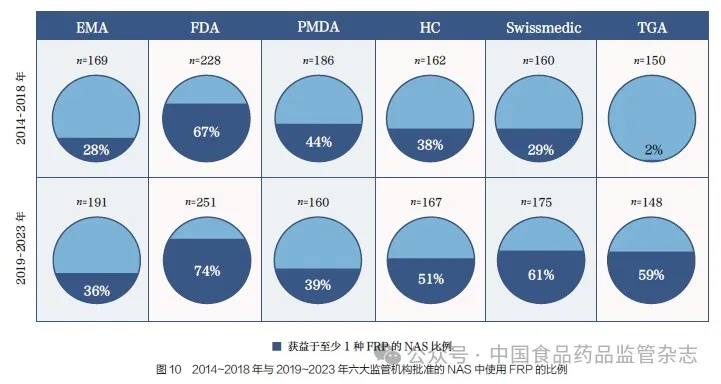
相较于2014~2018 年,2019~2023 年大部分监管机构对监管促进路径(facilitated regulatory pathways,FRP) 的使用都有所增加, 如图10 所示。其中,2019~2023 年FDA 成为使用FRP 最多的机构,其74%的NAS 至少使用了一种FRP,其次是Swissmedic(61%)、TGA (59%)、HC (51%)、PMDA(39%)和EMA(36%)。在通过FRP 批准NAS 的比例方面,TGA 的增幅最为显著,可能是由于TGA 自2017 年起实施了5 种FRP[ 优先审评、临时批准、国外同类监管机构(COR)审评、Access 工作共享联盟和Orbis计划]。通过对比可知,PMDA是2014~2018 年与2019~2023年唯一通过FRP 批准NAS 比例下降的机构。
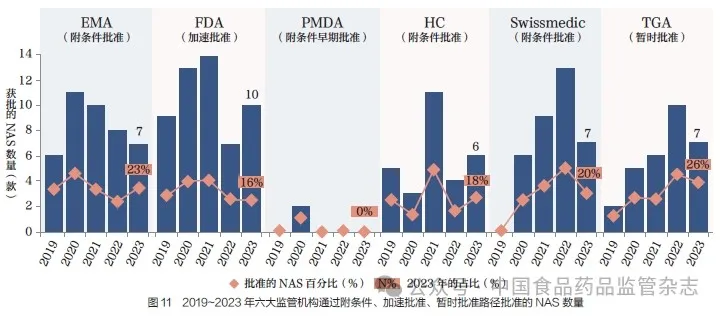
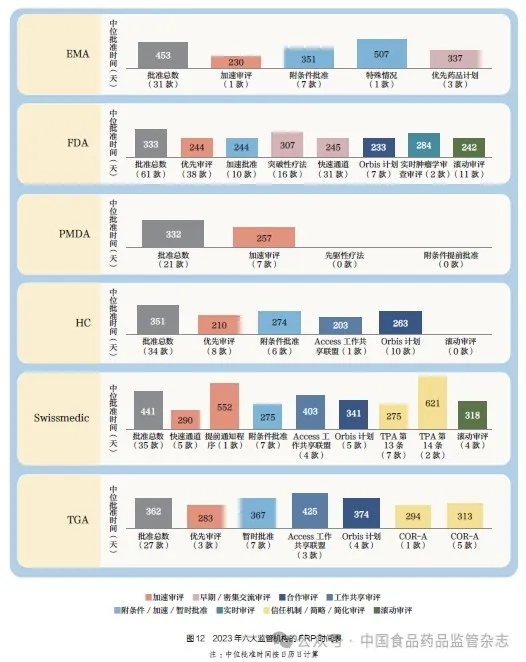
2023 年, 不同监管机构在附条件批准、加速批准、暂时批准方面的比例也存在差异,其中TGA 以26% 的比例领先,EMA 为23%、Swissmedic为20%、HC 为18%、FDA为16%,如图11 所示。值得注意的是,自2019~2023 年起,附条件批准、加速批准、暂时批准的数量总体上呈现年度波动的趋势。总体上, 对于六大监管机构而言, 这类审评路径的批准时间比总体中位批准时间更快, 可能主要得益于快速审评通道的应用。2023 年不同FRP 的NAS 中位批准时间,如图12 所示。
4.4 治疗领域
2019~2023 年, 六大监管机构在排名前5 治疗领域中批准的NAS 数量占据了全部批准数量的76%(833/1092), 其中抗肿瘤药物和免疫调节剂在5大治疗领域批准数量中占42%(464/1092), 如图13 所示。在5 大治疗领域中,抗感染药的总体中位批准时间最短,为295 天。对比之前的研究数据中的总体中位批准时间,抗感染药的总体中位批准时间与其他治疗领域的差距似乎有所扩大,这可能与新冠相关产品的快速获批有关。另一方面,目前消化类药物和代谢类药物与抗肿瘤药物和免疫调节剂并驾齐驱,总体中位批准时间分别为322 天和344 天,这反映出未满足的医疗需求正在发生变化,见表2。事实上,从2014~2018年的23% 到2019~2023 年的41%,作为加速审评对象的消化和代谢的NAS 比例显著上升。
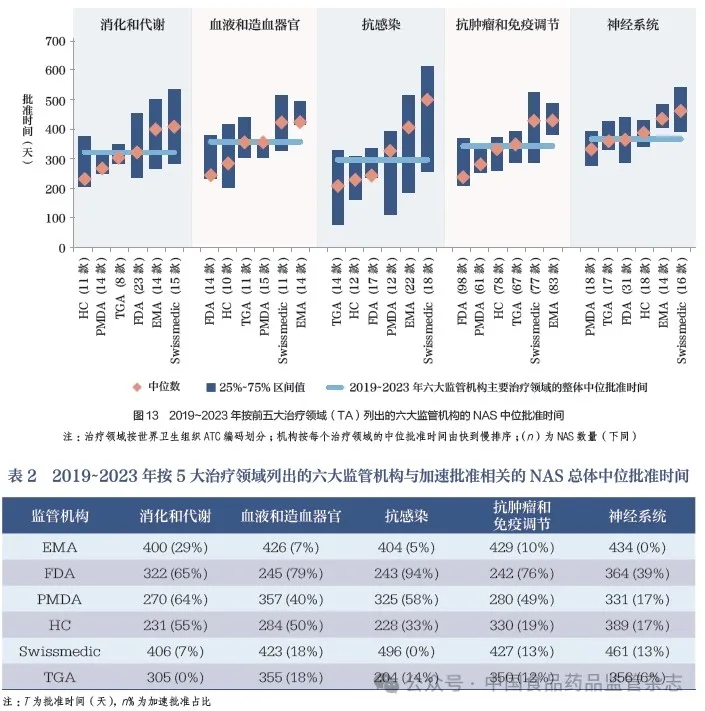
5 2023 年六大监管机构批准的NAS 情况汇总
本文对2023 年由六大监管机构批准的NAS 的批准时间,按产品类型、审评类型和主要治疗领域进行整理汇总,见表3。
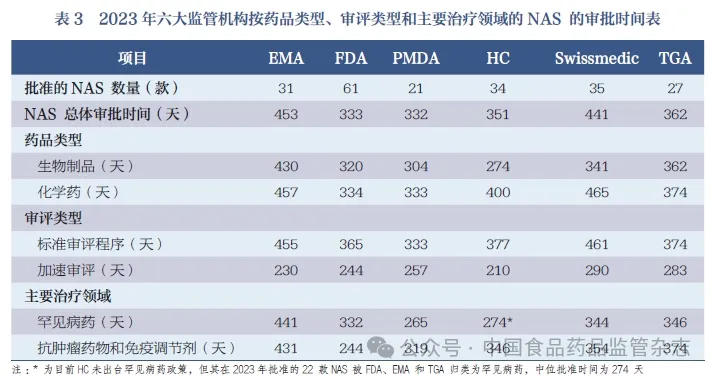
5.1 2023 年EMA 批准的NAS 情况
EMA 共批准了31 款NAS,中位批准时间为453 天,其中欧盟委员会中位时间为61 天,监管机构中位时间为240 天,申请企业中位时间为127 天。EMA 批准时间包括了欧盟委员会的审查时间。在药物类型方面, EMA 批准12 款生物制品NAS,中位批准时间为430 天;批准19 款化学药NAS,中位批准时间为457天;批准17 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为431 天;批准其他治疗领域的14款NAS,中位批准时间为489 天。在资格认定和审评类型方面,批准11 款罕见病药NAS,中位批准时间为441 天,比20 款非罕见病药NAS 的中位批准时间缩短14 天。加速审评批准1 款NAS,中位批准时间为230 天,比标准审评程序批准的30 款NAS 的中位批准时间缩短225 天。在EMA 批准的NAS 中,16% 为全球首次批准或者是在其他监管机构首次批准后1 个月内获得批准。剩余84% 是在其他监管机构批准1 个月后才获得EMA批准,这部分NAS 在EMA 的中位提交时间差为30 天。
5.2 2023 年FDA 批准的NAS 情况
FDA(药品评价与研究中心和生物制品评价与研究中心)共批准了61 款NAS,中位批准时间为333 天,其中82% 为首轮科学审评批准。在药物类型方面,FDA 批准27 款生物制品NAS,中位批准时间为320 天;批准34 款化学药NAS,中位批准时间为334 天;批准21 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为244 天;批准其他治疗领域的40 款NAS, 中位批准时间为335 天。在资格认定和审评类型方面,批准34 款罕见病药NAS,中位批准时间为332 天,比27 款非罕见病药NAS 的中位批准时间缩短2 天。加速审评批准38 款NAS,中位批准时间为244 天,比标准审评程序批准的23 款NAS 的中位批准时间缩短121 天。在批准的NAS 中,80% 为全球首次批准或者是在其他监管机构首次批准后一个月内获得批准。剩余20% 是在其他监管机构批准一个月后才获得EMA 批准,这部分NAS 在FDA 的中位提交时间差为220 天。
5.3 2023 年PMDA 批准的NAS 情况
PMDA 共批准了21 款NAS,中位批准时间为332 天。在药物类型方面,PMDA 批准9款生物制品NAS,中位批准时间为304 天;批准12 款化学药NAS,中位批准时间为333 天;批准8 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为319 天;批准其他治疗领域的13 款NAS,中位批准时间为332 天。在资格认定和审评类型方面,批准6 款罕见病药NAS,中位批准时间为265 天,比15 款非罕见病药NAS 的中位批准时间缩短68 天。加速审评批准7 款NAS,中位批准时间为257 天,比标准审评程序批准的14 款NAS 的中位批准时间缩短76 天。在PMDA 批准的NAS 中,14% 为全球首次批准或者是在其他监管机构首次批准后一个月内获得批准。剩余86% 是在其他监管机构批准一个月后才获得EMA 批准,这部分NAS 在FDA 的中位提交时间差为882 天。
5.4 2023 年HC 批准的NAS 情况
HC 共批准了34 款NAS,中位批准时间为351 天。在药物类型方面,批准19 款生物制品NAS,中位批准时间为274 天;批准15 款化学药NAS,中位批准时间为400 天;批准12 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为346 天;批准其他治疗领域的22 款NAS,中位批准时间为352 天。在资格认定和审评类型方面,HC 未出台罕见病药相关政策,但22 款NAS被FDA、EMA 或TGA 归类为罕见病药,中位批准时间为274天。加速审评批准8 款NAS,中位批准时间为210 天,比标准审评程序批准的26 款NAS 的中位批准时间缩短168 天。在HC 批准的NAS 中,9% 为全球首次批准或者是在其他监管机构首次批准后1 个月内获得批准。剩余91% 是在其他监管机构批准1 个月后才获得EMA 批准,这部分NAS 在FDA 的中位提交时间差为698 天。
5.5 2023年Swissmedic批准的NAS 情况
Swissmedic 共批准了35款NAS,中位批准时间为441 天。在药物类型方面,Swissmedic批准17 款生物制品NAS,中位批准时间为341 天;批准18 款化学药NAS,中位批准时间为465 天;批准15 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为354 天;批准其他治疗领域的20 款NAS,中位批准时间为458 天。在资格认定和审评类型方面,批准22 款罕见病药NAS,中位批准时间为344天,比13 款非罕见病药NAS 的中位批准时间缩短120 天。加速审评批准5 款NAS,中位批准时间为290 天,比标准审评程序批准的30 款NAS 的中位批准时间缩短171 天。在Swissmedic 批准的NAS 中,11% 为全球首次批准或者是在其他监管机构首次批准后1 个月内获得批准。剩余89% 是在其他监管机构批准1 个月后才获得EMA 批准,这部分NAS 在FDA 的中位提交时间差为351 天。
5.6 2023 年TGA 批准的NAS 情况
TGA 共批准了27 款NAS,中位批准时间为362 天。在药物类型方面,TGA 批准13 款生物制品NAS,中位批准时间为362 天;批准14 款化学药NAS,中位批准时间为374 天;批准12 款抗肿瘤药物和免疫调节剂NAS,中位批准时间为374 天;批准其他治疗领域的15 款NAS,中位批准时间为362 天。在资格认定和审评类型方面,批准12款罕见病药NAS,中位批准时间为346 天,比15 款非罕见病药NAS 的中位批准时间缩短22天。加速审评批准3 款NAS,中位批准时间为283 天,比标准审评程序批准的24 款NAS 的中位批准时间缩短91 天。在TGA 批准的NAS 中,4% 为全球首次批准或者是在其他监管机构首次批准后1 个月内获得批准。剩余96% 是在其他监管机构批准1 个月后才获得EMA 批准,这部分NAS 在FDA 的中位提交时间差为924 天。
国际监管科学创新研究中心(CIRS)使命是维护其在业界的权威领导地位,运用科学方法优化推进药品监管与卫生技术评估(HTA)的政策与流程。CIRS 提供了一个国际化的中立平台,聚集制药公司、药品监管部门、HTA 以及其他医疗保健中的利益相关者,通过药政科学理念的创新运用,支持多方互动和研讨,促进药政法规和医保政策。该机构实行自主管理并有独立顾问委员会,其资金来源于会员会费、相关活动费用和其他研发款项。它的运行和经营全部用于支持会员活动。本组织为科睿唯安旗下独立运营的中立机构。
作者简介
Juan Lara,博士,国际监管科学创新研究中心(CIRS),研究分析师。专业方向:监管研究
Magda Bujar,博士,国际监管科学创新研究中心(CIRS),战略发展经理。专业方向:监管计划优化与监管决策框架
Neil McAuslane,博士,国际监管科学创新研究中心(CIRS),科学总监。专业方向:监管战略和研发绩效
编译者简介
曾亚莉,科睿唯安信息服务(北京)有限公司,生命科学与医疗健康资深顾问。专业方向:国际市场准入与监管策略
整理者简介
李丹,《中国食品药品监管》杂志社,编辑。专业方向:微生物、食品及医药出版

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 99
99

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 89
89

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 78
78