 产业资讯
产业资讯
 药融圈
药融圈  2024-12-24
2024-12-24
 1379
1379
01抗癌“万金油”卡博替尼
药融圈获悉:卡博替尼(Cabozantinib)是一种非特异性酪氨酸激酶抑制剂(TKI),由美国生物制药公司Exelixis研发,其本质是一种喹啉类化合物,在2012年由美国FDA首次获批上市,因其对RET、AXL、MET和VEGFR等多个靶点具有靶向性,卡博替尼也被称为是抗癌“万金油”。自首次上市以来,卡博替尼已获批治疗多种癌症,包括甲状腺髓样癌(MTC)、肾细胞癌(RCC)、肝细胞癌(HCC)、分化型甲状腺癌(DTC),其与纳武利尤单抗的联合治疗方案获批一线治疗晚期肾细胞癌患者。
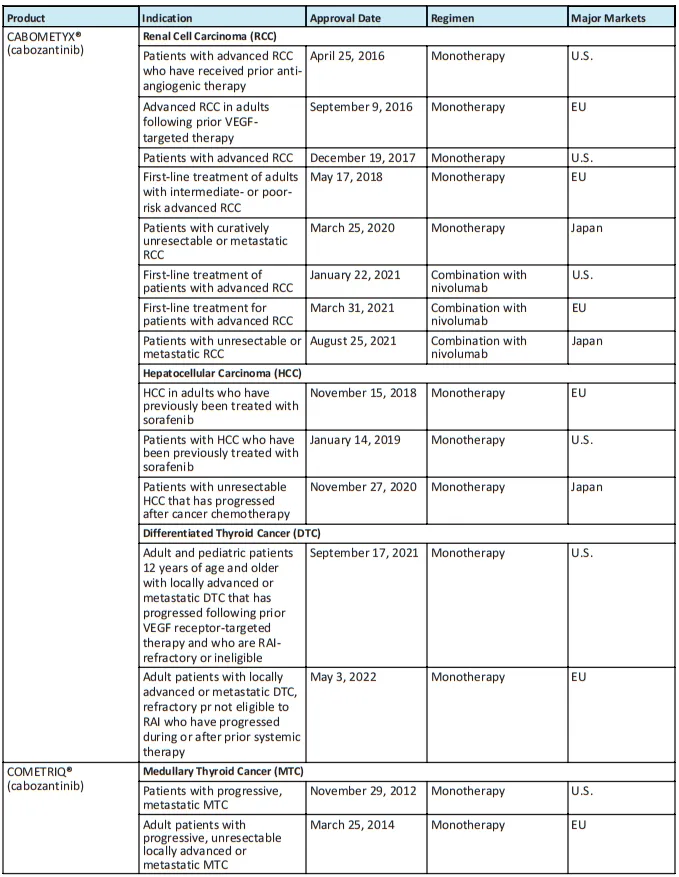
卡博替尼获批时间线(仅列出美国、欧洲、日本)
卡博替尼产品组合包括胶囊剂(商品名COMETRIQ®)和片剂(商品名CABOMETYX®),分别针对不同适应症,2021年、2022年和2023年,该系列产品分别为Exelixis贡献了10.773亿美元、14.012亿美元和16.289亿美元的净产品收入,占该公司总收入的绝大部分。在美国以外市场,卡博替尼由合作伙伴益普生IPSEN(美国和日本以外的所有地区)和武田制药(日本)进行商业化销售,2021年、2022年和2023年,分别为Exelixis带来了1.051亿美元、1.214亿美元和1.485亿美元的特许权使用费。
卡博替尼不是美国市场上第一个酪氨酸激酶抑制剂(TKI),但它是TKI中的佼佼者——晚期RCC(肾细胞癌)中排名第一的处方单药TKI和一线晚期RCC中排名第一的TKI+IO(酪氨酸激酶抑制剂+肿瘤免疫治疗)组合。

02Exelixis的“进化”之路
Exelixis成立至今已有30年,卡博替尼是该公司旗下唯一的已上市产品组合。MEK抑制剂考比替尼(Cobimetinib)和非甾体盐皮质激素受体阻滞剂艾沙利酮(Esaxerenone)也是由Exelixis最早研发,但已分别授权给了基因泰克和第一三共。
Exelixis源自希腊语Exelixi,意为进化——这个名字恰如其分地反映了该公司从一家功能基因组学初创公司成长为一家完全整合的生物制药公司。

1994年,当时在耶鲁大学的Spyridon Artavanis-Tsakonas博士(现任职于哈佛大学)以及当时在加州大学伯克利分校任职的Corey
Goodman博士和Gerry
Rubin博士创立Exelixis之时,该公司主要关注基于基因组学的农业研究。从2000年开始,Exelixis转变为专注于小分子药物发现。
Exelixis曾建立广泛的药物管线,并与百时美施贵宝、葛兰素史克、第一三共、基因泰克建立了合作。但后来Exelixis放弃其他项目,将卡博替尼视为药物开发的核心,投入大量资金,几乎是把公司的未来押注在这个分子上。
2014年是Exelixis的至暗时期,当时卡博替尼前列腺癌适应症3期临床失败,公司裁员70%,非小细胞肺癌研究进展缓慢,唯一获批适应症为罕见的甲状腺髓样癌(MTC),业绩惨淡,公司股价一路下跌,总市值最低时不到3亿美元。
不过从2016年开始,卡博替尼获批治疗晚期肾细胞癌(RCC),后拓展到一线治疗晚期RCC、与纳武利尤单抗的联合疗法,以及肝细胞癌(HCC)、分化型甲状腺癌(DTC)适应症,成功扭转颓势。
相关阅读:下一个潜在大药企百亿级收购对象Exelixis
03卡博替尼的新机会
在外部合作伙伴的支持下,目前Exelixis依然围绕卡博替尼开展多项临床试验,积极拓展适应症与联合疗法。
2011年10月,Exelixis与美国国家癌症研究所(NCI)癌症治疗评估计划(CTEP)就卡博替尼的临床开发订立合作研发协议(CRADA)。基于该合作协议开展的关键3期研究CABINET在两个独立队列中评估了卡博替尼(CABOMETYX®)在既往全身治疗后出现进展的神经内分泌肿瘤(NET)患者中的疗效:一个队列针对晚期胰腺神经内分泌肿瘤(pNET);另一个队列针对胰腺外神经内分泌肿瘤(epNET)。由于中期分析中观察到的无进展生存期(PFS)主要终点疗效显著改善,该试验被揭盲并提前停止。2024年8月,Exelixis宣布FDA已接受卡博替尼用于治疗既往接受过治疗的晚期pNET/epNET成年患者的sNDA申请,PDUFA目标日期为2025年4月3日,FDA还授予卡博替尼用于治疗pNET的孤儿药资格认定。2024年11月,该公司宣布FDA将于2025年3月召开ODAC会议讨论该sNDA申请。
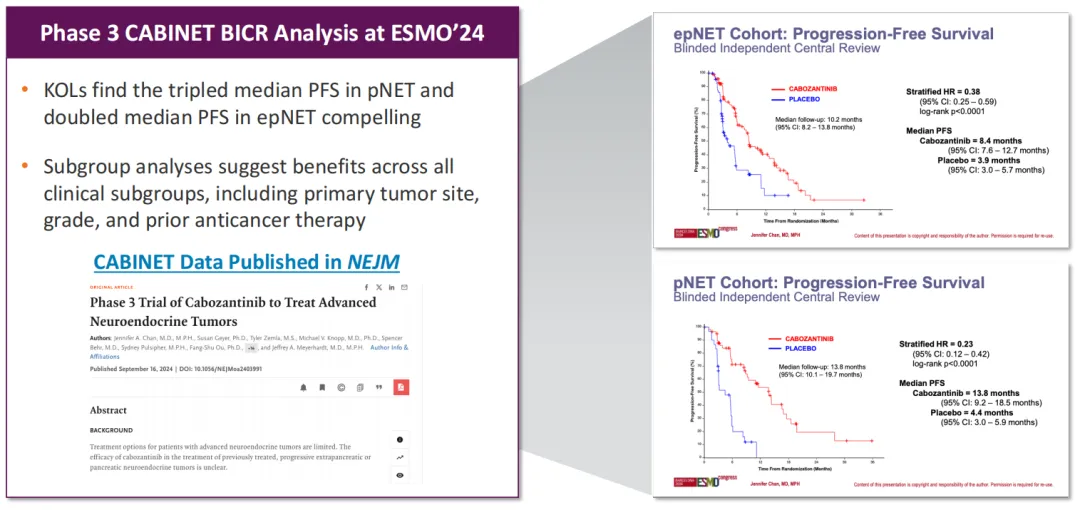
Exelixis与罗氏合作开展了关键3期研究CONTACT-02,旨在比较卡博替尼(CABOMETYX®)与罗氏的抗PD-L1抑制剂阿替利珠单抗(Tecentriq)作为联合疗法,与第二代新型内分泌治疗(NHT)药物治疗转移性去势抵抗性前列腺癌(mCRPC)的疗效。益普生和武田均已选择参与并共同资助该试验,以支持未来在美国以外各自地区潜在的监管递交。2023年8月,Exelixis宣布了CONTACT-02的顶线结果,中期分析显示无进展生存期(PFS)改善具有统计学意义,观察到总生存期(OS)改善的趋势但未达到统计学显著性。另外,2024年9月ESMO会议上披露的数据显示该联合疗法在关键亚组中始终观察到OS获益的趋势,包括肝转移患者(预后最差,需要新疗法)。Exelixis计划在2024年第四季度向FDA递交sNDA申请。
此外,Exelixis曾与BMS合作于2019年5月启动一项关键3期试验COSMIC-313,评估卡博替尼+纳武利尤单抗+伊匹木单抗的三联疗法在晚期肾细胞癌(RCC)患者中的疗效。2024年8月,Exelixis宣布该研究中实验组未显示出优于对照组的OS获益。基于该结果以及自研究启动以来一线RCC治疗前景的变化,Exelixis不再基于该研究寻求进一步监管批准。
04寻找“继任者”
Exelixis曾停掉所有其他项目,孤注一掷地投入在卡博替尼的开发,但其实卡博替尼现在已经面临专利到期的威胁,寻找“继任者”已经刻不容缓。目前,Exelixis正在稳步推进和发展产品管线组合,并利用内部经验和专业知识以及战略合作伙伴关系的力量,识别和寻求新的机会,包括小分子、生物治疗和ADC药物。
第三代酪氨酸激酶抑制剂
当前Exelixis研发管线中的最主要的资产Zanzalintinib是2017年该公司重启药物发现工作后第一个进入临床的内部化合物。Zanzalintinib是第三代口服酪氨酸激酶抑制剂(TKI),建立在卡博替尼的关键优势之上,旨在提供更好的获益/风险特征。Exelixis认为Zanzalintinib有潜力成为靶向VEGFR的首选TKI,无论是作为单一疗法还是联合疗法,涵盖各种实体瘤适应症。
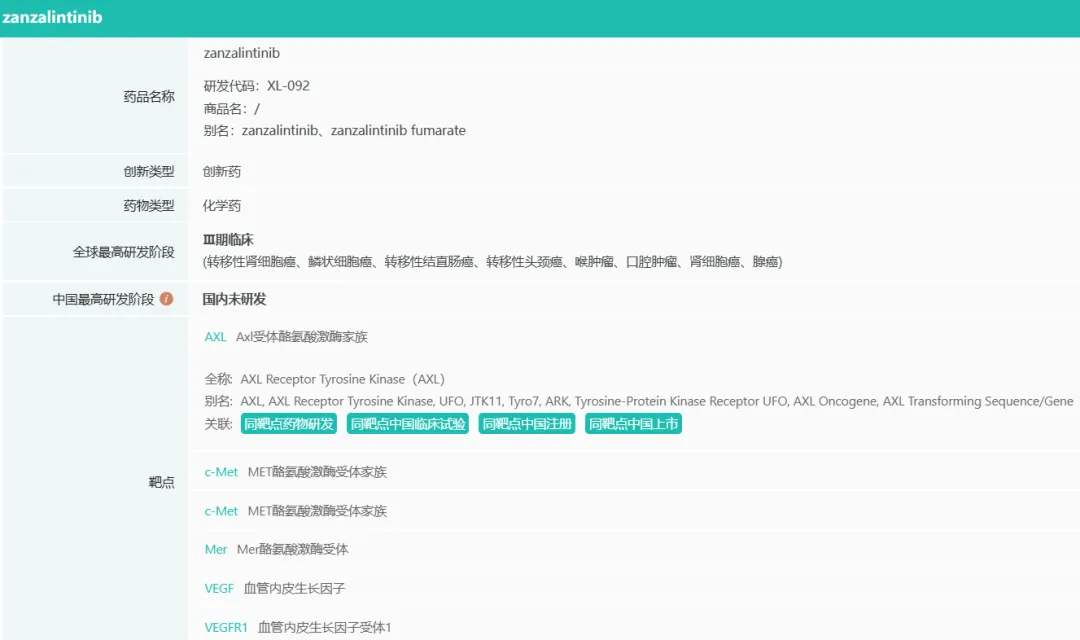
https://pharma.bcpmdata.com/,摩熵医药数据库
迄今为止,Exelixis已经启动了两项大型1b/2期临床试验(STELLAR-001和STELLAR-002),研究Zanzalintinib作为单药疗法或与免疫检查点抑制剂组成联合疗法的有效性。
另外,Exelixis还开展了三项关键试验:
STELLAR-303研究旨在比较Zanzalintinib+阿替利珠单抗作为联合疗法,与瑞戈非尼治疗转移性、难治性非微卫星不稳定性高或非错配修复缺陷型CRC(结直肠癌)患者,该公司2024年8月宣布完成该研究患者招募,预计将于2025年获得初步结果。
STELLAR-304研究旨在比较Zanzalintinib+纳武利尤单抗作为联合疗法,与舒尼替尼在先前未经治疗的晚期非透明细胞RCC(肾细胞癌)患者中的疗效,预计将在2025年中完成患者入组。
STELLAR-305研究是一项关键2/3期试验,旨在比较Zanzalintinib+帕博利珠单抗作为联合疗法,与帕博利珠单抗单药治疗先前未经治疗的PD-L1阳性复发性或转移性SCCHN(头颈部鳞状细胞癌)患者的疗效,患者招募正在进行中。
Exelixis还打算启动其他关键试验,评估Zanzalintinib在广泛的潜在适应症中的应用。STELLAR-311研究是一项计划中的3期关键试验,旨在比较Zanzalintinib与依维莫司作为晚期NET(神经内分泌肿瘤)患者(对原发部位无限制)的首个口服疗法的疗效,预计研究将在2025年上半年启动。
为了进一步探索Zanzalintinib的临床潜力,Exelixis与默沙东达成了临床开发合作,以评估Zanzalintinib与KEYTRUDA®(帕博利珠单抗)联合治疗SCCHN以及与默沙东的口服HIF-2α抑制剂WELIREG®(Belzutifan)联合治疗RCC的潜力。根据合作,默沙东将为Exelixis正在SCCHN患者中进行的3期STELLAR-305试验提供KEYTRUDA®(帕博利珠单抗)。此外,默沙东还将赞助针对RCC的一项1/2期试验和两项关键3期试验,Exelixis将在研究中提供Zanzalintinib和卡博替尼。不过Exelixis将保留Zanzalintinib的所有全球商业和营销权利。
Exelixis认为Zanzalintinib有潜力从2030年开始成为公司主要收入驱动力。

生物治疗
Exelixis当前大部分早期药物发现工作专注于抗癌生物治疗药物,如双特异性抗体、ADC和其他创新疗法,尤其是ADC药物。该公司围绕抗体、连接子、payload和偶联技术建立了多项研究合作和许可,以及一系列战略交易,以生成下一代ADC或多特异性抗体。
2022年11月,Exelixis与Sairopa建立独家临床开发合作和选择权协议,以开发后者的靶向SIRPα的单克隆抗体ADU-1805,该候选药物目前正在晚期或转移性难治性实体瘤患者的1期临床试验中进行评估,患者招募正在进行中。ADU-1805的未来计划包括与已获批的免疫检查点抑制剂联合使用的潜力。
Exelixis在生物治疗项目方面的一些其他研究合作还包括:利用Adagene(天演药业)的SAFEbody®技术开发新型掩蔽ADC或其他具有改善治疗指数潜力的创新生物治疗药物;使用Catalent专有的SMARTag®位点特异性生物偶联技术发现和开发多种ADC;与Invenra合作开发用于治疗癌症的新型结合剂和多特异性抗体。
XB010是Exelixis内部开发的第一个ADC,由靶向肿瘤抗原5T4的单克隆抗体与MMAE荷载偶联而成,使用了Catalent的SMARTag®位点特异性生物偶联技术构建,其5T4靶向单抗是与Invenra合作发现的。在FDA接受Exelixis的IND申请后,2024年8月,Exelixis宣布启动一项1期临床试验,评估XB010作为单药疗法和与帕博利珠单抗联合治疗晚期实体瘤患者的疗效,患者招募正在进行中。
在未来两年时间里,Exelixis还打算将另外四种生物治疗候选药物推向潜在的IND申请,包括一种靶向PD-L1和NKG2A的双特异性抗体XB628;由靶向TF的单抗与拓扑异构酶抑制剂有效载荷偶联而成的下一代靶向TF的ADC药物XB371;靶向ILT2的高亲和力单克隆抗体XB064;靶向肿瘤抗原IL13Rα2的ADC药物XB033。
其他候选小分子
XL309是靶向USP1的潜在同类最佳小分子抑制剂,USP1是BRCA突变肿瘤中的合成致死靶点。XL309由Exelixis在2023年9月独家引进自中国AI制药企业英矽智能(英矽智能研发代号ISM3091)。根据协议,英矽智能获得8000万美元的预付款,并有资格获得基于后续开发、商业化和销售的里程碑付款,以及未来产品净销售额的分级版税。目前Exelixis正在1期临床试验中评估XL309作为单药疗法以及与PARP1/2抑制剂联用治疗晚期实体瘤患者的疗效,患者招募正在进行中。
XL495是一种PKMYT1抑制剂,由于其改善的选择性和药代动力学特征,具有治疗实体瘤的同类最佳潜力。2024年10月,在FDA接受Exelixis的IND申请后,公司宣布启动一项1期临床试验,以评估XL495作为单药疗法和与选定细胞毒性药物联合治疗晚期实体瘤患者的疗效。

Exelixis合作伙伴
Exelixis预计未来将加强BD活动,瞄准具有明显临床差异化和商业成功潜力的GU(泌尿生殖)/GI(胃肠道)肿瘤学后期临床资产,目标是成为GU和GI肿瘤市场的领导者。
05Exelixis近期财务业绩
2024年前三季度,Exelixis总收入16.02亿美元(+19%),其中卡博替尼净产品收入12.9亿美元(+8%)、许可收入3亿美元(+125%)、合作服务收入788万美元(-55%)。
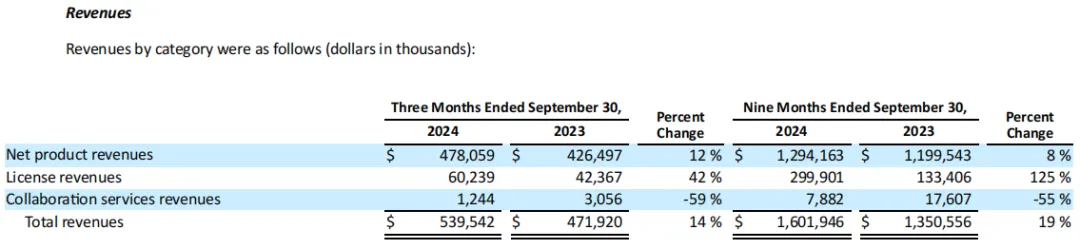
近五个季度Exelixis总收入趋势:
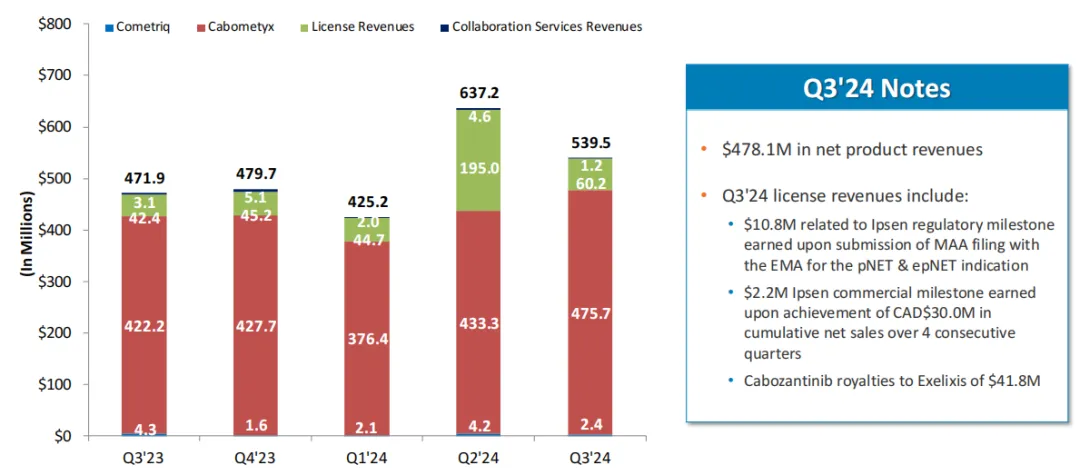
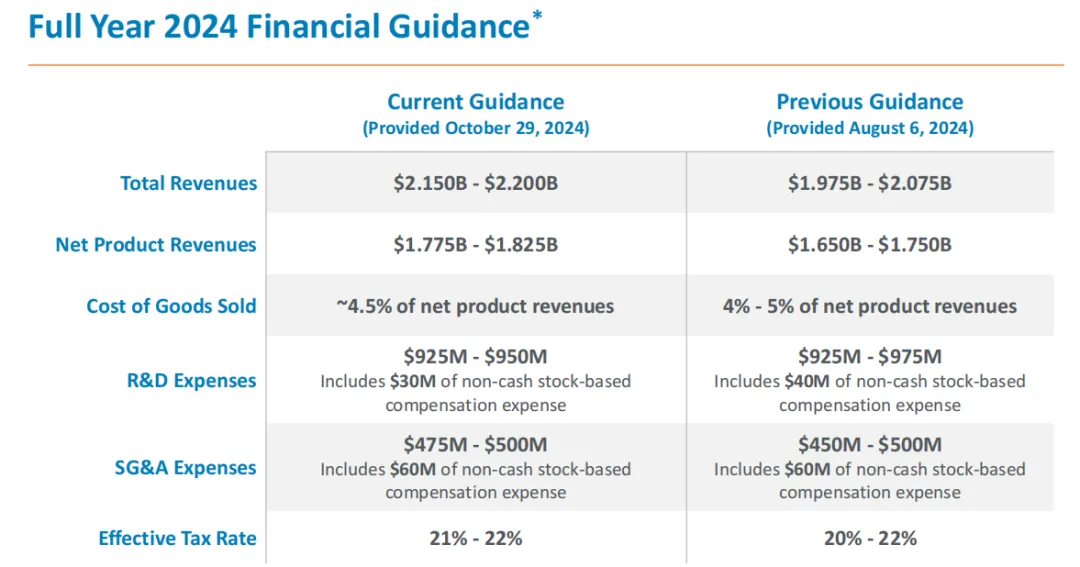
Exelixis预计2024年度总收入将达到21.5~22亿美元,净产品收入将达到17.75~18.25亿美元。
截至2024年12月2日收盘,Exelixis市值101.64亿美元。截止发稿前,市值为95.07亿美元。
参考:
NMPA/CDE;
摩熵医药数据pharma.bcpmdata.com(原药融云数据);
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);
Exelixis: Integrated Drug-Discovery and Development Platform for HumanTherapeutics,McCarthy, Alice A.,Chemistry & Biology, Volume 12, Issue 4, 407 - 408.;
https://ir.exelixis.com/news-releases/news-release-details/exelixis-and-insilico-medicine-enter-exclusive-global-license;
https://mp.weixin.qq.com/s/vAPBQcyIZq0m7YUrzuvv0Q;
https://xueqiu.com/5943184518/311936404;等等

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 109
109

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 97
97

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 86
86