 产业资讯
产业资讯
 医药地理
医药地理  2025-01-22
2025-01-22
 1084
1084
近日,赛诺菲多发性骨髓瘤用药艾沙妥昔单抗获批上市,成为了中国2025年首个进口的单克隆抗体新药。2024年12月25日,安斯泰来的佐妥昔单抗在中国获批上市,作为全球首个CLDN18.2靶向治疗药物,已先后在日本、欧盟、美国获批上市,同时也成为了中国2024年最后一个批准的进口单抗新药。
▐ 中国进口单抗的获批概览
基于Pharma-ONE中国上市药品数据库,统计每一个进口单抗产品(皮下注射单独计数,ADC不计入)的首次获批时间,并按照人源化比例进行分类汇总。2018年是进口单抗获批的增长点,相较于2017年数量翻倍还多,2019年至2023年则稳定维持在8-9个/年,直到2024年NMPA新批准了12个单抗产品,再创历年新高,至今已有76个相关产品获批进口。人鼠嵌合单抗或鼠源性单抗在2017年及以前的早期市场占有一席之地,但近几年较为少见,尤其是鼠源性单抗,2021年至今未有新药;全人源抗体在2019年至2022年更受市场欢迎,如今已被人源化单抗明显超越,同时研发阶段也呈现类似格局。
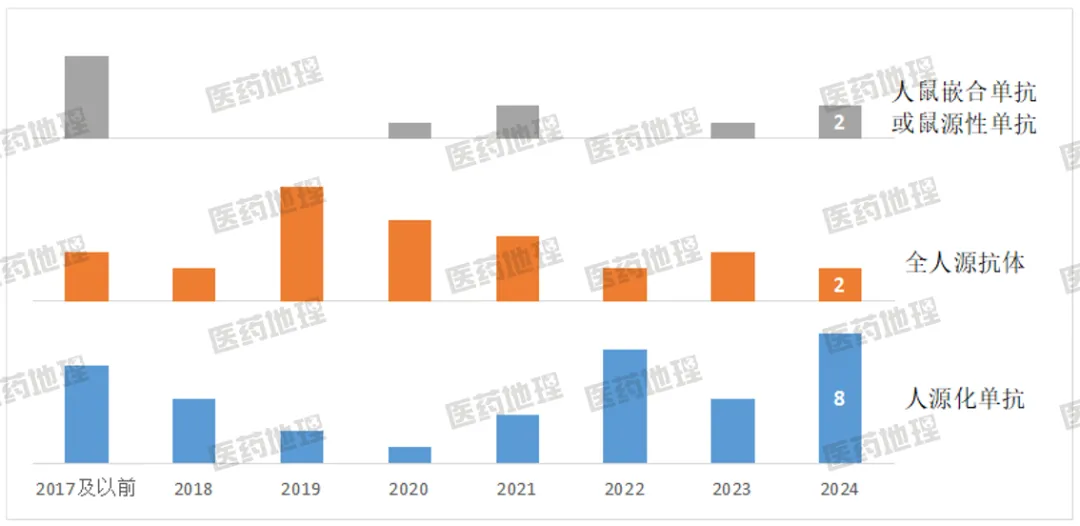
图1 不同年份中国获批进口的单抗产品数量统计
进一步统计上述单抗对应的企业,至少有2个进口产品的企业有17家,对应产品数占所有进口单抗的88.2%。Roche以18个产品遥遥领先,稳居第一,且近五年每年都有新产品获批,近两年每年获批3个。Janssen-Cilag以8个产品位居第二,Novartis的7个紧随其后,两家企业近五年获批的新产品都是3个,分散于不同年份。第三梯队的产品数量是3-4个,Eli Lilly在2024年表现突出,加卡奈珠单抗和多奈单抗分别于1月和12月获批;此外,Boehringer Ingelheim的佩索利单抗在2022年底获批后,2024年一季度其皮下注射制剂也顺利通过了监管机构的审核。
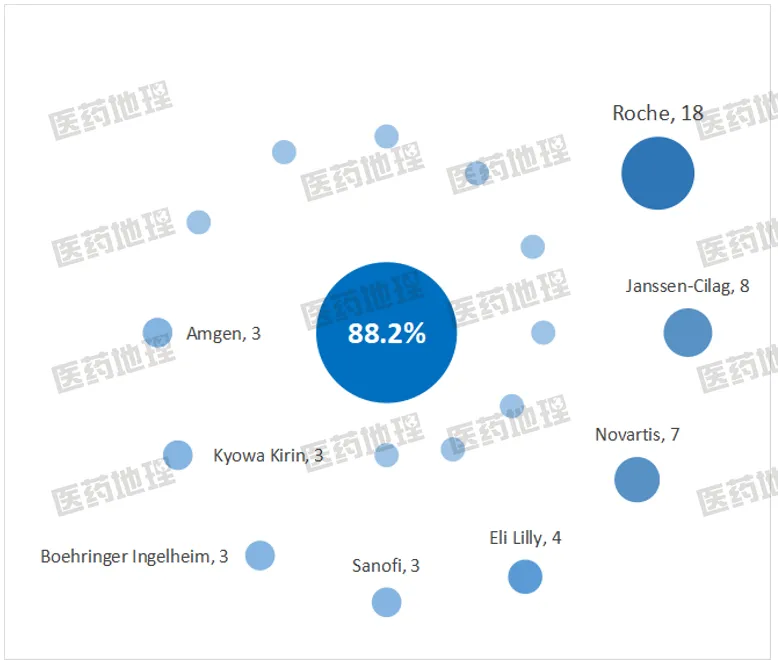
图2 不同企业中国获批进口的单抗产品数量统计
▐ 中国进口单抗的全球获批历程
基于Pharma-ONE全球上市药品数据库,统计2024年中国获批的进口单抗(皮下注射和ADC均不计入)在美国、欧盟、日本这三个国家或地区的首次批准时间。在9个单抗中,有2个尚未获得欧盟批准,有1个日本首批,有1个中国首批。四个国家或地区时间跨度最长的超过6年,最短的仅6个多月。
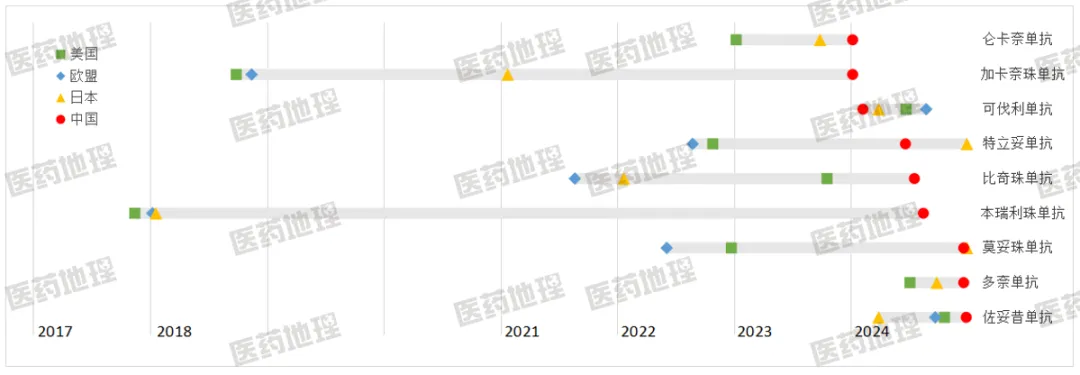
图3 部分进口单抗在不同国家或地区的获批时间对比
▐ 中国首发之速
可伐利单抗,用于治疗阵发性睡眠性血红蛋白尿症(PNH),是Roche在中国市场的全球首发创新药。该产品2024/2/6获中国NMPA批准,此后分别于同年3/26、6/20、8/22获日本PMDA、美国FDA、欧盟EMA首肯,198天内就登陆了全球最重要的四大市场,进展神速。PNH在中国被列入了《第一批罕见病目录》,存在未被满足的临床需求,因此NMPA给予该药突破性疗法认定,并授予优先审评资格。
▐ 计划外的日本首批
佐妥昔单抗,用于治疗特定胃癌或胃食管交界处癌,是Astellas原研的高度靶向药。虽然是一家日本企业,Astellas仍希望在美国进行首发,并已获得优先审评资格,却在2024年1月9日等来了FDA的拒绝批准上市回复函。由于只是第三方生产工厂缺陷而非药物自身问题,该产品在9个月后还是顺利获得了FDA批准,同时也成为了第二个在2024年快速攻克全球四大市场的单抗。
▐ 反复无常的欧盟
仑卡奈单抗和多奈单抗,均用于治疗阿尔茨海默病,分别归属于Eisai/Biogen和Eli Lilly。2024年7月25日,CHMP认为仑卡奈单抗的“风险大于收益”,拒绝其上市申请,而在在此前该产品已获6个国家批准,包括美、日、中。经企业上诉和重新审查,2024年11月,CHMP终于转向建议批准,预计将于2025年落地。受其连带影响仍在审查阶段的多奈单抗,也有望在欧盟转变态度后迎来批件。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 82
82

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 70
70

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 64
64