 产业资讯
产业资讯
 药时空
药时空  2025-02-09
2025-02-09
 1256
1256
近日,艾美荣誉的冻干人用狂犬病疫苗(人二倍体细胞)、康泰生物的二价肠道病毒灭活疫苗(Vero细胞)和四价肠道病毒灭活疫苗(Vero细胞)均获批临床试验。
1、冻干人用狂犬病疫苗
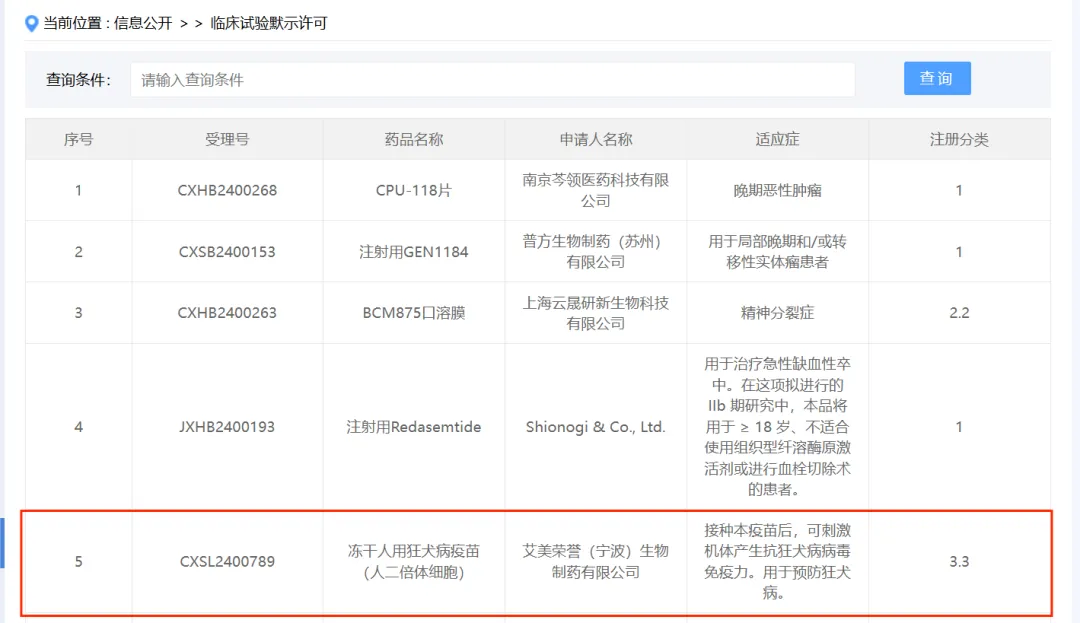
2月8日,据国家药品监督管理局药品审评中心官网显示,艾美荣誉(宁波)生物制药有限公司的冻干人用狂犬病疫苗(人二倍体细胞)获临床试验默示许可,受理号为CXSL2400789。
据艾美疫苗此前披露的信息,与传统的初代人二倍体狂犬疫苗相比,该集团研发的迭代工艺高效价人二倍体狂犬疫苗,率先突破了传统工艺中病毒滴度低、产量低的技术瓶颈,在纯化工艺上进行了优化创新,在产品质量和安全性方面均得到显著提高。与传统的狂犬疫苗接种针次相比,该集团研发的该款产品在接种方式上既可采用“五针法”接种,也可采用“简易四针法”以及“2-1-1四针法”接种,更加灵活方便。
另外,集团已建设完成满足国际化标准的新型工艺高效价人二倍体狂犬病疫苗车间,并已完成商业化规模的三期临床试验样品的生产,具备该产品规模化生产的能力。
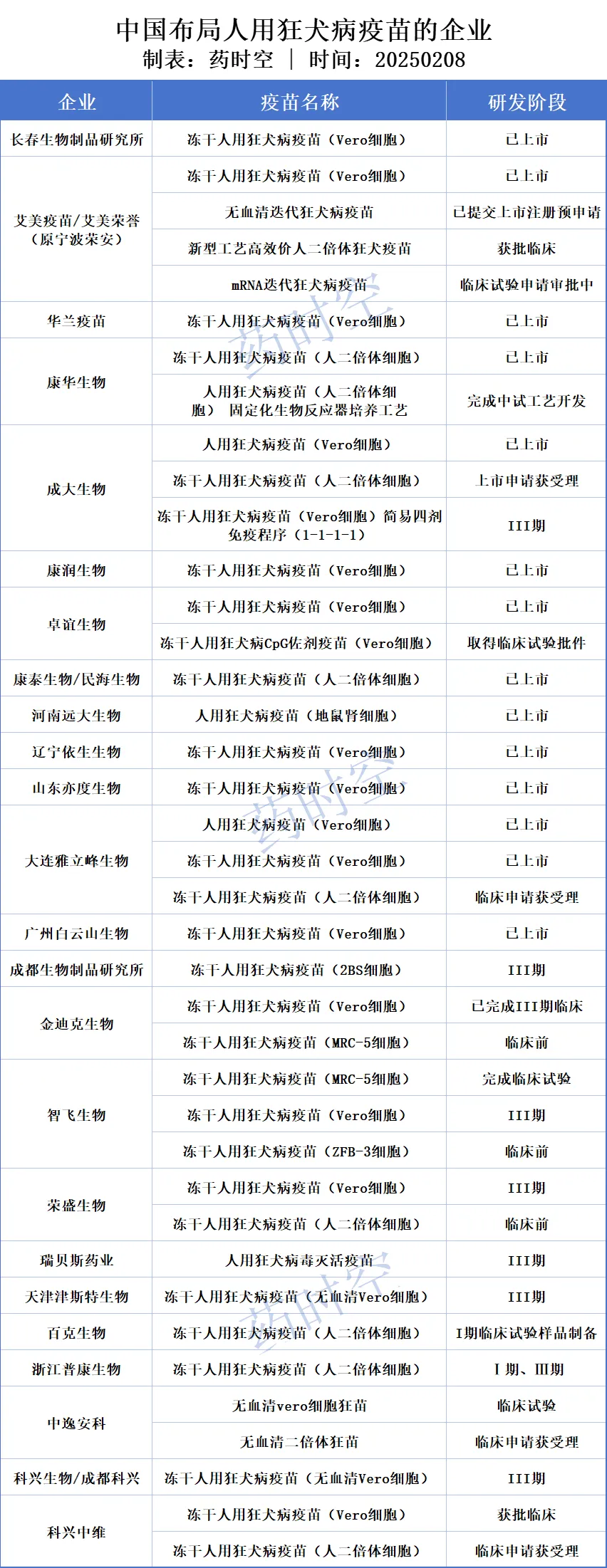
艾美疫苗是全球第二大狂犬疫苗供货商,于2007年9月取得了人用狂犬病疫苗(Vero细胞)的新药申请,并于2008年6月取得了其生产所需的GM证书,该产品长期占据市场领先地位。除上述的新型工艺高效价人二倍体迭代狂犬疫苗外,未来公司即将陆续通过推出无血清迭代狂犬疫苗和mRNA迭代狂犬疫苗产品,加大公司在狂犬疫苗市场的竞争力:
无血清迭代狂犬病疫苗已向国家药品监督管理局提交上市注册预申请。根据已完成揭盲的III期临床研究结果显示,该疫苗具有良好的安全性、免疫原性和免疫持久性,达到临床预设目标。疫苗产品中的动物血清残留是导致疫苗接种人群产生过敏等不良反应的重要因素之一,该集团研发的无血清迭代狂犬疫苗,不含有动物血清,显著提高了安全性,降低了不良反应的概率。截至目前,全球市场上尚未有无血清狂犬疫苗获批上市,该产品有望成为首个上市产品。该集团已建设完成满足国际化标准的无血清迭代狂犬疫苗车间,并已完成商业化规模验证生产,已具备该产品规模化生产能力。
mRNA迭代狂犬病疫苗,经过大量动物试验证明,与传统通过病毒培养方式的狂犬疫苗相比,具有免疫接种针次显著减少、保护性中和抗体产生速度显著加快,综合保护性效果显著增强的特点。
2、肠道病毒灭活疫苗
2月7日,康泰生物发布公告称全资子公司民海生物研发的二价肠道病毒灭活疫苗(Vero细胞)和四价肠道病毒灭活疫苗(Vero细胞)获得国家药品监督管理局的《药物临床试验批准通知书》,同意开展临床试验。

其中,二价肠道病毒灭活疫苗(Vero细胞)适用于6月龄至71月龄EV-A71、CV-A16易感者,可刺激机体产生抗EV-A71、CV-A16的免疫力,用于预防肠道病毒EV-A71、CV-A16感染所致的手足口病等传染病;四价肠道病毒灭活疫苗(Vero细胞)适用于6月龄至71月龄EV-A71、CV-A6、CV-A10、CV-A16易感者,可刺激机体产生抗EVA71、CV-A6、CV-A10、CV-A16的免疫力,用于预防肠道病毒EV-A71、CV-A6、CVA10、CV-A16感染所致的手足口病等传染病。
手足口病是由多种肠道病毒感染引起的一种儿童常见传染病,目前尚无针对肠道病毒感染的特效药物,接种疫苗是预防手足口病及其大爆发最有效和最经济的措施。目前全球尚无二价肠道病毒灭活疫苗(Vero 细胞)、四价肠道病毒灭活疫苗(Vero 细胞)获批上市。在我国,目前布局二价手足口病的企业还有科兴生物(二价肠道病毒灭活疫苗(Vero细胞),Ⅱ期揭盲)、艾美疫苗(EV71-CA16二价手足口病疫苗(人二倍体细胞),Ⅰ期)、智飞生物(双价手足口病疫苗,临床前)等。此外,科兴生物研制的四价肠道病毒灭活疫苗(Vero细胞)也已获批临床试验。

 产业资讯
产业资讯
 药视声Medispace
药视声Medispace  2025-11-10
2025-11-10
 3
3

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 154
154

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 160
160