 政策法规
政策法规
 中国医药创新促进会
中国医药创新促进会  2025-03-07
2025-03-07
 4022
4022
新年伊始,Deepseek的横空出世搅动了全产业创新的风云,数据资源的高效运用,进一步成为了新一轮科技革命的关键之战,也成为了今年“两会”上各方重点关注的提议,在《政府工作报告》中也明确,“加快完善数据基础制度,深化数据资源开发利用,促进和规范数据跨境流动”。
我国庞大的患者数量使我们拥有世界上潜在规模最大的医学数据资源,将这些资源转化为创新资源将极大地助力我国生物医药产业发展。目前,我国医学大数据在维度、广度和深度都在快速增长。各大医学机构已建设了完备的电子信息采集、记录、处理和分析系统,包括临床医学研究数据、生物信息数据、医院信息系统数据、医疗卫生服务平台数据、公共卫生普查数据等,将临床全过程数字化这些临床数据不仅提高了诊疗的效率和精准度,更是精准医学的主要基础,为填补临床空白、满足患者需求的创新药研发提供了大量宝贵的资源。
然而,尽管各大医疗机构存在大量数据资源存量,却未转化为资源增量。根据现有研究成果[①][②],结合中国药促会调研发现,目前各医院数据管理分散,不同医院甚至不同科室、不同课题组之间临床信息系统各成孤岛,数据格式和标准不一、数据交汇机制缺乏,部分数据甚至还存在合规管理不严格、隐私保护机制不完善、数据质量不高等问题。当新药研发团队想要获取临床数据资源助力临床研究时,发现难以全面获取,也缺少通畅的数据交易渠道,即使在部分已完成的交易中,也出现了产权确权困难、估价定价标准不一、信任机制不完善等问题[③]。
如何打通当前临床数据共享和交易的堵点?本文将从国际经验介绍出发,共同探讨临床数据共享与交易机制的建设方向。
一国际经验:临床数据资源驱动医药创新的关键步骤
1顶层设计:构建数据共享和交易的法律基础
将临床数据相关内容写入法律,是保障数据安全、明确权属和边界、释放数据价值的基础,是数据共享和交易机制得以运行的重要支撑。
美国于2012年发布的《21世纪治愈法案》(21st Century Cures Act),特别提到了要通过临床数据的共享促进科学进步和公共卫生,鼓励政府、科研机构、临床研究机构、药企和患者组织之间通过数据共享协议明确各方的权利和义务,这些协议通常包括数据的使用范围、使用期限、数据安全要求以及利益分配机制等内容。但同时也明确数据合规性要求,对于个人健康信息等数据,必须严格遵守1996年颁布的《健康保险可携性和责任法案》(HIPAA),这不仅保护了患者的隐私权,还为数据的合法交易和确权提供了法律依据。
2013年5月,美国政府发布《开放数据政策-将信息作为资产进行管理》(0pen Data Policy-Man-aging Infommalion as an Asset)备忘录,要求各机构以支持下游信息处理和传播活动的方式收集或创建电子数据信息,包括使用开放格式、数据标准等,最大限度地提高数据的互操作性和信息可访问性。
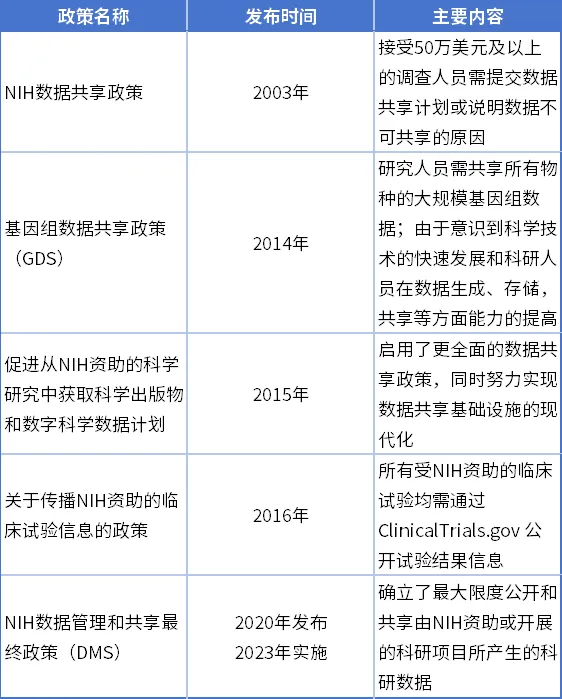
随着顶层设计的明确,NIH随即发布了一系列临床数据共享的具体落实政策,对临床研究的数据提出了必须能够实现共享的硬性要求:
表1 NIH数据资产管理与共享政策[④]
欧盟则通过《通用数据保护条例》(GDPR)为医学数据的共享和交易提供了法律保障。GDPR不仅规定了数据的隐私保护要求,还明确了数据主体的权利,如数据访问权、数据删除权等。同时,欧盟还通过《欧洲健康数据空间》(EHDS)计划,推动成员国之间的健康数据共享,为数字医疗服务和产品培育单一市场。
此外,英国、加拿大等国家也相继出台了相关法律法规,如英国的《数据保护法案》《数据政策通用原则》《数据管理和共享政策》;加拿大的《基因组数据发布与共享政策》《个人信息保护与电子文件法》(PIPEDA)等,都对临床机构和团队明确提出了数据质量和共享的要求,清晰数据管理权责,也为临床数据的共享和交易提供了依据,促进了医学大数据的流通和价值挖掘。
2统一标准:确保数据互操作性和质量
统一标准的制定和推广不仅提高了数据的互操作性,还提升了数据的质量和可靠性。临床数据源文件分散在诊疗、随访、临床试验等不同的业务系统中,结构、采集方式的不同导致呈现效果差异,对不同来源的临床数据进行标准化是一个庞大的工程。通过采用统一的数据格式、编码体系和元数据标准,医学大数据的共享交易变得更加高效和准确,为数据分析和应用提供了坚实的基础。
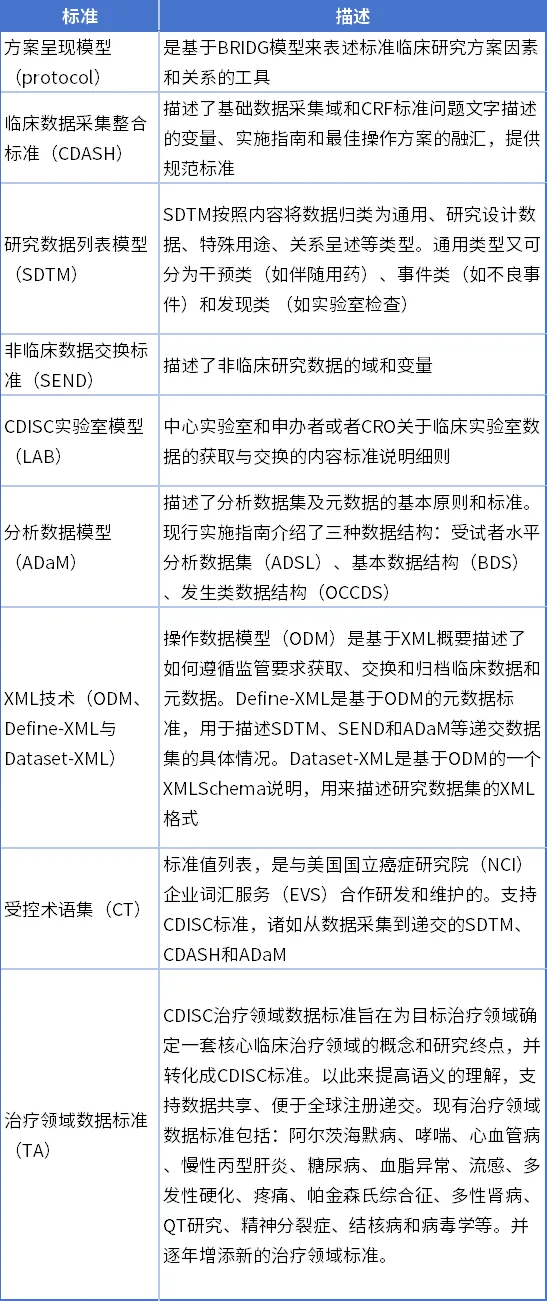
例如,在临床试验数据标准化方面,为提高临床数据质量,促进国际合作和交流共享,多个国际组织开发了各项数据标准,直接和突出的是CDISC系列标准,它与用于医院医疗系统信息与临床试验数据交换的HL7、国际标准化组织(IOS)标准、用于实验室信息语义标准化的LONIC及ICH开发的医学标准术语MedDRA等也有兼容和一致性。
表2 CDISC核心标准一览表[⑤]
FDA自2014年已发布文件强制要求电子提交的项目需遵循CDISC标准,随后日本PMDA、欧洲的EMA也明确提出使用CDISC标准的要求并发布正式文件加入强制要求。在多国监管部门的努力下,CDISC数据标准的使用在国际范围扩大化,一些业内主流数据管理软件、数据分析软件等也开发、嵌入了CDISC标准化数据模块,增加了标准的通用性和可及性。目前我国多家创新药企业也加快对于CDISC的引入,加速国际临床试验的开展和国际化进程。
随着人工智能(AI)技术的飞速发展,如何借助AI的强大功能促进临床信息系统的建设管理并推动数据标准化建设,已成为临床数据资源挖掘的新方向[⑥]。
3统筹网络:构建数据共享和交易的平台
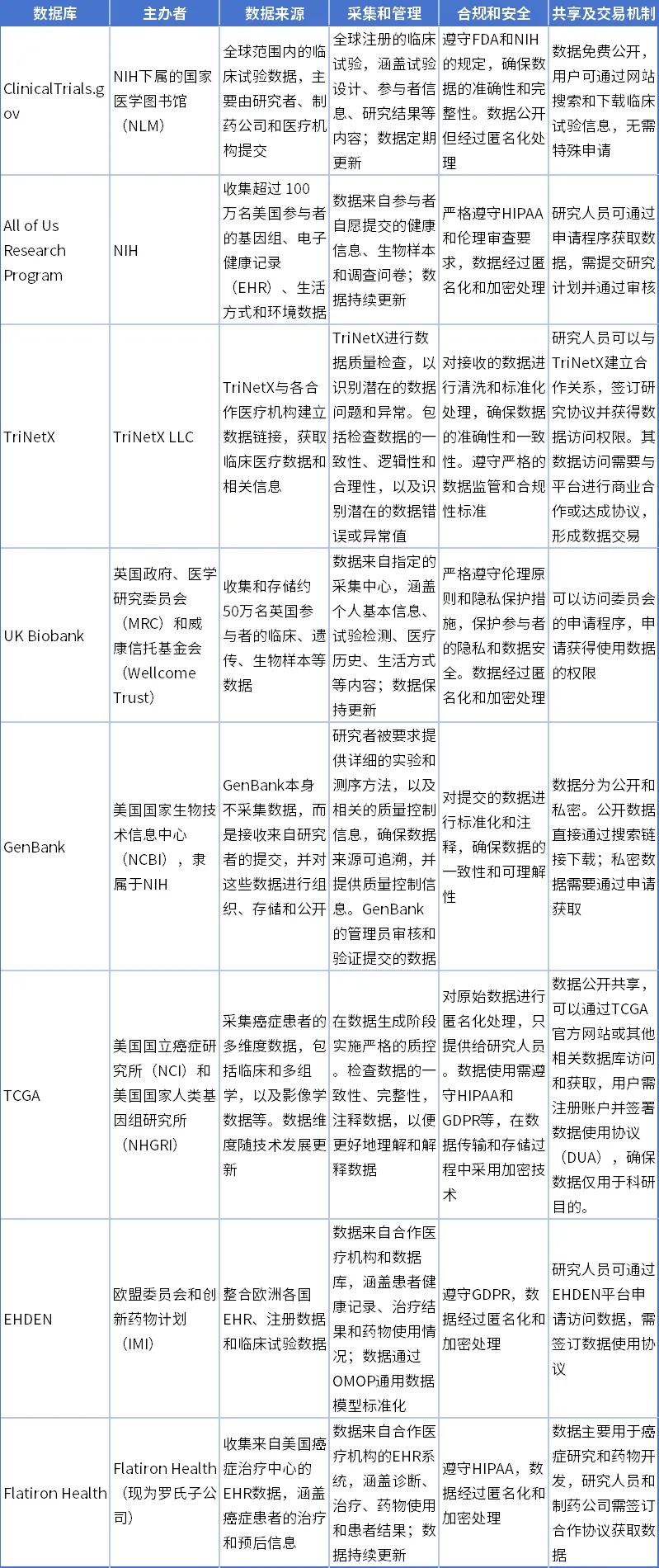
在法律对医学数据的共享和交易明确的基础上,还需要依托于强大的网络基础设施。国际上,许多国家和地区通过建立临床研究网络,收集全国高质量临床数据和患者资源信息,建立临床数据库和病人样本资源库实现了数据的集中管理、共享,并推进公私合作和交易,提高全国临床研究和新药研发的效果和效率。
表3 各国大型临床数据和共享平台
二
发展方向和建议
当前,我国已具备临床数据资源储存、分析与管理的硬件设施资源和技术条件,部分地区已开始着手医疗数据使用和赋能生物医药产业发展的尝试[⑦]。然而法规政策的完善、与国际接轨的数据标准化、数据所有权和使用权的明确、合规交易空间的试运行等方向的建设仍有较大空间,临床数据无法实现畅通高效的共享和交易,严重制约着数据资源对医药创新发展的促进作用。同时,随着人工智能技术的快速发展,临床数据库和AI的有效结合,将成为未来“大数据+医药创新”的重要发展方向。基于以上分析,我们提出以下建议:
01加强顶层设计,制定国家层面对临床数据的共享机制并支持药械疗法的创新提出硬性要求和建设规划,明确发展目标和实施路径。
02完善法律法规,制定专门的临床数据共享交易管理办法,明确数据权属、隐私保护、数据安全等方面的要求。
03建立统一的、与国际接轨的数据标准和质量控制体系,提高数据的互操作性和可靠性。
04加强技术创新,探索人工智能、区块链、联邦学习等新技术在数据共享交易平台中的应用,提高数据安全性和利用效率。
05鼓励条件成熟的地区、国家医学中心或重大专病网络等,优先建设具备共享机制和条件的大型临床数据库,并推进数据确权、定价和交易的试点建设,总结经验、逐步推广。
通过以上措施,逐步将我国庞大丰富的临床数据资源逐步转化为创新资源。中国医药创新促进会愿意和产业界、医学界一道,积极推进以上建议的落地实行。如您对此感兴趣,可与本项目负责人联系。
①沈洪兵 大数据时代的临床医学研究——机遇和挑战,南京医科大学学报(自然科学版) 2020.40(3):303-305
②姜勇,孟霞,王拥军 建立卒中临床研究大数据,推动精准医学发展 中国卒中杂志 2020.15(6):573-576
③黄锦辉 医学数据交易渐“走红”,哪些“暗礁”需警惕?南方日报2024.12.28
④Final NIH Policy for Data Management and Sharing and Supplemental Information,https://www.federalregister.gov/documents/
⑤CDISC官网 https://www.cdisc.org/standards.
⑥曹静,易欣 人工智能在临床实验室变革中的潜力,中华检验医学杂志,2025,48(2)
⑦让医疗数据加速释放巨大潜力!浦东积极推进“医疗大数据实验室”建设 “浦东发布”2025.2.26

 政策法规
政策法规
 国家药监局
国家药监局  2025-09-16
2025-09-16
 78
78
 政策法规
政策法规
 CDE
CDE  2025-08-23
2025-08-23
 290
290

 政策法规
政策法规
 中国卫生杂志
中国卫生杂志  2025-08-09
2025-08-09
 767
767