 产业资讯
产业资讯
 药研网
药研网  2025-03-26
2025-03-26
 1178
1178
3月24日, 康诺亚发布2024年业绩报告,公司收入为人民币4.28亿元,同比增长21%;毛利为人民币4.16亿元,同比增长31%;年内亏损为人民币5.15亿元,去年同期亏损3.57亿元。
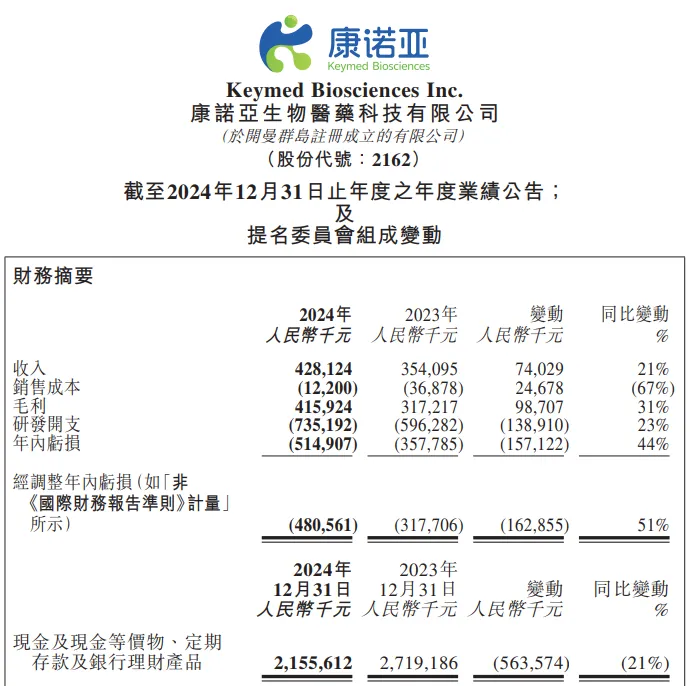
截止2024年12月31日,康诺亚现金及现金等价物、定期存款及银行理财产品总额为人民币21.56亿元。
受此消息影响,截止发稿,康诺亚股票绩后涨超5%!
研发管线梳理及核心产品进展
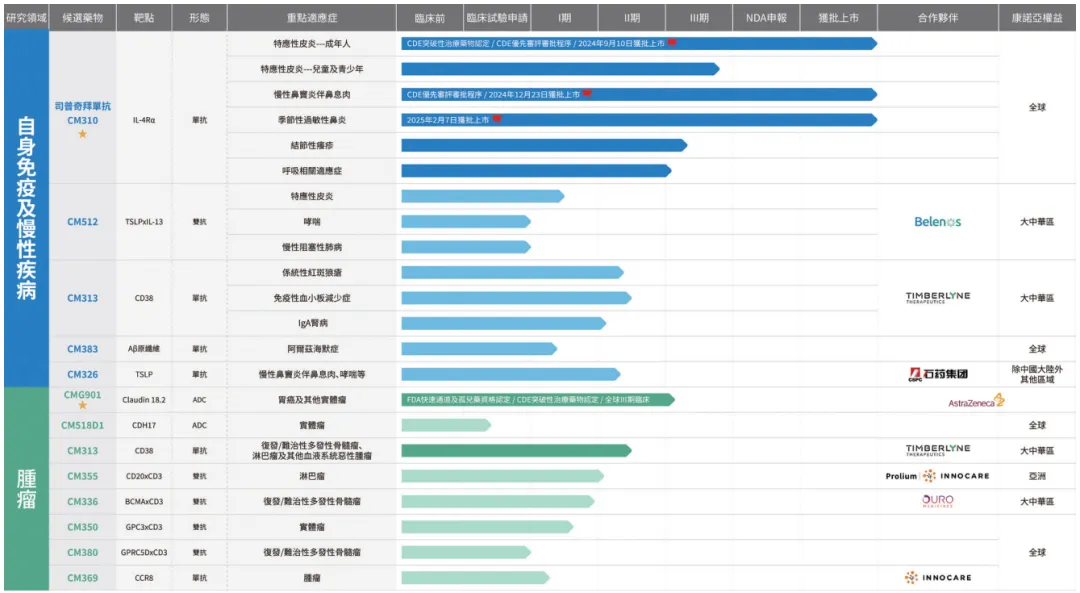
康悦达®(司普奇拜单抗,IL-4Rα抗体)三项适应症获批上市,截止2024年底,3个半月内实现销售收入人民币约4,000万元。
2024年9月,康悦达®(司普奇拜单抗)治疗成人中重度特应性皮炎的药品上市许可申请获国家药监局批准,成为国内首个自主研发、全球唯二获批上市的IL-4Rα抗体药物,开启特应性皮炎治疗EASI-90新时达。
2024年12月,康悦达®(司普奇拜单抗)治疗慢性鼻窦炎伴鼻息肉的药品上市许可申请获国家药监局批准,成为目前国内首个批准用于治疗慢性鼻窦炎伴鼻息肉的生物制剂。
2025年2月,康悦达®(司普奇拜单抗)治疗季节性过敏性鼻炎的药品上市许可申请获国家药监局批准,成为全球唯一获批治疗季节性过敏性鼻炎IL-4Rα生物制剂。
CMG901/AZD0901(Claudin 18.2抗体偶联药物)获FDA快速通道资格认证、CDE突破性治疗药物认定
AstraZeneca就CMG901(AZD0901)治疗晚期实体瘤开展了多项全球多中心临床研究,包括治疗2L+胃癌的临床III期、1L胃癌的临床II期、1L胰腺癌的临床II期及2L+胆道癌的临床II期研究。
2024年6月,CMG901(AZD0901)治疗晚期胃癌/胃食管结合部腺癌的I期临床研究最新数据在2024年美国临床肿瘤学会(ASCO)年会上以口头报告形式发布。2025年1月6日,该临床I期数据在国际权威肿瘤学期刊《The Lancet Oncology》上发表。研究结果显示,所有93例Claudin 18.2高表达胃癌/胃食管结合部腺癌受试者的中位无进展期(mPFS)为4.8个月,中位总生存期(mOS)为11.8个月。
CM313(CD38抗体):启动并推动CM313治疗复发/难治性多发性骨髓瘤的I/II期临床研究。
2024年6月,CM313治疗成人原发免疫性血小板减少症的研究成果发表在《新英格兰医学杂志》。研究显示,其对难治性免疫性血小板减少症患者的治疗应答率高达95%,表现出快速且持续的疗效反应,且安全性良好。
2024年7月,完成CM313治疗系统性红斑狼疮的Ib/IIa期临床研究,并计划于2025年上半年启动II期临床研究。
启动并推进CM313治疗原发免疫性血小板减少症的II期临床研究,正在进行患者入组工作,首例患者已于2024年11月完成入组及给药。
2025年初启动并推进CM313治疗IgA肾病的II期临床研究,目前正在进行患者入组的准备工作。
2025年1月,康诺亚与Timberlyne Therapeutics, Inc.订立独家对外许可协议,授予Timberlyne在全球(不包括中国内地、香港、澳门及台湾)开发、生产及商业化CM313的独家权利。
CM512(TSLPxIL-13双特异性抗体)
启动并推进CM512治疗中重度特应性皮炎的I期临床研究,首列受试者已于2024年9月完成入组。已于2025年一季度,启动海外治疗哮喘的临床I期研究。
CM336(BCMA x CD3 双抗):持续推进CM336治疗复发或难治性多发性骨髓瘤的I/II期临床研究,目前处于剂量扩展阶段。
2024年12月,第66届美国血液学会(ASH)年会以墙报形式公布了CM336治疗复发或难治性多发性骨髓瘤的I/II期临床研究的最新数据。
CM383(Aβ原细纤维丝抗体): 完成CM383 Ia期临床研究,全部受试者已出组。
2024年11月,CM383治疗阿尔茨海默病源性轻度认知功能障碍和轻度阿尔茨海默病的 Ib 期临床研究完成首例受试者入组。
CM518D1(CDH17 ADC)
已向CDE递交CM518D1临床试验申请,并计划开展治疗晚期实体瘤I/II期临床试验。
CM355/ICP-B02(CD20 x CD3 双抗)
持续推进CM355治疗复发/难治性非霍奇金淋巴瘤的I/II期临床研究,初步数据均显示CM355对于滤泡性淋巴瘤(FL)与弥漫性大B细胞淋巴瘤(DLBCL)患者具有良好的疗效。
康诺亚、北京诺诚健华及双方合资公司共同与Prolium Biosciences就CM355的开发及商业化订立协议,授予Prolium在全球非肿瘤适应症以及亚洲以外地区肿瘤适应症方面开发、注册、生产及商业化CM355的独家权利。
CM350(GPC3 x CD3 双抗)
持续推进CM350治疗晚期实体瘤I/II期临床研究,目前处于I/II期临床研究的剂量递增阶段,已观测到初步的积极疗效。
CM369/ICP-B05C(CCR8抗体)
持续推进CM369治疗晚期实体瘤及复发/难治性非霍奇金淋巴瘤的I期临床研究。
CM380(GPRC5D x CD3双特异性抗体)
正在计划开展CM380治疗复发或难治性多发性骨髓瘤患者的I/II期临床研究。
多起BD—NewCo 模式专业户
康诺亚作为连年亏损的 Biotech,如今已成功转型为“NewCo 模式专业户”。此前,康诺亚先后与阿斯利康等国际医药巨头签订授权合作,并获Bain Capital、TPG、RTW、OrbiMed等全球领先投资机构支持,以NewCo创新模式多次出海。自成立以来,康诺亚各项BD项目收获超10亿人民币首付款,潜在收入超210亿人民币
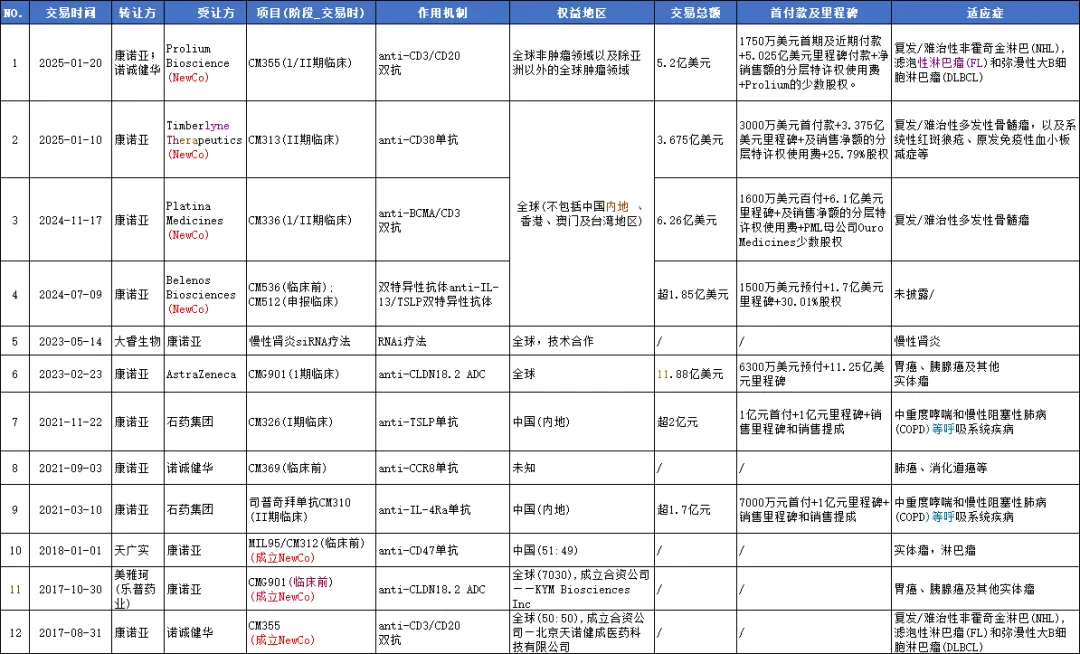
康诺亚董事长兼首席执行官陈博博士表示,"过去一年,康诺亚实现重要突破,康悦达®(司普奇拜单抗)成人中重度特应性皮炎、慢性鼻窦炎伴鼻息肉、季节性过敏性鼻炎三项适应症获批上市,以国产创新开启治疗新时代;各项高潜力管线取得重要进展,多个创新成果发表于国际顶级期刊。公司获全球知名投资机构支持,以NewCo创新模式四度出海,让自主创新产品登上国际舞台。
2025年,将是我们全面建立自身免疫性疾病等创新疗法领先优势的关键之年,我们将继续推进差异化临床研发,加速免疫疗法的创新迭代,促进重点产品临床价值的深度挖掘,加速患者创新药物可及性,驱动公司长期、稳健、高质量发展。"


 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 82
82

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 70
70

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 65
65