 政策法规
政策法规
 中国医药创新促进会
中国医药创新促进会  2025-04-15
2025-04-15
 4305
4305
引言
当全球生物医药产业驶入深水区,创新药“出海”已不仅是企业扩张的必选项,更是中国医药产业升级的战略支点。日本作为全球第三大医药市场,与中国药企在靶点开发、成本控制方面优势互补,成为中国创新药企出海的重要一站。
中国医药创新促进会始终致力于深化中日医药产业合作,并在医药创新领域取得了一系列实质性成果。为全面助力中国药监、生物技术公司、投资界深入了解日本药品监管法规、申报流程、沟通交流以及生产和检查等相关事宜,我会联合研发客、上海市生物医药科技产业促进中心以及泰格医药,共同开设“出海日本”专栏,特邀日本法规监管领域的资深专家发布专业性文章。撰稿人包括著名的药品开发及监管专家植村昭夫博士、东内祥浩先生和高野哲臣先生。同时研发客主编毛冬蕾女士还将对日本政府、学术界以及中日两国业内专家进行访谈,共同探讨开发及监管热门话题。
中国药促会中日医药合作交流
联系人:马明尧
电话:13520846026
邮箱:mamy@phirda.com
撰文|医药研发达人主编 高野哲臣(t2T Healthcare股份公司总裁兼首席执行官)
中文版翻译负责人:医药研发达人主编 高野哲臣
• 从2018年1月到2025年1月在ClinicalTrials.gov登记的临床试验数量来看,中国由于鼓励创新药同步开发成为全球增长率最高的国家,而日本登记的试验数量增长则放缓。
• 日本在ClinicalTrials.gov登记的临床试验数量比较少,其原因是日本大量临床试验信息未在ClinicalTrials.gov登记,而只登记在JapicCTI、jRCT等日本独有的网站上。
• 中国临床试验信息登记义务起始于2013年,日本起始于2018年。自2005年以来,日本设立了三个临床试验信息登记机构(UMIN-CTR、JapicCTI、JMACCT),2018年新增jRCT。日本临床试验搜索网站集成了四个机构数据,增加了复杂性。
• 许多全球制药企业按照全球统一的标准和操作披露临床试验信息,使用ClinicalTrials.gov作为公开平台。但一些日本制药企业基本不使用ClinicalTrials.gov,只使用强制要求的jRCT。建议查找在日本已完成或正在进行的临床试验信息时,首先搜索ClinicalTrials.gov,如果与ClinicalTrials.gov的信息不重复或者担心信息可能有遗漏时,再结合使用jRCT。
在本次系列 A《日本的临床试验和药品市场》第三篇中,由高野介绍“日本独有的临床试验信息登记网站”以及“2018年起在日本开始实施的临床试验信息登记的义务”。
在第3期系列A第二篇(3月14日出版)中,曾提到“ICH E17(MRCT 指导原则)于 2017 年 11 月达到第4阶段,并于 2018 年起在欧洲、美国和东亚依次实施。然而,自其实施后,无论是本土试验还是多区域临床试验(MRCT),东亚临床试验格局似乎呈现出两极分化:中国等国的试验数量持续增长,而日本等国则陷入停滞”。本期首先将介绍在ClinicalTrials.gov (https://clinicaltrials.gov/) 中登记的临床试验数量在各国和地区的变化趋势。
需要注意的是,本文中多处包含笔者的主观观点,请读者自行斟酌留意。
01
在ClinicalTrials.gov中也显现出日本临床试验数量增长放缓
图1显示了从2018年1月到2025年1月,在ClinicalTrials.gov登记的各国和地区临床试验数量变化趋势。2025年,中国的试验数量是2018年的3.69倍,中国由于鼓励创新药同步开发成为自E17实施(2017年11月达到第4阶段)以来全球增长率最高的国家。
笔者分析了国家药监局药品审评中心(CDE)每年发布的《药品审评报告》及《中国新药注册临床试验进展年度报告》的近几年数据,结果表明,自2018年以来推动中国临床试验数量增长的主要因素是创新药所带来的以下几类试验:
1)中国企业主导的本土试验;
2)欧美大型制药企业开展的包含中国在内的MRCT;
3)中国企业主导的包含中国及外国(如美国)在内的MRCT。
另一方面,日本在2025年登记的试验数量是2018年的1.71倍。根据ClinicalTrials.gov的趋势判断,在东亚地区,不仅不及中国,还落后于数量增长为2.14倍的中国台湾和1.82倍的韩国,显示出日本临床试验数量增长的放缓。笔者认为,其原因是,在日本临床试验数量增长的主要因素——日本企业主导的本土试验,欧美制药企业开展的包含日本在内的MRCT和日本企业主导的包含日本及外国在内的MRCT——的增长速度不如中国。
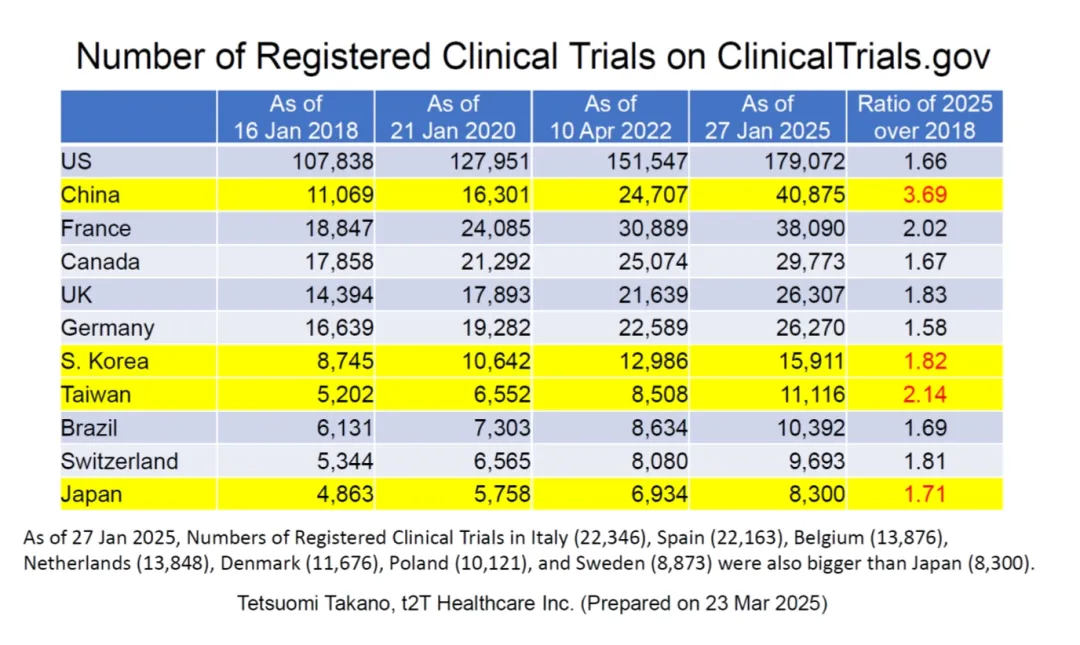
图1. ClinicalTrials.gov中登记的各国和地区临床试验数量变化趋势(2018年1月到2025年1月)
(高野哲臣,t2T Healthcare Inc.,2025年3月23日制作)
根据笔者统计,截至2025年1月27日,日本在ClinicalTrials.gov登记的临床试验数量为8,300例,位居全球各国和地区第18位。
那么,日本的临床试验数量真的如此之少吗?答案是否定的。
其原因在于,无论是在2018年3月日本开始实施临床试验信息登记义务之前还是之后,日本的大量临床试验信息并未在ClinicalTrials.gov登记,而是登记在JapicCTI、jRCT等日本独有的网站上。
02
中国与日本临床试验信息登记义务的历史
在讨论日本独有的临床试验信息登记网站之前,首先需要提到中日两国在实施临床试验信息登记义务时间上的差异。
在中国,临床试验信息登记的义务,起始可以追溯到2012年11月1日,当时CDE网站开通了《药物临床试验登记和信息公示平台》(试运行)。随后,2012年11月19日CDE发布了《关于试行药物临床试验信息登记的通知》,这标志着临床试验信息登记,成为了申请人的义务的开始。2013年9月17日,原国家食品药品监督管理总局发布了《关于药物临床试验信息平台的公告》(2013年第28号),2013年11月25日,CDE发布了《药物临床试验登记填写指南(V1.0版)》,由此,在CDE网站进行临床试验信息的登记和公示的义务正式实施。
因此,中国开始强制实施临床试验信息登记的时间是2013年。
而在日本,临床试验信息登记义务的起始时间是2018年,较中国晚了5年。具体情况将在下一章详细介绍。
03
日本独有的临床试验信息登记网站
自2005年以来,日本已分别设立了三个临床试验信息登记机构:
• UMIN-CTR 临床试验登记系统——由大学医院医疗信息网络(UMIN)运营,主要针对学术界和大学的临床研究等;
• JapicCTI——由财团法人日本医药信息中心(Japic)运营,主要针对企业主导的临床试验;
• JMACCT——由公益社团法人日本医师会运营,主要针对研究者发起的临床试验。
此外,2018年还新增了临床研究等提交和公开系统(jRCT, Japan Registry of Clinical Trials)(https://jrct.mhlw.go.jp/),主要针对特定临床研究(参见以下【※】内容)等。
【※】日本临床研究的分类
• 所有以人类为对象的医学研究称为“临床研究”,根据是否伴随“干预”,“临床研究”分为“观察研究(非干预研究)”和“临床试验(干预研究)”。
• 临床试验(干预研究)进一步分为以药品注册为目的的“治验 (日本独有的专业用语为“以药品注册为目的的临床试验”)”和不以药品注册为目的的“干预性临床研究”。
• “干预性临床研究”中,属于“使用“未批准”或“适应症外”的药品等进行的临床研究”,或者“由制药企业等资助进行的药品等的临床研究”,但不属于“治验”的,称为“特定临床研究”。
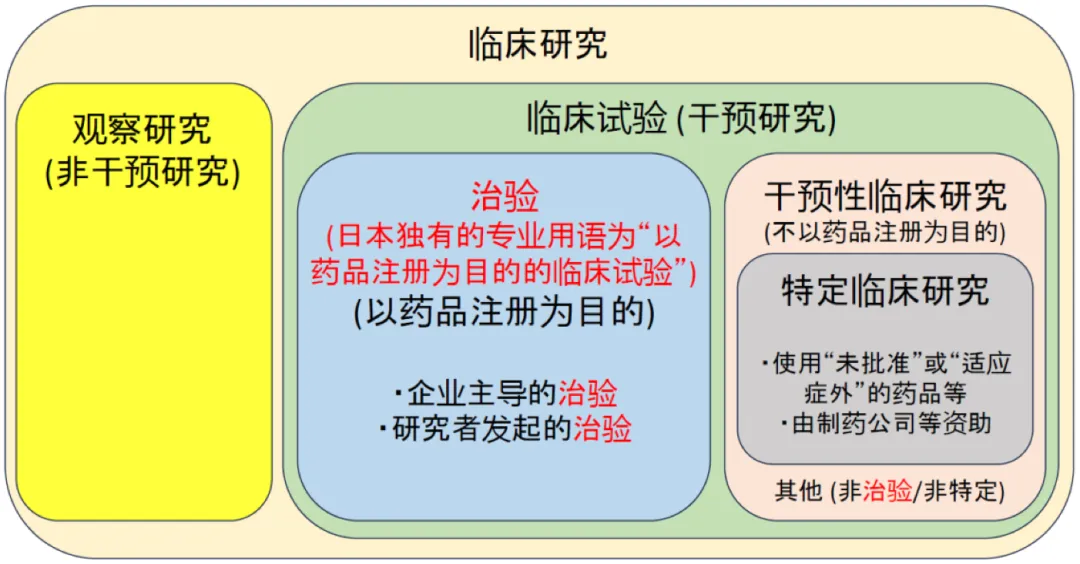
(摘自东京科学大学健康科学研究开发中心网站,有部分修改)
随后,2021年,jRCT成为了WHO的主要登记平台(Primary Registry)。自那时起,jRCT的临床试验搜索网站成为了一个门户网站,集成了这4个临床试验信息登记机构的数据,从而提供了统一的临床试验信息。(图2)
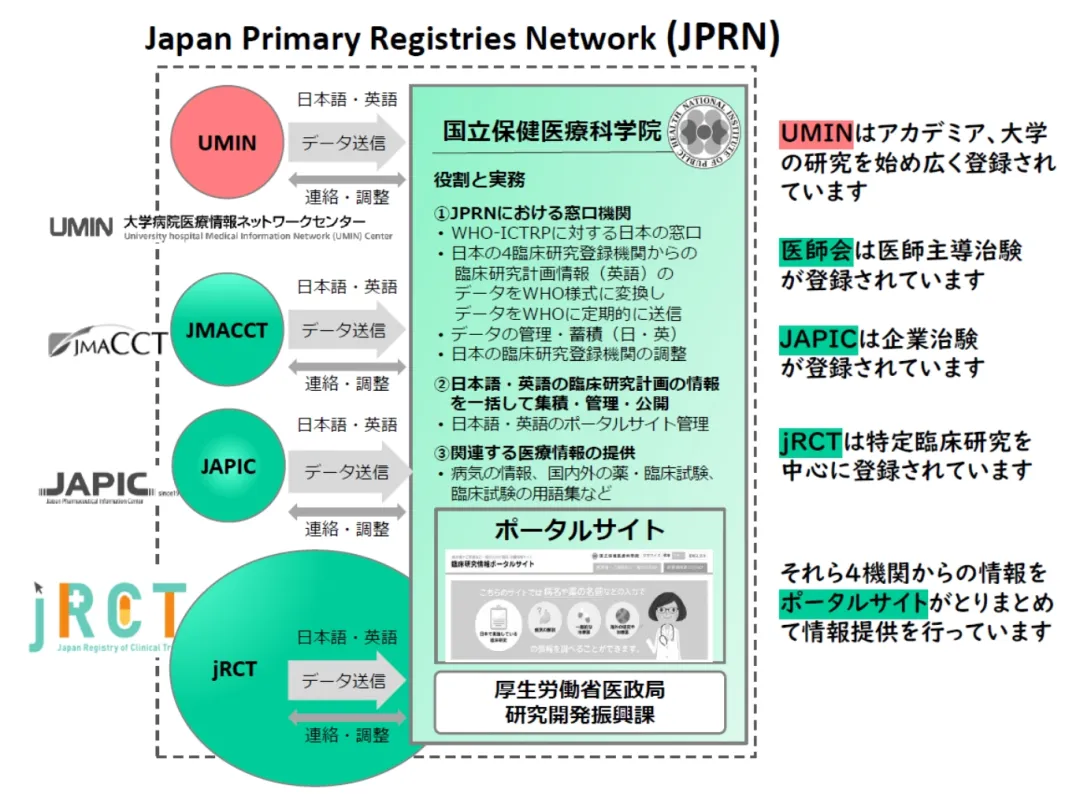
图2. 日本独有的4个临床试验信息登记机构(2018年以后)(汤川庆子,国立保健医疗科学院,由日本制药工业协会主办的临床试验实施情况等登记说明会,线上,2022年4月20日)
与这些变化相对应,日本自2018年3月26日MHLW发布的医药品审查管理课长通知《关于临床试验实施情况的登记》(药生药审发0326第3号)起,首次规定了患者为对象的临床试验信息必须在JapicCTI平台登记。此后,2020年8月31日MHLW发布的医药品审查管理课长通知《关于临床试验实施情况等的登记》(药生药审发0831第9号)
(https://www.mhlw.go.jp/content/11120000/000665717.pdf)进一步扩展了登记范围,要求自2020年9月1日起提交的新的临床试验申报上临床试验,包括健康志愿者的试验,必须在【临床研究等提交和公开系统 (jRCT, Japan Registry of Clinical Trials)】(https://jrct.mhlw.go.jp/)上登记,并且公开包含“WHO国际临床试验登记平台(International Clinical Trials Registry Platform, ICTRP)要求登记和公开的24项信息”,其中还包括实施医疗机构的名称。这些信息必须以日语和英语的形式进行公开,成为强制性要求。
(https://www.jpma.or.jp/information/evaluation/results/allotment/CL_202402_TP2.html)
(https://www.jpma.or.jp/information/evaluation/results/allotment/rs40ob00000014sn-att/CL_202402_TP2.pdf)
(来源:日本制药工业协会网站,药品评价委员会的成果等)
尽管网站还不是那么好用,但2020年9月1日以后提交的所有临床试验申报上包括在日本已完成或正在进行的临床试验,都可以在临床研究等提交和公开系统 (jRCT) (https://jrct.mhlw.go.jp/)上进行搜索,并能用日语和英语进行登记信息的查阅。
如前所述,由于jRCT汇集了4个临床试验信息登记机构的数据,因此不仅企业主导的临床试验,研究者发起的临床试验、特定临床研究以及非特定临床研究等也都会在该系统中登记。
此外,临床试验申报数量变化趋势显示,2022年(令和4年)以来日本临床试验数量的减少(参见第1期的图5)也从jRCT登记的临床试验数量自2022年(令和4年)的减少中得到了印证。(图3)
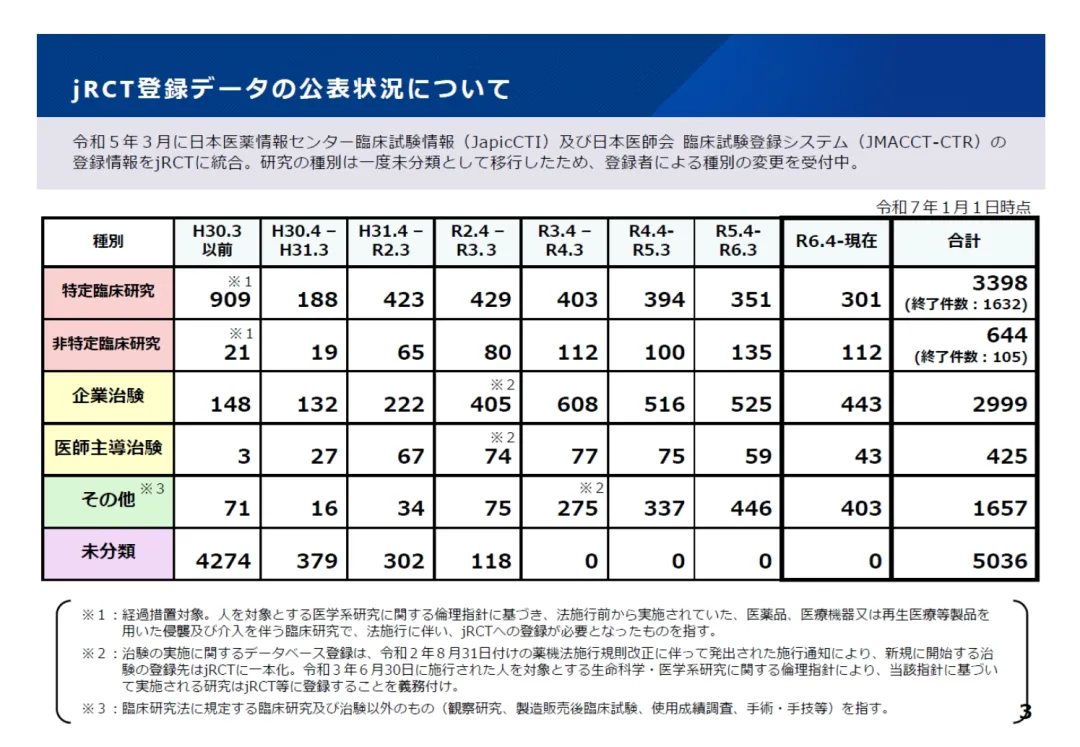
图3. jRCT登记数据的公示情况(截止到2025年1月1日)
(来源:MHLW, 第39届厚生科学审议会临床研究部会 参考资料2, 东京, 2025年1月29日)
04
关于临床试验登记和结果公开的IFPMA共同指南
至此,我们已围绕中国和日本的监管机构实施临床试验信息的登记义务进行了论述。然而,实际上,中日两国及欧美的制药企业(以MNC为主),早在临床试验信息登记强制化之前,便已经依照国际药品制造商协会联合会(IFPMA, International Federation of Pharmaceutical Manufacturers & Associations)(包括PhRMA、EFPIA、JPMA、RDPAC和2016年11月以后PhIRDA等组织为成员)和各自企业政策的要求,自2000年代初期开始便公开了临床试验信息。
例如,IFPMA在2008年11月发布了《通过临床试验登记簿及数据库披露临床试验信息的共同指南》(Joint Position on the Disclosure of Clinical Trial Information via Clinical Trial Registries and Databases),并于2018年1月15日发布了该指南的目前有效的修订版(https://www.jpma.or.jp/basis/rinsyo/lofurc0000001wp2-att/180115_shishin_e.pdf)。
此外,IFPMA还在2009年11月发布了标题为《新的联合行业临床试验透明度立场要求企业披露所有针对患者的临床试验》(New Joint Industry Clinical Trials Transparency Position Requires Companies to Disclose All Clinical Trials in Patients)的新闻稿,强调了成员制药企业在透明度方面的承诺(https://www.jpma.or.jp/basis/rinsyo/lofurc0000001wp2-att/091110_shishin_release_e.pdf)。
2018年1月15日,IFPMA还发布了《临床试验数据共享的IFPMA政策》(IFPMA Principles for Responsible Clinical Trial Data Sharing)(https://www.jpma.or.jp/basis/rinsyo/lofurc0000001vkc-att/policy18.pdf),向患者和研究者承诺以下五项原则:
1)增强与研究者共享包含个体数据的试验数据;
2)加强临床研究信息的公共访问(在药物或新适应症获批后);
3)与参与临床试验的受试者共享临床试验结果;
4)明确临床试验数据公开流程;
5)重申对公开临床试验结果的承诺。
此外,即使是未加入IFPMA的美国、欧洲、日本、中国等的创业型制药企业,即使没有受到监管机构的强制要求或所属行业协会指南的约束,为了展示临床试验和企业活动的透明度,同时也为了向医疗从业者和患者等提供适当的临床试验信息,并提高企业价值,这些企业目前也在积极公开临床试验信息。
05
ClinicalTrials.gov,还是jRCT?
如前所述,从2020年9月1日起,在日本已完成或正在进行的所有临床试验信息都可以在临床研究等提交和公开系统(jRCT, Japan Registry of Clinical Trials)(https://jrct.mhlw.go.jp/)上用日语和英语查阅。
那么,在jRCT强制登记以来,日本如何对待ClinicalTrials.gov呢?
根据IFPMA在2018年1月15日发布的目前有效的修订版《通过临床试验登记簿及数据库披露临床试验信息的共同指南 (Joint Position on the Disclosure of Clinical Trial Information via Clinical Trial Registries and Databases)》(https://www.jpma.or.jp/basis/rinsyo/lofurc0000001wp2-att/180115_shishin_e.pdf),关于临床试验信息应该在哪个网站登记和公开,美国选择了ClinicalTrials.gov,欧洲选择了英国的ISRCTN,而日本则使用了旧版JapicCTI,各地情况各异。
然而,事实上,包括日资企业在内的许多全球制药企业,都在按照全球统一的标准和操作披露临床试验信息,使用ClinicalTrials.gov作为公开平台。
在这些全球制药企业中,在JapicCTI开始运营之前,无论是日本本土的临床试验,还是在日本国外进行的临床试验,或是包含日本在内的MRCT,都会在ClinicalTrials.gov上登记和公开。即使在2020年日本开始强制要求以日语和英语在jRCT上登记后,这些企业仍然会继续同时使用ClinicalTrials.gov。
笔者认为,另一方面,一些日本制药企业在JapicCTI运营开始后,完全没有使用ClinicalTrials.gov,而是仅通过JapicCTI进行登记和公开,对于日本本土的临床试验等,至今仍然基本不使用ClinicalTrials.gov,而是只使用强制要求的jRCT。
因此,原本使用ClinicalTrials.gov的制药企业,现在大多仍然应该在继续使用。如果想查找在日本已完成或正在进行的临床试验信息,建议“首先使用熟悉的ClinicalTrials.gov进行搜索,如果与ClinicalTrials.gov的信息不重复或者担心信息可能有遗漏时,再结合使用jRCT”。
综上,本期笔者聚焦于“日本的临床试验信息登记”这一话题。
接下来,第四篇以后将深入探讨“日本的药品错失与药品上市延迟的原因之一,J-GCP所导致的日本特有问题”,以及“为解决日本的药品错失与药品上市延迟问题的具体对策”。(参见第3期的图4)

 政策法规
政策法规
 国家医保局
国家医保局  2026-01-15
2026-01-15
 522
522

 政策法规
政策法规
 医麦创新药
医麦创新药  2025-12-26
2025-12-26
 813
813

 政策法规
政策法规
 中国药审
中国药审  2025-12-12
2025-12-12
 1253
1253