 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-05-10
2025-05-10
 960
960
近期,制药巨头先后披露了 25 年第一季度财报。面对专利悬崖重压、研发成本飙升与资本市场寒冬,罗氏、赛诺菲、阿斯利康等头部药企纷纷举起「手术刀」,对研发管线进行精准切割,涉及肿瘤、自免、感染性疾病等多个领域。
Insight 数据库在此对部分 MNC 放弃的管线进行梳理。扫描文末二维码即可下载各大 MNC 2025 年一季度报。
罗氏
2025 年第一季度,罗氏销售额同比增长 6%(按固定汇率计算,下同),达到 154 亿瑞士法郎。
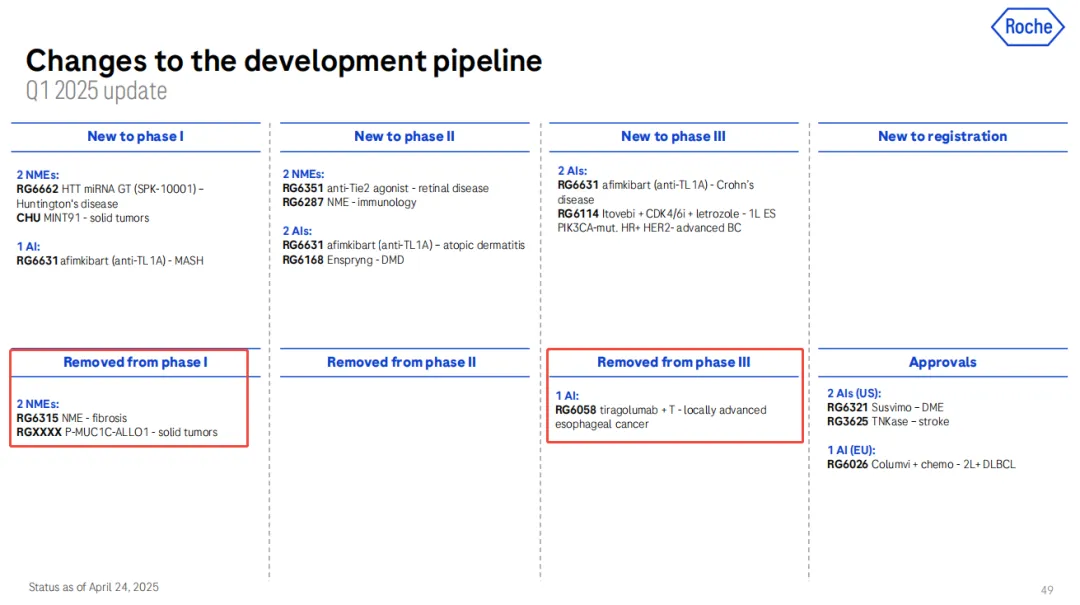
在管线进展方面,罗氏宣布 2 种潜在的新疗法将进入 III 期临床研究,分别是用于治疗阿尔茨海默病的双抗和用于治疗 A 型血友病的下一代药物。同时,罗氏也在财报中披露移除 3 个研究项目,涉及 Tiragolumab、RO7303509 和 P-MUC1C-ALLO1。
Tiragolumab 是具有完整 Fc 区域的 TIGIT 单抗,同时该药也是全球首款进入 III 期临床的 TIGIT 单抗。然而罗氏在这款药物上数次折戟,先是在 2022 年 5 月,罗氏宣布 Tiragolumab 联合阿替利珠单抗一线治疗 NSCLC 的联合疗法(SKYSCRAPER-01)未能达到 PFS 主要终点。2024 年 11 月 26 日,罗氏公布了该 III 期研究未达到总生存期这一主要终点。
除了一线疗法,在 NSCLC 的辅助疗法上,罗氏在 24 年第二季度报中披露终止 Tiragolumab 联合阿替利珠单抗辅助治疗 NSCLC 的 III 期研究。
随后,罗氏在 2024 年度报告中放弃了 Tiragolumab 的多项临床研究,包括 2 项 III 期临床、2 项 II 期临床、1 项 I 期联合治疗临床试验。而近期公布的一季度报中,罗氏又放弃了一项 Tiragolumab 联合阿替利珠单抗治疗局部晚期食管鳞状细胞癌的 III 期研究。
RO7303509 是一款 TGFB3 单抗,旨在与人体组织和体循环中的成熟人源 TGFβ3 结合。罗氏将其治疗纤维化的 I 期临床试验从研发管线中移除。
P-MUC1C-ALLO1 是一种同种异体 CAR-T 产品候选药物,用于治疗多种源自上皮细胞的实体瘤,例如乳腺癌、卵巢癌、结直肠癌、肺癌、胰腺癌和肾癌,以及其他表达癌症特异性粘蛋白 1(MUC1-C)的癌症,目前处于 I 期开发阶段。在近期公布的一季度报中,罗氏移除了其 I 期研发管线。
截图来源:企业财报
赛诺菲
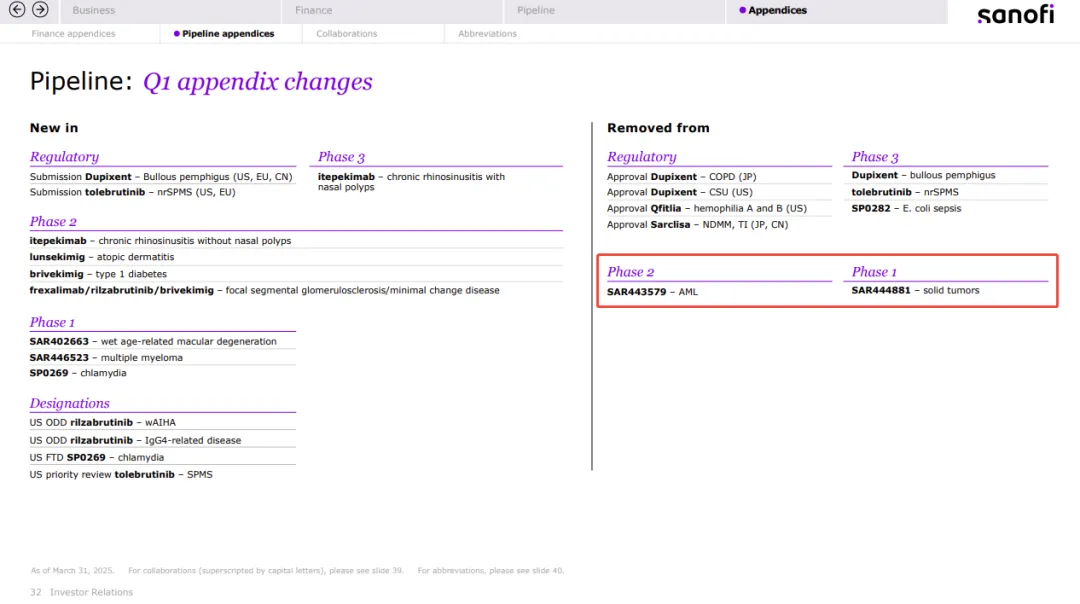
赛诺菲在一季度报中披露将移除 2 条早期管线。
一项是 Bexatamig 用于急性髓系白血病(AML)的 II 期临床研究。Bexatamig(SAR443579)是 Innate 与赛诺菲合作开发的一款新型三特异性 NK 细胞接合器,通过 Innate 专有的多特异性抗体平台 ANKET 构建,靶向肿瘤细胞上的 CD123 抗原,同时接合 NK 细胞上的 NKp46 和 CD16a。
赛诺菲曾主导 Bexatamig 的 I/II 期临床试验(NCT05086315)。剂量递增部分的疗效和安全性结果已在 2024 年 EHA 大会上以口头报告的形式公布。
数据显示,该药在复发或难治性 AML 患者中表现出临床获益、持久缓解以及良好的安全性。在 1 mg/kg 剂量下,5 例患者获得完全缓解(4 例完全缓解 / 1 例完全缓解),3 例患者获得持久完全缓解(>10 个月)。
2025 年 4 月 23 日,根据公司的战略重点,赛诺菲终止此前和 Innate 就该药达成的合作协议,Innate 获得 Bexatamig 的全部权利。
另一项是 BND-22(SAR444881)用于实体瘤的 I 期临床研究。BND-22 是 Biond Biologics 自研的 ILT2 单抗。2021 年,赛诺菲以 1.25 亿美元的现金预付款、超过 10 亿美元的开发、注册和销售里程碑付款,以及两位数的分级特许权使用费与 Biond Biologics 就该药达成全球独家许可协议。
作为协议的一部分,21 年 4 月,Biond 与赛诺菲合作启动一项首次人体 I 期研究(NCT04717375),旨在评估 BND-22 作为单一疗法以及与西妥昔单抗和帕博利珠单抗联合使用的安全性和耐受性。
然而在 25 年 3 月,基于对公司战略的调整,赛诺菲归还了 BND-22 的权利,将其完全转让给 Biond。
截图来源:企业财报
阿斯利康
4 月 29 日,阿斯利康发布一季度财报,营收 135.88 亿美元,同比增长 10%,其中产品收入 128.75 亿美元(+9%)。
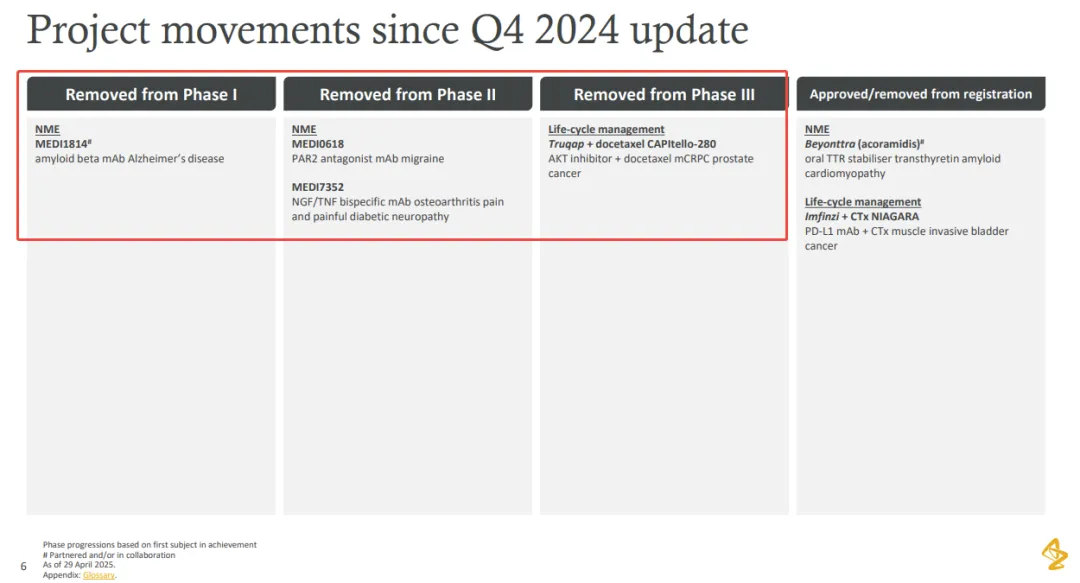
在管线进展方面,阿斯利康宣布终止 III 期 CAPItello-280 研究。这是一项 III 期、双盲、随机、安慰剂对照研究,旨在评估卡匹色替(Capivasertib)联合多西他赛对比安慰剂联合多西他赛治疗转移性去势抵抗性前列腺癌 (mCRPC) 患者的有效性和安全性。
此项决定是基于独立数据监测委员会(IDMC)的建议,委员会在审查该研究的中期分析数据后,认为该联合疗法在试验完成后,与对照组相比,不太可能达到放射学无进展生存期(rPFS)和总生存期(OS)这两个主要终点。
卡匹色替是一种强效、选择性泛 AKT 抑制剂,于 2023 年 11 月首次在美国获批上市,用于治疗 HR 阳性、HER2 阴性乳腺癌。2025 年 4 月 18 日,该药首次在华获批上市。
除此之外,阿斯利康还剔除了 3 个神经科学项目,分别是用于发作性偏头痛的 PAR2 单抗 MEDI0618(临床 II 期)、用于膝骨关节炎和糖尿病周围神经痛的 NGF/TNF-α 单抗 MEDI7352(临床 II 期)以及和礼来合作用于治疗阿尔兹海默病的 Aβ 单抗 MEDI1814(临床 I 期)。
同时,阿斯利康在第一季度财报电话会议中对外宣布,将全面退出神经科学领域,将资源转向肿瘤、代谢疾病等核心赛道。
截图来源:企业财报
GSK
2025 年第一季度,GSK 在财报中更新了管线变化,涉及 3 个项目的剔除。除了已获批的五价脑膜炎球菌 ABCYW 疫苗以外,还移除了 2 个早期研究项目。
一个是 IL18 单抗 GSK1070806 用于特应性皮炎(AD)的 II 期研究。GSK 最早于 21 年 7 月启动 GSK1070806 治疗 AD 的 I 期临床,并于 23 年 3 月完成该试验。
在 2025 年 AAD 大会上,该试验的结果被公布,数据显示单剂量 GSK1070806 最早在第 4 周即可使中度至重度 AD 患者受益,并在第 12 周观察到更高的、具有临床意义的反应率。根据该试验的积极结果,GSK 启动 II 期临床试验,旨在进一步探究该药的疗效和安全性。
然而在 25 年 4 月底,GSK 主动终止了两项 GSK1070806 用于特应性皮炎的 II 期研究(CTR20242051/CTR20240627)。原因为 GSK 数据审查委员会章程以及计划进行的第二次期中分析(IA2)结果显示,试验已达到无效性分析中预设的疗效标准。
另一个是 VH3739937 的 II 期临床研究。VH3739937 是一款 HIV 成熟抑制剂,根据 GSK 官网显示,该管线由于业务的原因已被移除。

截图来源:企业财报
诺和诺德
诺和诺德在 2025 年一季度财报中披露,由于投资组合的考虑,已在 4 月终止开发每周 1 次的司美格鲁肽口服片剂。
司美格鲁肽是诺和诺德开发的一款 GLP-1R 激动剂,今年第一季度创造了 78.64 亿美元销售额,占到诺和诺德总营收的约 71%,在中国一共获得了约 3.18 亿美元的收入。
另外,诺和诺德在财报中指出,此前用于肥胖的口服司美格鲁肽 25 mg 版本已经向 FDA 提交了上市申请,成为全球首款递交上市申请的口服减重版 GLP-1 药物。不过与本次终止开发的司美格鲁肽口服片剂不同,报上市的 25 mg 版本为每日一次的口服剂型。
相关的临床试验结果在 2024 年 Obesity Week 上被公布。数据显示,司美格鲁肽组组平均体重降低了 13.6%(vs 安慰剂组降低 2.2%)。与安慰剂组相比,司美格鲁肽组有更多受试者达到减重≥5%(79.2% vs 31.1%)、≥10%(63.0% vs 14.4%)、≥15%(50.0% vs 5.6%)和 ≥20%(29.7% vs 3.3%)。

截图来源:企业财报

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 637
637

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 646
646

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 616
616