 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-05-20
2025-05-20
 770
770
5 月 19 日,CDE 官网显示,信诺维医药的 XNW5004 片拟纳入突破性治疗品种,拟用于治疗既往接受过至少 3 线全身系统治疗的复发或难治性滤泡性淋巴瘤(EZH2 野生型)。
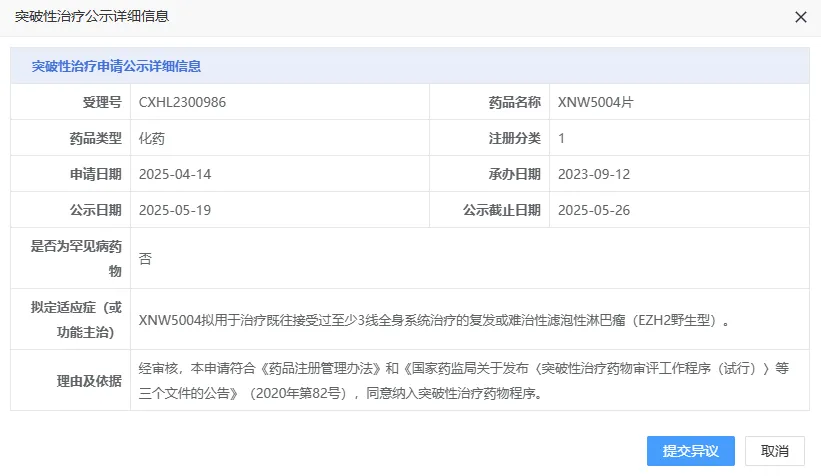
截图来源:CDE 官网
XNW5004 是信诺维自主研发的一种特异的,靶向 EZH2 的底物竞争性的小分子药物。已有临床试验证实该类药物在淋巴瘤领域有良好的抗肿瘤疗效,可为淋巴瘤患者提供一种新的治疗方式。在临床前体外、体内多个实体瘤模型上,也展示出良好的抗肿瘤活性,且安全性较好。
在 2022 年 ASH 大会上,信诺维首次公布该药的 I 期临床试验结果。这是一项开放标签、多中心、单臂、I 期研究,评估 XNW5004 在复发或难治性非霍奇金淋巴瘤(NHL)患者中的安全性、药代动力学、药效学和疗效。
截至 2022 年 7 月 15 日,共入组 15 例患者,患者既往治疗线数中位数为 3(范围:2-7),诊断包括弥漫大B细胞淋巴瘤(DLBCL,n = 3)、滤泡性淋巴瘤(FL,n = 6)、套细胞淋巴瘤(MCL,n = 1)、边缘区淋巴瘤(MZL,n = 2)、小淋巴细胞淋巴瘤(SLL,n = 1)、血管免疫母细胞性 T 细胞淋巴瘤(AITL,n = 1)和瓦尔登斯特伦巨球蛋白血症(WM,n = 1)。
结果显示,中位随访周期为 4 个周期(范围:2-10 个周期),在 9 名可评估患者中,客观缓解率 (ORR) 为 33.3%,疾病控制率 (DCR) 为 78%。中位无进展生存期 (mPFS) 和中位缓解持续时间 (mDOR) 均未达到。
EZH2 野生型(WT)FL 患者(n=5)中 ORR 为 40%,DCR 为 100%,中位 PFS 和中位 DOR 均未达到。所有疾病稳定(SD)患者病灶持续缩小。
1 例DLBCL(非 GCB)患者接受 2 个周期 XNW5004 治疗,病灶缩小 59.8%;治疗 4 个周期后,病灶缩小超过 70%。
1 例 FL(EZH2 WT)患者接受 2 个周期 XNW5004 治疗,皮下病灶及腋窝淋巴结均明显缩小,PET-CT 显示摄取强烈减少,Deauville 评分(DS)分别为 5 分和 3 分,疗效评价为部分缓解(PR)。治疗 4 个周期后 PET-CT 显示皮下病灶及腋窝淋巴结代谢持续降低,DS 分别为 2 和 1,疗效评价为完全缓解(CR)。
XNW5004 安全性和耐受性良好,在每日两次(BID)至 1600 mg 剂量范围内未观察到剂量限制性毒性(DLT)。
4 例患者发生 3 级治疗相关不良事件(TRAE),包括白细胞减少、中性粒细胞计数减少、淋巴细胞计数减少和血小板计数减少。未发生 ≥4 级不良事件(AE)及严重 TRAE。 ≥20% 患者发生的任何级别 TRAE 包括恶心、腹泻、丙氨酸氨基转移酶升高、中性粒细胞计数降低、白细胞减少、高甘油三酯血症、天冬氨酸氨基转移酶升高、呕吐、血乳酸脱氢酶升高、血胆红素升高、瘙痒、贫血。

截图来源:Insight 数据库
从开展的临床试验情况来看,除了血液瘤以外,XNW5004 已申报 3 个联合用药 IND 申请,正式进入实体瘤研发阶段,将在多个实体瘤适应症上,分别与PARPi、PD-1 抑制剂及 ARi 联合进行研究。
2023 年 6 月,信诺维宣布与默沙东就该药与默沙东的 PD-1 抑制剂帕博利珠单抗开展联合用药临床试验合作,围绕治疗晚期实体瘤的一项 Ib/II 期临床试验展开。
根据达成的协议,信诺维负责整体临床试验并提供临床费用,默沙东将提供帕博利珠单抗,信诺维仍保留 XNW5004 的全球知识产权。
Insight
数据库显示,在国产 EZH2 靶向药物赛道上,共有 3 条管线进入临床阶段,恒瑞 SHR2554 进展最快,已处于上市申请阶段,首发适应症为外周 T
细胞淋巴瘤,曾被 CDE 纳入突破性治疗;信诺维 XNW5004 第二,目前处于临床 III 期阶段;中科拓苒 TR115 尚处于临床 I 期。
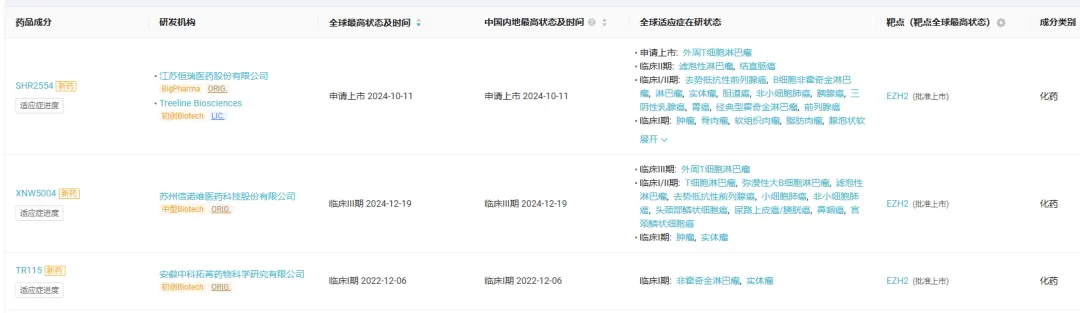
截图来源:Insight 数据库

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 19
19

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 20
20

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 19
19