 产业资讯
产业资讯
 同写意
同写意  2025-05-23
2025-05-23
 934
934
01
口服多肽热度持续走高,再造授权大单
2025年4月15日,Cyprumed与默沙东达成了一项引人注目的合作协议。根据协议内容,默沙东将获得Cyprumed创新口服多肽递送平台的全球非独占使用权,并拥有对特定靶点技术的独占授权选择权。Cyprumed有望从此次合作中获得高达4.93亿美元的里程碑付款,并在默沙东行使独占选择权后获得额外收入。该协议由默沙东全权承担后续产品的研发、生产与商业化工作,充分反映了全球制药巨头对口服多肽递送技术商业潜力的认可。
这项交易是Cyprumed继建立自主口服片剂平台之后的重要里程碑。Cyprumed专注于口服肽类药物递送,开发创新的口服多肽配方,可显著提高肽类药物的口服生物利用度。他们还将此技术平台拓展至高分子量、低水溶性的BCS IV类注射用药物的口服递送,建立了相应的递送平台,涵盖如PROTAC类药物的研发合作。
BCS IV指的是生物药剂分类系统(Biopharmaceutics Classification System, BCS)中的第IV类化合物,这类药物具有两个显著特点:即水溶性差(Low Solubility)和渗透性低(Low Permeability)。由于溶解性和渗透性都差,BCS IV类药物口服吸收效率极低,往往需要依赖注射剂型进行给药。在开发口服制剂时,通常面临在胃肠道中几乎不溶解,无法有效释放活性成分的问题。即便溶解,也难以通过肠道上皮进入血液循环。传统口服剂型技术手段通常难以实现满意的生物利用度。
Cyprumed的口服制剂技术平台与口服多肽药物未来的发展方向非常契合。尽管多肽药物在代谢性疾病、罕见病和肿瘤治疗等多个领域取得了重要进展,但其在剂型上长期受限于注射方式。这一方面降低了患者的用药依从性,另一方面也制约了部分潜在适应症的市场拓展。多肽类药物在胃肠道环境中易被蛋白酶降解,且分子量较大、极性较强,穿越肠上皮细胞的能力有限,因而被认为是“最难被口服化的分子类别之一”。正是在这一挑战之下,递送技术的创新,成为口服多肽药物开发能否实现突破的关键。
02
开发口服多肽药物的系统性挑战
尽管多肽类药物在临床上展现出高度靶向性与安全性优势,其口服递送却长期受限,核心难点并非源于药效学本身,而是多重生物药剂学屏障与递送路径的不适配性所致。口服多肽制剂的成功开发,必须在以下几个方面同时实现突破:
• 胃肠道酶降解与酸性环境的不稳定性
多肽分子在胃肠道中易受到胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶等多种消化酶(proteolytic enzymes)的水解作用,导致其在口服途径中肽链断裂、失活。此外,胃酸环境(pH ~1.5)对多数天然多肽的稳定性构成额外威胁,形成化学降解与酶学降解的叠加效应。因此,如何实现胃肠道稳定性增强是所有口服多肽技术平台面临的首要课题。
• 低膜通透性限制跨上皮转运效率
多肽通常为高分子量(>1000 Da)、亲水性强、带电荷的结构,大多不符合口服制剂的利平斯基五规则(Lipinski’s Rule of Five)。这些性质导致其无法有效通过肠上皮细胞的跨细胞(transcellular)转运路径,而细胞间通道(paracellular route)又受限于tight junctions的高选择性(通常只允许高极性的极小分子通过)。整体结果是多肽药物的口服生物利用度(oral bioavailability)极低,常不足1%(表1)。很多口服多肽制剂的开发,得益于多肽超高的体内活性,这在很大程度上弥补了极低的口服生物利用度的桎梏,例如desmopressin口服制剂(口服生物利用度0.1%左右)就是依靠这个优势开发出来并成功上市的。
• 转运蛋白介导的主动外排机制
即便有少量多肽分子进入上皮细胞内,也可能被P-gp(P-glycoprotein)、MRP2等外排转运体(efflux transporters)主动转运回肠腔而无法进入血液循环系统,进一步削弱其系统暴露水平。这一机制在多肽类、大环肽及某些PROTAC等新型分子中尤其显著。
• 口服药代动力学特性不可预测性高
由于递送效率低且变异来源多(如肠道pH、胃排空时间、酶表达差异),口服多肽通常表现为吸收窗口窄、生物利用度高度个体化、Cmax波动大,这给临床剂量设计和疗效预测带来极大不确定性,甚至成为IND申请和后续监管审评的关键风险点。
• 递送系统需兼顾药效增强与CMC可行性
即使找到可提升透膜性或稳定性的辅助技术,如渗透促进剂(permeation enhancers)、酶抑制剂(enzyme inhibitors)、载体系统(lipid-based carriers、polymeric nanoparticles),仍需评估其毒理学安全性、肠道耐受性、递送一致性及产业化生产工艺复杂度(CMC complexity)。很多技术在实验室或动物模型中有效,但无法满足人用长期用药与商业化制剂的标准。
表1. 部分上市口服多肽
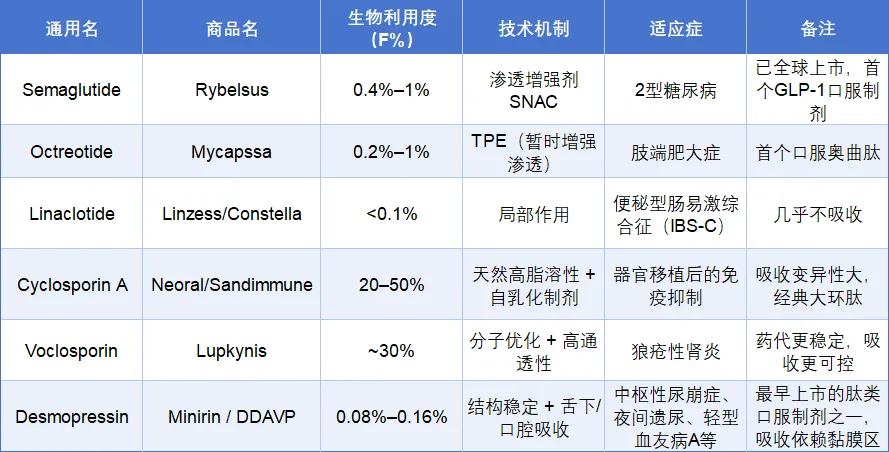
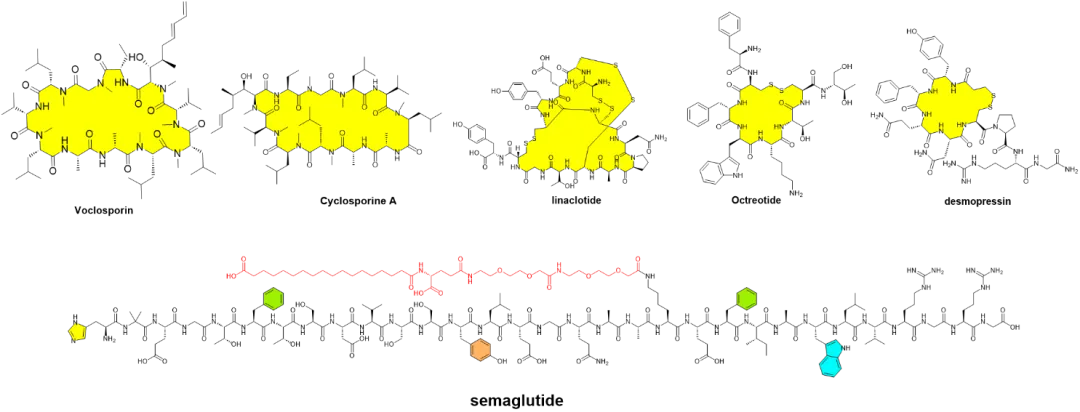
图1. 部分上市口服多肽化学家结构
03
为什么口服多肽成为当下的热点领域?
过去十年间,全球多肽药物市场持续扩容,临床需求与品类数量显著增长,但剂型受限于注射仍是限制其广泛适用与患者依从性的核心障碍。随着创新递送技术的不断成熟,将多肽药物“口服化”不仅成为技术攻坚目标,更演变为新药开发中的重要竞争高地,原因主要包括以下几点:
• 临床顺应性驱动
多肽类药物广泛应用于代谢性疾病(如糖尿病、肥胖)、炎症与自身免疫疾病(如类风湿性关节炎、炎症性肠病)等慢性病领域,这些适应症往往要求长期甚至终身用药。相比之下,传统的注射给药频繁、对患者日常生活干扰大,成为限制疗效达成与依从性提升的关键障碍。特别是在门诊为主、基层使用频繁的治疗场景中,口服剂型可显著降低护理负担,提高患者自我管理能力与治疗坚持率。
更重要的是,这类慢性疾病的患者群体与肿瘤治疗人群不同,并非处于“病急就医”状态,更关注用药便利性、剂型舒适度与生活质量。因此,与肿瘤药物相比,多肽类药物在代谢与免疫类疾病中“口服优先”导向更强烈,市场接受度也更高。口服剂型不仅有助于扩大目标人群覆盖,还可在生命周期管理中延长专利保护、优化支付路径。
• 市场体量与商业回报潜力巨大
据市场调研机构预测,全球多肽药物市场将在未来五年持续保持双位数增长,其中一大部分增长点将来自于口服剂型的适应症扩展与人群下沉(指从高风险、重度患者人群向早期、轻中度、基层或广谱人群扩展适应症与使用范围的过程)。
诺和诺德的Rybelsus即是典型案例,其在2024年全球销售额达到34亿美元,验证了“低生物利用度也可成就大品种”的市场逻辑。更重要的是,诺和诺德正在积极准备扩展Rybelsus的标签,他们已向FDA递交申请,寻求将Rybelsus的适应症从2型糖尿病扩展至“降低重大不良心血管事件(MACE)风险”,特别是针对合并动脉粥样硬化性心血管疾病(ASCVD)或慢性肾病(CKD)的患者。这是Rybelsus自2019年获批以来的第一个潜在适应症拓展。适应症拓展将进一步增强其“高端口服降糖药+心血管保护”的战略价值。除了拓展适应症之外,诺和诺德还希望将口服semaglutide用于其主战场肥胖症,FDA已于5月2日接受了诺德诺德的申请。
• 技术突破
随着SNAC、TPE(Transient Permeability Enhancer,瞬时渗透性增强剂)、微针、脂质体、纳米胶束等口服递送平台的不断成熟,开发者不再仅仅依赖“高结构稳定性+被动扩散”来筛选可口服化分子,而是可以通过平台化手段系统性解决多肽的吸收屏障。这也使得Cyprumed,Enteris,Rani Therapeutics等公司转型为“递送解决方案提供者”,在与大药企合作中获得战略地位。
• 监管接受度提高
随着多个口服多肽制剂获得FDA批准,监管机构已建立起基于生物等效性、生物利用度优化及递送机制验证的审评框架,使“注射转口服”的路径不再是新物种开发,而是可控的二代产品策略。这使得拥有既有多肽管线的企业更有动力进行剂型创新与生命周期管理。
目前已经有包括semaglutide, cyclosporine A, voclosporin, desmopressin, linaclotide和octreotide等众多多肽口服制剂获得了监管部门的批准上市(图1)。
04
口服多肽制剂开发技术前沿
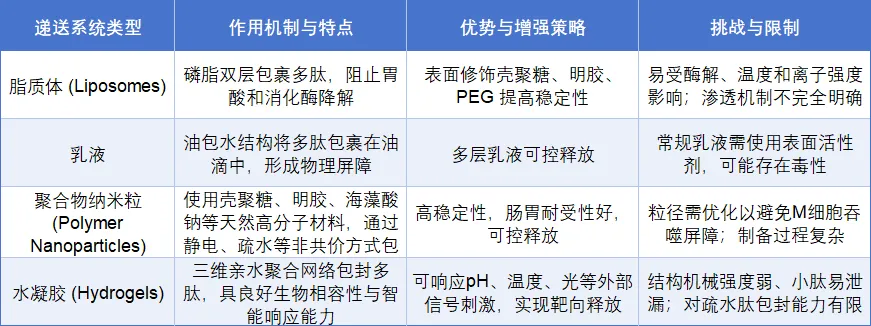
多肽类药物因其分子量大、亲水性强、易降解等特点,导致其口服生物利用度极低。为解决这一难题,研究者从穿透增强、分子改造与载体包封三大方向构建递送策略。
• 渗透增强技术(Permeation Enhancement)
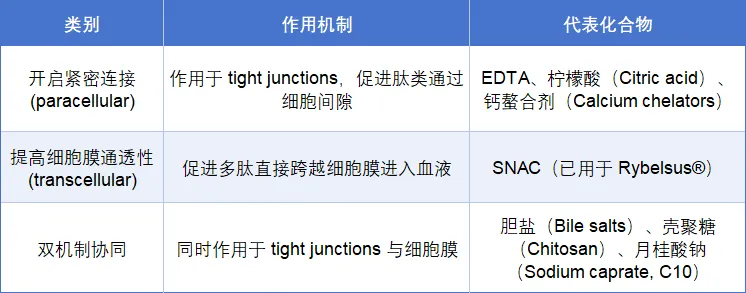
渗透增强剂(Permeation Enhancers,PEs)通过短暂性调控上皮屏障结构或细胞膜通透性,实现增强多肽肠道吸收的目的(表2)。
表2. 口服多肽制剂开发常见渗透增强机制
• 化学结构修饰(Chemical Modification)
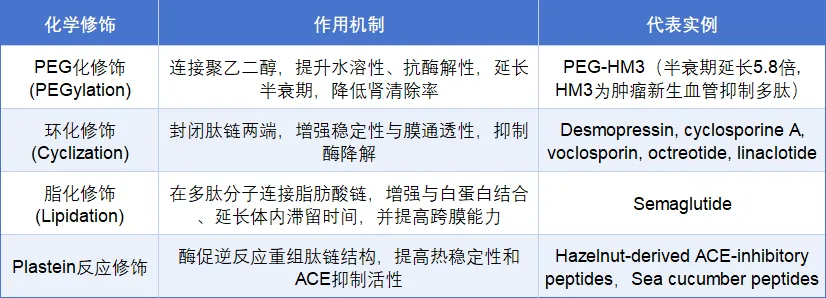
通过对多肽主链或侧链结构的化学修饰,可有效提升其酶稳定性、水溶性和体内半衰期(表3)。
表3. 口服多肽制剂开发常见化学改性策略
• 胶体递送系统(Colloidal Delivery Systems)
将多肽包封于微纳米结构中可提供胃肠道保护、缓释释放与靶向吸收能力,是目前应用最广泛的递送平台之一(表4)。
表4. 口服多肽制剂开发常见胶体递送机制
05
口服多肽制剂市场展望
根据市场研究数据,2025年全球口服多肽治疗药物市场规模约为87.8亿美元,预计到2032年将增至191亿美元,年均复合增长率达到13.83%。这一增长预期不仅反映了技术突破推动产品落地的潜力,也说明各大药企正加速将口服多肽递送平台纳入长期战略布局。
近年来,随着多肽药物在糖尿病、肥胖、骨代谢、炎症性疾病、罕见病等多个慢性病治疗领域的持续渗透,口服制剂因其在便利性、依从性和慢病长期管理中的优势,成为产业重点攻坚方向。
主要驱动因素包括技术进步(递送系统不断成熟,解决吸收、生物稳定性等核心难点、)患者需求导向(非注射剂型提高依从性,尤其适用于基层医疗、早期治疗与年轻患者群体)、监管推动和全球化推动(亚太地区,尤其是中国、印度在基础设施、医保普及和药品可及性方面的加速推进,成为重要增量市场)。
重要的口服多肽制剂开发商包括:艾伯维、阿斯利康、礼来、辉凌、益普生、强生、默沙东、诺华、诺和诺德、赛诺菲、武田、梯瓦等。口服多肽制剂的主要市场将在肿瘤学、代谢疾病和中枢神经系统疾病等领域。
06
口服多肽最新项目
在近期的会议上,BMS首次公开了其新一代PD-L1抑制剂BMS-986238的分子结构(图2),标志着这一项目迈入新阶段。作为一种采用大环肽结构设计的创新分子,BMS-986238不仅突破了传统抗体药物的模态限制,也预示着BMS有意在免疫检查点抑制剂这一竞争激烈的赛道上,通过差异化的技术路线重新布局,重塑其在这一领域的话语权。
尽管抗体类药物在PD-1/PD-L1靶点上长期占据主导地位,BMS多年来一直在探索更小、更灵活的药物模态,试图通过肽类分子实现机制相同但形式迥异的免疫阻断策略。早期候选物BMS-986189展示出对PD-L1的极高亲和力,并在健康志愿者中实现了低浓度条件下的靶点饱和,为大环肽结构在该靶点上的药效验证提供了临床依据。然而,其极短的体内半衰期和每日给药的需求,暴露出药代属性方面的严重不足,成为其进一步开发的主要障碍。
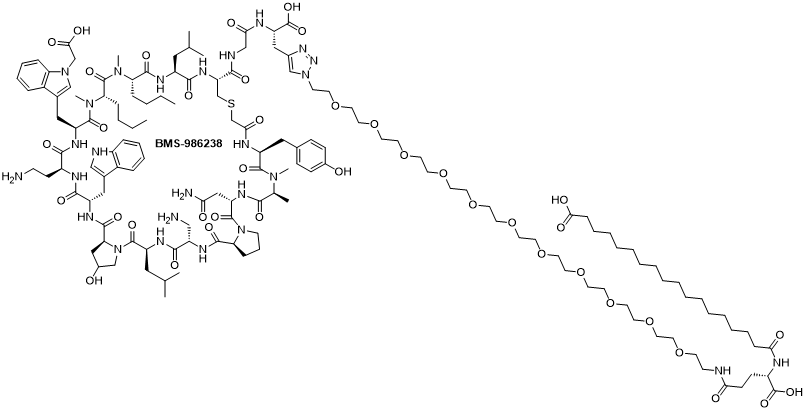
图2. PD-L1抑制剂BMS-986238分子结构
为解决这一问题,BMS随后对分子设计进行了系统优化,推出新一代分子BMS-986238。该分子在保留高亲和力基础上,通过引入一系列结构修饰策略显著改善了药代动力学性能,尤其是在延长体内暴露时间方面取得了关键进展。优化措施包括提高与白蛋白的结合能力、引入脂肪酸结构延长循环时间、设计PEG间隔以减少空间位阻,以及对结合动力学参数进行精细调控以确保靶点结合特异性和功能完整性。值得注意的是,BMS-986238的化学结构涵盖了环肽、N-甲基氨基酸、非蛋白质氨基酸和脂化支链等众多符合口服多肽发展方向的属性(图2)。
BMS-986238在非临床模型中已显示出优于前代分子的半衰期表现,在大鼠和猴中均超过19小时,同时具备潜在的口服剂型开发前景。值得关注的是,BMS在开发策略上更强调药效窗口与暴露特征之间的匹配,而非单纯追求生物利用度的绝对提高。在已有数据中,BMS-986189已被证实在低血药浓度下亦可实现PD-L1的有效占据,因此新一代分子若能维持类似亲和力,结合更长的体内暴露时间,即有可能通过较低Cmax实现持续疗效。这一逻辑为口服制剂的可行性提供了理论支持,也反映了BMS对于PK/PD协同机制的深度考量。
BMS-986238的出现,不仅延续了大环肽作为非抗体免疫检查点抑制剂的研发思路,也标志着该公司在突破传统模态限制方面迈出了实质性一步。在抗体已高度成熟化的PD-1/PD-L1赛道中,BMS正试图通过结构和策略的双重创新,建立新的竞争优势。
07
口服多肽制剂未来展望
随着肽类药物在靶向性、安全性和功能可设计性方面优势的不断显现,其应用领域正从传统的注射制剂逐步延伸至口服治疗场景。长期以来,由于肽类分子易被胃肠道酶降解、渗透性差、半衰期短等限制,口服制剂的开发面临显著挑战。然而,近年来在分子修饰、递送系统、吸收促进剂以及PK/PD建模等方面的技术进展,正在逐步突破这些瓶颈。
未来,口服肽类药物的发展趋势将不仅聚焦于提高生物利用度这一单一指标,更强调整体给药策略的合理性,包括药效窗口的设计、暴露曲线的优化以及与现有治疗方案的协同可能性。以BMS-986238为代表的新一代分子正在证明,通过结构合理化和动力学参数调控,即便在生物利用度有限的前提下,仍可实现有效、可控的口服治疗路径。
可以预见,随着新技术的不断融合和产业化能力的提升,肽类口服制剂将成为未来药物开发中一个高度活跃的方向,尤其在慢性病、肿瘤维持治疗和免疫调节等长期用药场景中展现出更广阔的临床价值。多肽递送平台和多肽分子结构设计方面必然会迎来爆发式的进步,而资本市场也会出现越来越多以口服多肽为核心的资产交易。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 11
11

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 13
13

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 12
12