 产业资讯
产业资讯
 药渡
药渡  2025-05-23
2025-05-23
 780
780
2025年5月20日,中国国家药监局药品审评中心(CDE)官网公示,科济药业全资子公司恺兴生命科技申报的舒瑞基奥仑赛注射液拟纳入优先审评,拟用于治疗CLDN18.2表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌。
此次优先审评将有助于缩短其上市时间,使患者能够更快地受益于这一创新疗法,为胃癌患者带来了新的希望,也标志着中国CAR-T细胞疗法在实体瘤治疗领域取得了重大进展。
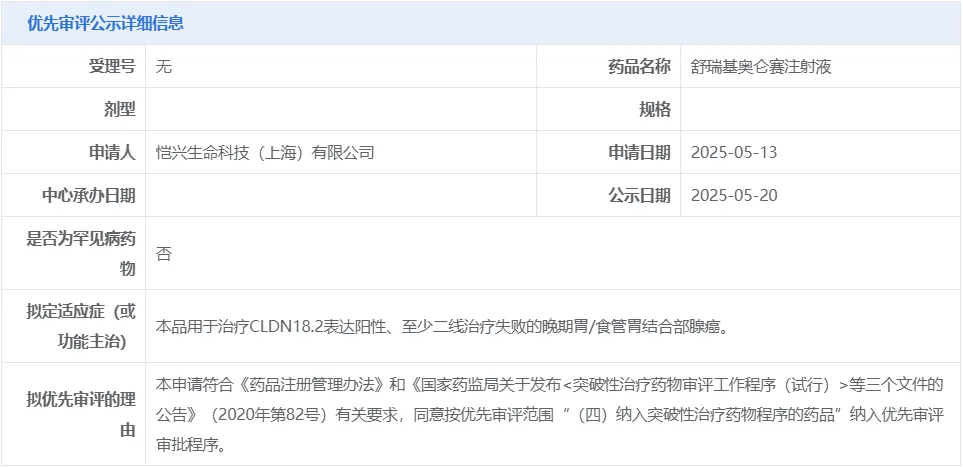
图1. 舒瑞基奥仑赛注射液优先审评公示信息,来源:CDE官网
01
胃癌治疗新选择
胃癌是一种常见的消化系统恶性肿瘤,具有较高的发病率和死亡率。食管胃结合部腺癌作为一种特殊类型的胃癌,同样具有较高的恶性程度和复杂的治疗需求。Claudin18.2(CLDN18.2)是一种在多种肿瘤细胞表面高度表达的蛋白,尤其在胃癌、胰腺癌等实体瘤中呈现高表达。因此,针对CLDN18.2的治疗成为近年来的研究热点。
舒瑞基奥仑赛注射液拟用于治疗的适应症为CLDN18.2表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌。这一适应症涵盖了经过至少两种前线治疗方案失败后的晚期患者群体,为这些患者提供了新的治疗选择。
舒瑞基奥仑赛注射液此次拟纳入优先审评,是基于其在多项临床试验中展现出的显著疗效和良好安全性。此前,该药物已获得CDE纳入突破性治疗品种,并被美国FDA授予再生医学先进疗法(RMAT)认定和孤儿药资格。这些资格认定不仅体现了舒瑞基奥仑赛在治疗胃癌领域的潜力,也为其加速审批提供了支持。
02
药物作用机制
舒瑞基奥仑赛注射液是一种靶向CLDN18.2的自体CAR-T细胞疗法。其作用机制如下:
靶向识别:舒瑞基奥仑赛通过其表面的嵌合抗原受体(CAR)特异性识别肿瘤细胞表面的CLDN18.2蛋白。
T细胞激活:当CAR-T细胞与肿瘤细胞表面的CLDN18.2结合后,T细胞被激活,启动免疫反应。
肿瘤细胞杀伤:激活的T细胞通过释放细胞毒性因子和直接杀伤机制,特异性地清除表达CLDN18.2的肿瘤细胞。
持久免疫效应:CAR-T细胞在体内具有一定的持久性,能够持续监测和清除复发或残留的肿瘤细胞。
03
临床试验数据详情
在2024年ASCO大会上,科济公布了舒瑞基奥仑赛治疗胃癌的Ⅰ期研究(NCT03874897)结果。此次临床试验旨在评估舒瑞基奥仑赛在CLDN18.2阳性晚期胃肠道癌症患者中的安全性和有效性,共有98例患者接受舒瑞基奥仑赛输注治疗。在所有患者(N=98)中,客观缓解率(ORR)为37.8%,疾病控制率(DCR)为75.5%,中位无进展生存期(PFS)为4.4个月,中位总生存期(OS)为8.4个月。在接受舒瑞基奥仑赛单药治疗的疗效可评估的胃癌患者中,47例可测量病灶患者的ORR为57.4%,DCR为83.0%;所有55例疗效可评估胃癌患者中,中位PFS为5.8个月,中位OS为9.7个月。
关于安全性数据,最常见的3级或更高级别治疗中出现的不良事件是与淋巴细胞清除相关的血液学毒性。未报告剂量限制性毒性、治疗相关死亡或免疫效应细胞相关神经毒性综合征(ICANS)。96.9%的患者出现细胞因子释放综合征(CRS),均为1-2级。
2024年12月,科济药业宣布舒瑞基奥仑赛在中国胃癌关键II期临床试验(NCT04581473)中取得初步阳性结果。这是一项在中国进行的随机对照、多中心的临床试验,旨在评估舒瑞基奥仑赛治疗CLDN18.2表达阳性、既往接受过至少2线治疗失败的晚期胃/食管胃结合部腺癌的有效性和安全性。受试者以2:1的比例随机分配至舒瑞基奥仑赛注射液组或研究者选择治疗组。
该试验的主要终点为由独立评审委员会(IRC)评价的无进展生存期(PFS)。结果显示,舒瑞基奥仑赛组的PFS显著优于研究者选择治疗组。试验中未发生剂量限制性毒性(DLT),且长期随访显示安全性持久可控。
舒瑞基奥仑赛还在全球范围内开展了多项临床试验,包括在中国开展的研究者发起的临床试验(CT041-CG4006),在中国开展的针对胰腺癌辅助治疗的1期临床试验(CT041-ST-05),以及在北美开展的针对晚期胃癌或胰腺癌的1b/2期临床试验(CT041-ST-02)。这些试验进一步验证了舒瑞基奥仑赛在不同患者群体中的疗效和安全性。
04
市场分析及展望
胃癌是全球范围内常见的恶性肿瘤之一,尤其是在中国、日本和韩国等东亚国家发病率较高。每年新发胃癌病例中,约有30%~40%的患者在诊断时已处于晚期阶段,这些患者对有效的治疗方案有迫切需求。舒瑞基奥仑赛作为一款针对CLDN18.2的CAR-T细胞疗法,有望填补这一领域的治疗空白。
目前,全球尚无CAR-T产品获批用于实体瘤治疗。舒瑞基奥仑赛在该领域处于第一梯队,有望成为全球首款获批上市的实体瘤CAR-T产品,市场潜力巨大。
舒瑞基奥仑赛的优先审评将加速其在中国的上市进程,为患者提供更早的治疗机会。相信科济药业在获批后将会迅速推进其商业化进程,未来或将进一步拓展其在胃癌、胰腺癌等实体瘤领域的临床开发。同时,公司也或将会积极探索舒瑞基奥仑赛在其他CLDN18.2阳性实体瘤中的应用,以扩大其市场覆盖范围。
舒瑞基奥仑赛拟纳入优先审评,不仅为胃癌患者带来了新的希望,也展示了中国创新药企在CAR-T细胞疗法领域的研发实力。这一进展将激励更多国内药企加大在细胞治疗领域的研发投入,推动中国生物医药产业的创新发展。同时,舒瑞基奥仑赛的成功也将为科济药业的国际化战略奠定基础,提升其在全球市场的竞争力。
结 语
舒瑞基奥仑赛注射液拟纳入优先审评,标志着中国CAR-T细胞疗法在实体瘤治疗领域取得了重大突破。其独特的靶向CLDN18.2作用机制和在临床试验中展现出的显著疗效和良好安全性,使其成为胃癌治疗的新希望。
随着优先审评的推进,舒瑞基奥仑赛有望尽快获批上市,为中国及全球的胃癌患者提供创新的治疗选择。
这一成就不仅体现了科济药业在细胞治疗领域的创新能力,也为整个中国生物医药产业的发展注入了新的活力。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 11
11

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 13
13

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 12
12