 产业资讯
产业资讯
 医药经济报
医药经济报  2025-05-27
2025-05-27
 664
664
中枢神经系统(CNS)疾病药物研发此前常被称为生物医药领域的“死亡谷”,创新药企的攀登之途一直未停。近年来,这一布满荆棘的领域逐渐绽放生机。
艾昆玮《2025年研发报告》显示,近五年,这一领域取得了显著发展,全球范围内有近3400项试验,包括用于治疗神经退行性疾病、神经肌肉疾病和精神疾病的产品。值得注意的是,2015-2019年,国内企业开展的神经治疗领域新药Ⅰ~Ⅲ期临床试验数量平均占全球总份额6%,2020-2024年,其提升至占全球总份额13%。
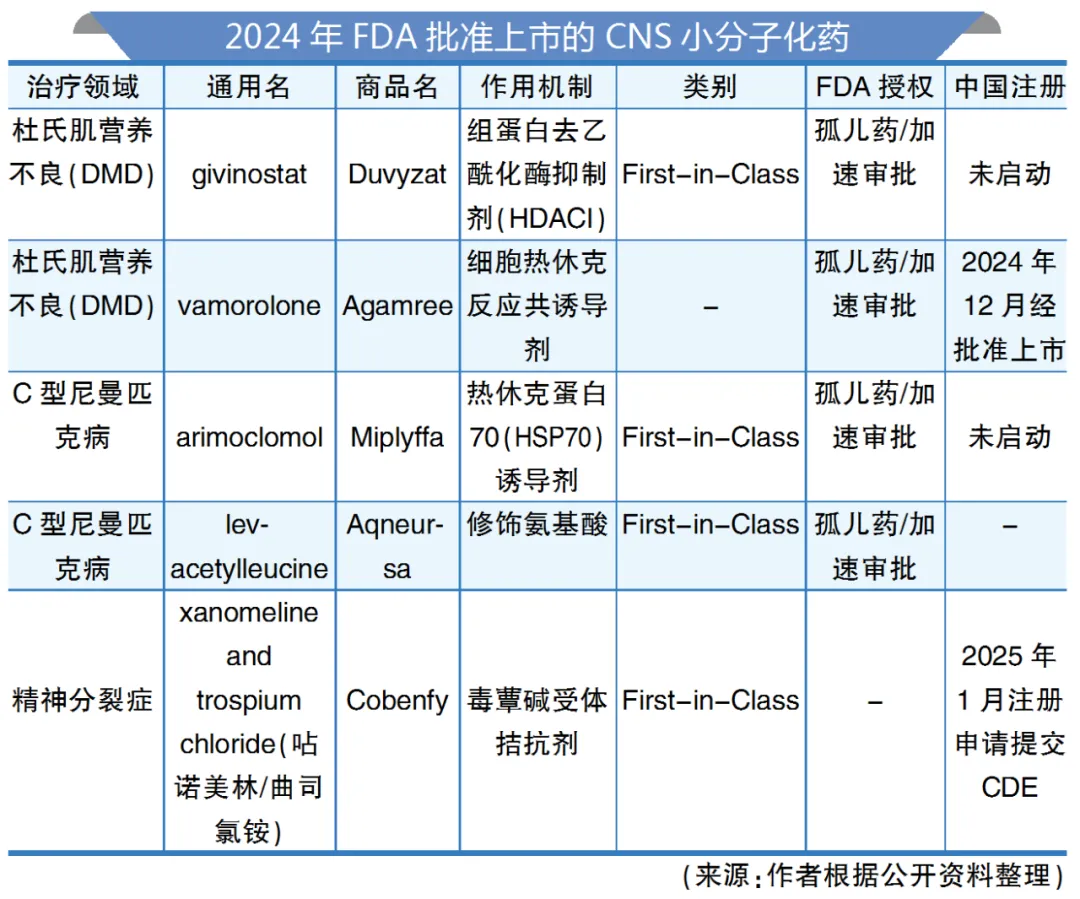
在这一波研发浪潮中,小分子药物表现出独特的活性调控能力、靶点穿透优势和适应症广泛性,成为多个机制性创新的代表。笔者聚焦三款2024年问世的CNS小分子化药,涉及罕见神经肌肉病、神经罕见病及精神疾病,分析此类药物在不同维度上的研发突破。
Duvyzat 开拓全新治疗策略
在杜氏肌营养不良症(DMD)患者的肌肉组织中,组蛋白去乙酰化酶(HDAC)活性异常升高,可能促使肌肉再生受损,阻碍肌肉超细纤维适应收缩。Italfarmaco SPA公司Duvyzat旨在通过抑制DMD患者中异常升高的HDAC活性,缓解对肌肉组织的损害,保护肌肉超细纤维的功能,从而为此类患者提供一种全新的治疗策略。根据FDA新闻稿,Duvyzat是首个获批可用于治疗携带任何DMD基因变异患者的非类固醇疗法。
此前,FDA授予Duvyzat治疗DMD的罕见儿科疾病资格、孤儿药资格、快速通道资格及优先审评,最终于2024年3月批准上市,口服治疗6岁及以上杜氏肌营养不良(DMD)患者。
在一项为期18个月的随机、双盲、安慰剂对照研究中评估了Duvyzat治疗DMD的有效性,共有179名患者按2:1随机接受Duvyzat(n=118)或安慰剂(n=61)。
研究结果显示,该试验达成主要终点。DMD患儿在接受18个月的Duvyzat治疗后,计时运动功能有所改善(根据执行爬4级楼梯的时间相较于基线时的平均变化评定)。接受该药治疗的患者从基线到第18个月爬4级楼梯的平均时间变化为1.25秒,而安慰剂组患者则为3.03秒。此外,试验还达成了各项次要终点。
Miplyffa 首款热休克反应诱导剂
Acer Therapeutics公司的Miplyffa是一种羟胺衍生物,为热休克蛋白-70(HSP70)共同诱导剂,于2024年9月20日获得FDA批准适用于与酶抑制剂miglustat联合使用,用于治疗2岁及以上成人和儿童患者的C型尼曼-匹克病(NPC)的神经系统症状的药物。其也是FDA批准的首款NPC药物,曾获FDA授予孤儿药资格、快速通道资格、突破性疗法认定以及罕见儿科疾病资格。
虽然Miplyffa治疗NPC的具体作用机制尚不完全清楚,但据推测,它旨在提高NPC患者所缺乏的蛋白质的功能水平,减缓疾病进展,缓解NPC症状,填补了该领域的临床空白。
在一项随机、双盲、安慰剂对照、为期12个月的试验中,该药的安全性和有效性得到评估。试验对象为2~19岁的NPC确诊患者。50名患者以2:1的比例随机接受经体重调整的Miplyffa(31~124mg)或安慰剂治疗,每日三次。50名患者中,有39名(78%)在试验中接受了miglustat作为基础治疗。
R4DNPCCSS评分为NPC疾病进展的衡量标准,它评估了NPC患者、护理人员和医生认为与疾病进展最相关的四个项目,包括行走、说话、吞咽和精细运动功能,分数越高表示疾病越严重。分析显示,根据R4DNPCCSS评分,Miplyffa组患者与安慰剂相比的疾病进展较慢。
Cobenfy 精分新靶点药物征途漫漫
精神分裂症是一种严重的慢性精神疾病,可引起多种精神病症状。该病有一定的遗传概率,许多环境因素也是疾病的诱因,发病高峰年龄段为25~54岁。流行病学调查显示,精神分裂症是导致精神残疾的主要疾病,给社会带来了沉重负担。传统的抗精神分裂症药物靶点为多巴胺受体及皮质多巴胺受体,第一代药物通过抑制多巴胺受体在边缘系统的作用,在一定程度上控制精神分裂症阳性症状;第二代药除抑制多巴胺受体还可作用于皮质多巴胺受体,调节血清素、去甲肾上腺素和(或)组胺神经传递等。
2024年9月26日,百时美施贵宝(BMS)的Cobenfy(曲司氯铵/占诺美林)顺利获FDA批准上市,用于治疗成人精神分裂症,成为数十年来首个获批的全新机制的精神分裂症治疗药物,也是首款获批治疗精神分裂症的毒蕈碱乙酰胆碱受体激动剂。
该药的功效被认为是在中枢神经系统中对M1和M4毒蕈碱乙酰胆碱受体的激动剂活性。曲司氯铵是一种毒蕈碱拮抗剂,主要在外周组织中拮抗毒蕈碱受体。
尽管已获批上市,但Cobenfy在精神分裂症领域的征途长路漫漫。今年4月22日,BMS宣布Cobenfy在ARISEⅢ期试验中的顶线结果。该试验旨在评估Cobenfy作为非典型抗精神病药物的辅助治疗药物,拟治疗成人精神分裂症患者。然而,试验结果显示,Cobenfy作为辅助治疗药物,在第6周时与安慰剂相比,阳性与阴性症状量表(PANSS)总分仅降低了2.0分,未达到统计学显著性(P=0.11),次要终点也均未达到统计学差异。
BMS指出,精神分裂症辅助疗法的研发面临患者反应异质性、严苛的试验设计要求及增量获益验证的复杂性等挑战。接下来,公司将进一步分析数据。
不过,该药的目标不只是精神分裂症市场,其针对阿尔茨海默病和自闭症谱系障碍、双相情感障碍等领域的研究也在推进。
相关

走出“死亡谷”黎明在望?
蒋莉莉
2024年全球推出的48种新活性物质(NAS)中,有8个为神经领域药物。其中包括30多年来精神分裂症治疗领域的首个新机制新药,以及4种用于治疗神经罕见病的新药申请(NAS),其中2种用于杜氏肌营养不良症,2种用于C型尼曼-匹克病。2024年,FDA批准5款CNS小分子化药上市,但在今年第一季度,未有新力量加入。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 6
6

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 7
7

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 7
7