 产业资讯
产业资讯
 医药魔方
医药魔方  2025-05-29
2025-05-29
 952
952
2025年2月,强生公司的埃万妥单抗注射液(锐珂®)(Amivantamab, Rybrevant®)在中国获批上市:与卡铂和培美曲塞联合给药,用于经检测确认携带EGFR 20号外显子插入(exon20ins)突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
4月底,埃万妥单抗的第二个适应症在华获批:联合卡铂和培美曲塞,治疗携带EGFR exon19del或L858R,经EGFR-TKI治疗进展的晚期非鳞状NSCLC患者。
同年的4月、5月,埃万妥单抗的两款原研伴随诊断(组织和血浆)依次获得NMPA批准。而这两个用途,均搭载于制造业单项冠军企业艾德生物的同一款产品——人类10基因突变联合检测试剂盒(可逆末端终止测序法)。
这款试剂盒,曾在2018年首次通过NMPA创新医疗器械审查通道获批上市:作为治疗肺癌和肠癌关键靶向药物的伴随诊断,已经服务中国临床七个年头。本次获批是增加了EGFR exon20ins的CDx标签,以及第二个全新用途——血浆检测。
埃万妥单抗何许人也
埃万妥单抗是一款双特异性抗体,可以同时靶向结合EGFR和MET的胞外域,施加双重抗癌机制:它阻断配体结合,诱导EGFR和MET降解,从而阻扰其信号传递;它亦可通过免疫效应细胞,靶向杀伤肿瘤细胞。如此高效的作用机制,造就了埃万妥单抗优异的治疗效果——
NCCN指南关于埃万妥单抗的用药推荐:
1类推荐——联合卡铂和培美曲塞,一线治疗EGFR exon20ins晚期的NSCLC(非鳞癌)患者;
1类推荐——联合拉泽替尼(lazertinib),一线治疗携带EGFR exon19del/L858R的NSCLC患者;
1类推荐——联合化疗,后续治疗经奥希替尼治疗进展、携带EGFR exon19del/L858R的晚期NSCLC患者;
2A类推荐——后续治疗经铂类化疗进展、携带EGFR exon20ins的NSCLC患者。
自从2021年FDA首次批准上市后,埃万妥单抗一路高歌猛进,从单药到组合,从一线到后线,从罕见靶点(EGFR exon20ins)到常见靶点(EGFR 19del/L858R),每一项研究都蕴藏着“敢教日月换新天”的期许和能量。
伴随诊断——“优等生”的晋级之路
在创新药物全球商业化的进程中,每项新适应症的获批,都会增加广泛的适用人群;而每治疗一名患者,便肩负了一份承诺,一份责任。
强生作为全球药企,对药物/诊断的协同布局可谓追求到了极致:纵观埃万妥单抗的成长过程,在全球主要的区域市场,强生都为其搭建了药物与CDx产品的生态系统,以应对各国独特的法规要求,采用最高的标准来确认适用的患者人群,从而确保治疗获益的稳定输出。


在美国、日本、中国,埃万妥单抗为了有效定位患者,采用了两种最有效的技术路径:收集肿瘤组织(FFPE)和血浆(plasma)样本,使用在本国获批上市的伴随诊断试剂盒进行分子检测,获得EGFR基因的exon20ins突变结果,从而确认患者是否可以接受治疗。因此,强生在每个国家的市场,通过合作开发的方式,分别布局了“组织+血浆”至少两款CDx产品。
尤其是在日本,由于实行的是药物-诊断-医保强绑定的临床应用模式,强生也为药物补充了区域性诊断策略:对于联用EGFR-TKI的适应症,需要识别EGFR常见突变(exon19del和L858R),强生选择了在日本NSCLC临床市占率颇高的产品——艾德生物的人类肺癌11基因(PCR)试剂盒(AmoyDx® Pan Lung Cancer PCR Panel)合作申报伴随诊断[1],可谓将诊断合规做到极致。
伴随诊断——创新药生态的重要一环
对于CDx的系统性布局,强生并不是独家:各家跨国药企,为创新抗肿瘤药物,都搭建了完整的生态;专注于生物标志物的高水准诊断产品,正是创新药物生态搭建的支柱。与原研CDx的协同开发,是靶向机制药物上市的必备条件,也是嵌入创新药生命周期的“护身锦囊”。
在机遇与风险并存、规则与认知震荡上升的当下,坚守科学本质的“笨办法”,往往才是唯一的捷径。
以血浆检测为例,我们穷举在美国获批上市的伴随诊断(液体活检)产品清单,不难看出,肺癌、肠癌、乳腺癌、前列腺癌这些瘤种,已经有成熟的血浆检测临床共识,血浆CDx是药物上市的必选项;而跨国药企的畅销药物,大多都承载了血浆CDx的开发使命。这些创新的CDx产品,开发难度大,而一旦成功上市,却能有效地拓宽适用人群,是药物大规模推广的公认前提。
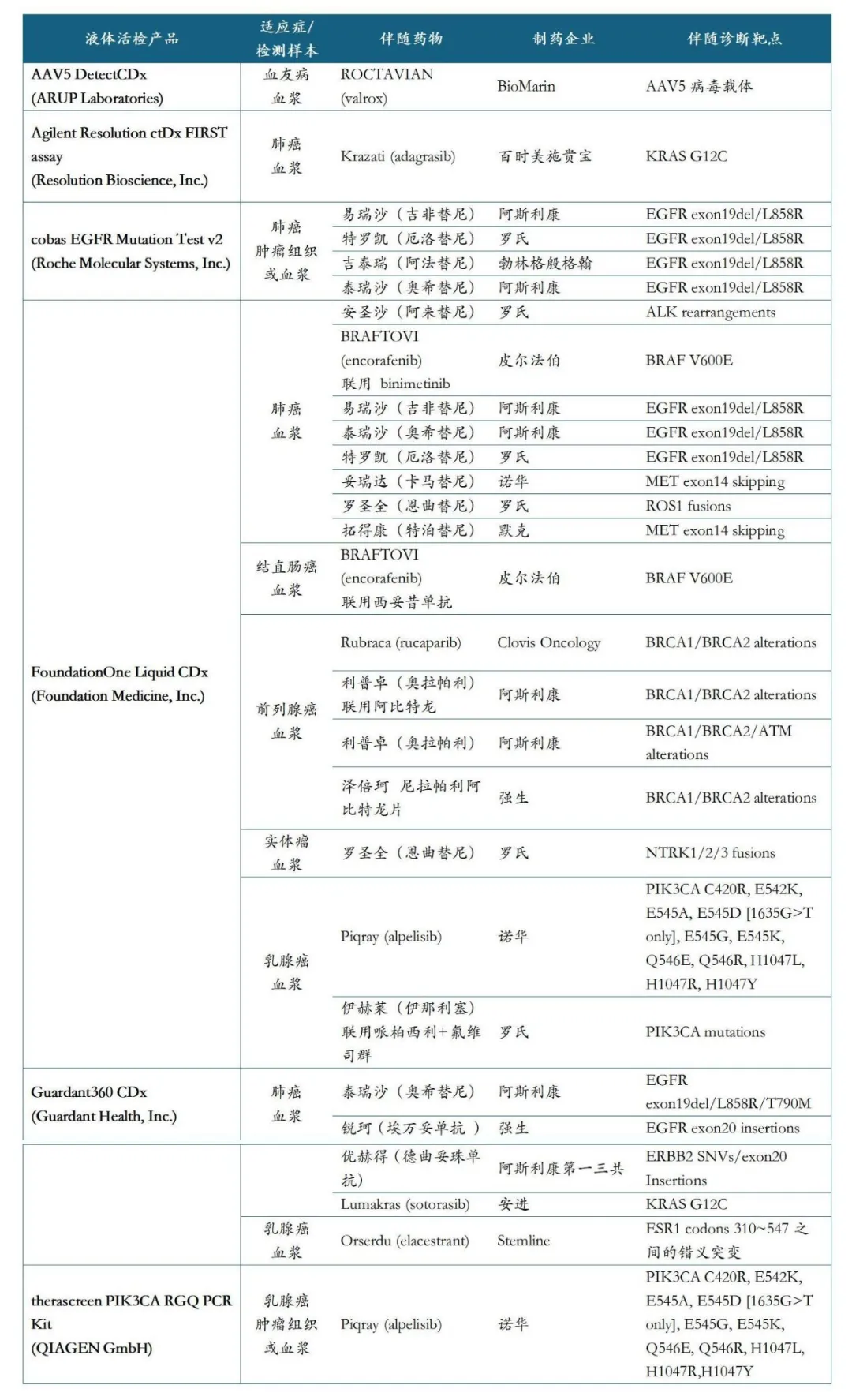
FDA批准的血浆伴随诊断一览(更新至2025年4月)
中国伴随诊断,生态正在成长
自从2018年,NMPA开始按照“伴随诊断(CDx)”的标准,审批靶向药物相关的IVD产品以来,药物开发者、诊断开发者们,便与监管部门一道展开了执着的探索。尤其是创新药,与CDx的协同开发、共同上市,是产品合规应用的必备保障,也是临床循证的必经之路。
过去几年,中国的原研CDx产品的数量已经有了可喜的积累,然而药物/诊断的获批节奏普遍难以同步:上市时间相差一年已经算是乐观情况;更有甚者,药物上市前承诺过的原研CDx计划,挣扎多年无法落实、苦苦找人接盘的也大有人在,此中过程不可谓不艰苦。
创新药与CDx的上市时间差,导致标准诊断方法的可及性困难——这使得患者接受的治疗决策,经常暴露在丛林般的信息来源中;而对于靶向驱动的抗肿瘤治疗来说,CDx的缺失,给临床应用蒙上了一层难以预测的合规风险。
道虽远,行则将至
回到开篇,一款创新药、两款原研伴随诊断、三个月内在国内相继上市——这个协同节奏之紧凑,令人眼前一亮。一家国际顶级药企,一个伴随诊断龙头,强生与艾德交出的这份答卷,实乃在中国药监体系的监督与激励下,药械合作的一次优秀示范。
艾德生物的这款NGS试剂盒,适用于两个适应症(肺癌和结直肠癌)的10个临床决策基因:EGFR、ALK、ROS1、RET、KRAS、NRAS、PIK3CA、BRAF、HER2和MET。随着“肿瘤组织+血浆”EGFR exon20ins伴随诊断标签的入列,这款产品将继续作为中国肿瘤CDx的前哨,探索药物与器械协同上市、临床获益模式的新边界。
我们也能看到,未来会有更多如强生一样的企业:作为敬畏科学、敢于突破的实践者,加码中国创新药生态的先行者,选择志向相投的合作者,搭建出属于自己的行业丰碑。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 3
3

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 4
4

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 4
4