 研发追踪
研发追踪
 医药笔记
医药笔记  2025-06-02
2025-06-02
 2104
2104
2025年5月28日,拜耳宣布Sevabertinib(BAY 2927088)获FDA授予优先审评资格,用于治疗已经接受过一种系统治疗的HER2突变非小细胞肺癌患者。


Sevabertinib的上市申请是依据1/2期临床SOHO-01的数据,队列D未接受过HER2靶向治疗,队列E接受过HER2靶向治疗。截至2024年10月14日,队列D入组44例患者,队列E入组34例患者,ORR分别为70.5%、35.3%,DCR分别为81.8%、52.9%,mDOR分别为8.7个月、9.5个月。安全性方面,治疗相关副作用发生率97.4%,腹泻是导致减量的最主要副作用,但没有患者因为腹泻停止治疗,未发生间质性肺炎副作用。

Sevabertinib为拜耳的核心管线之一,此前已经获得中国、美国的突破疗法认证,目前正在推进三期验证性临床SOHO-02,以及HER2激活突变泛瘤种的二期临床panSOHO。
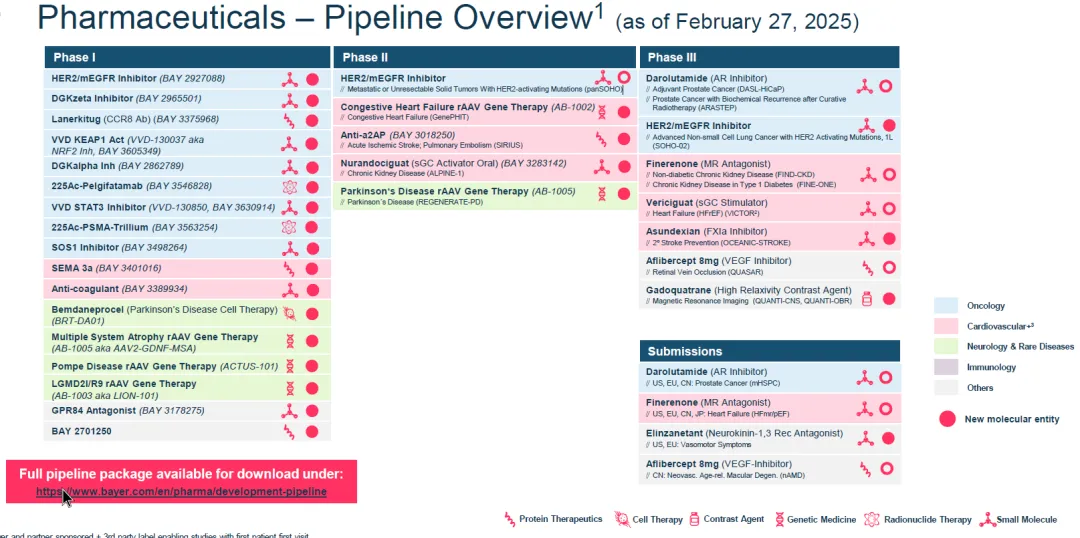
总结
HER2激活突变占到非小细胞肺癌患者的2-4%,目前还缺乏FDA完全批准的治疗方案。拜耳在竞争激烈的EGFR exon20ins之外,找到了HER2 exon20ins这一突破口。

原文链接:
https://www.bayer.com/en/us/news-stories/sevabertinib

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 50
50

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 44
44

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 42
42