 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-06-09
2025-06-09
 615
615
当地时间 6 月 4 日,拜耳全资拥有并独立运营的子公司 Vividion Therapeutics 宣布,其已获得临床阶段 WRN 共价抑制剂 VVD-214(RO7589831)的全球独家开发和商业化权利,将增强并补充其创新的肿瘤学开发管线。

来自:企业官网
VVD-214 是由罗氏和 Vividion Therapeutics 合作研发的一种口服新型首创共价不可逆 WRN 抑制剂。其是在 Vividion 与罗氏于 2020 年达成的独家全球合作与许可协议下发现和开发的。
在 2025 年 AACR 大会上,该药的一项开放标签、多中心、I 期临床研究 (NCT06004245) 结果被披露。该研究评估了 VVD-214 对 MSI 和/或 dMMR 晚期实体瘤患者的安全性、药代动力学 、药效学和初步抗肿瘤活性。主要目的是确定最大耐受剂量 (MTD) 和/或推荐的 II 期剂量 (RP2D)。
截至 2024 年 11 月 25 日,共 44 例患者(22 名 CRC 和 22 名非 CRC)被纳入 6 个剂量组(从 150 mg 到 2000 mg)。这些患者既往治疗线数中位数为 3,89% 接受过免疫检查点抑制剂治疗。
在 32 名疗效可评估的 MSI 患者中,4 名患者获得部分缓解(PR)(2 例已确认),持续缓解时间长达 9.5 个月以上,DCR 为68.8%(95%CI 51.13, 86.37),20 例患者达到疾病稳定(SD)。
在安全性方面,最常见的治疗中出现的 AE 是恶心、腹泻和呕吐。3 级 (G) 治疗相关 AE (TRAE) 包括恶心和 AST/ALT 升高以及疲劳和贫血。未观察到 G4 或更高级别的 TRAE。
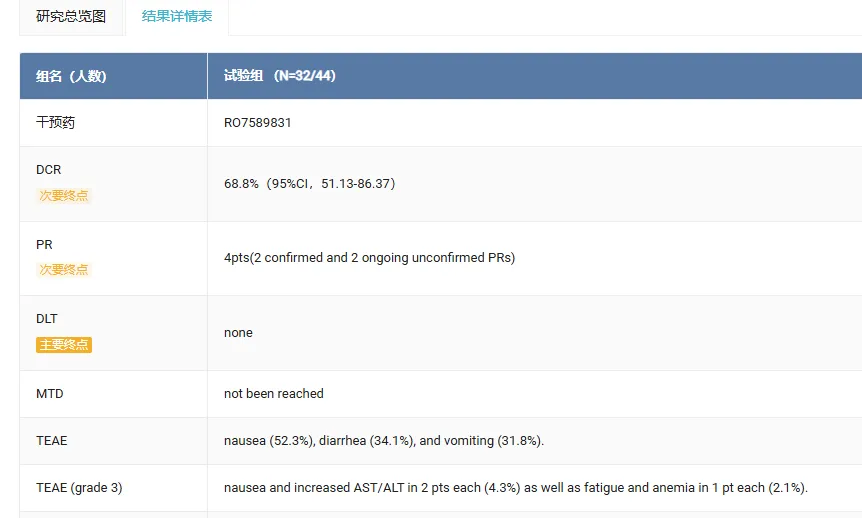
来自:Insight 数据库
Insight 数据库显示,目前全球范围内共有 6 款 WRN 抑制剂进入临床阶段(仅统计积极状态),其中诺华和 GSK 均有入局,不过都尚处早期临床阶段。
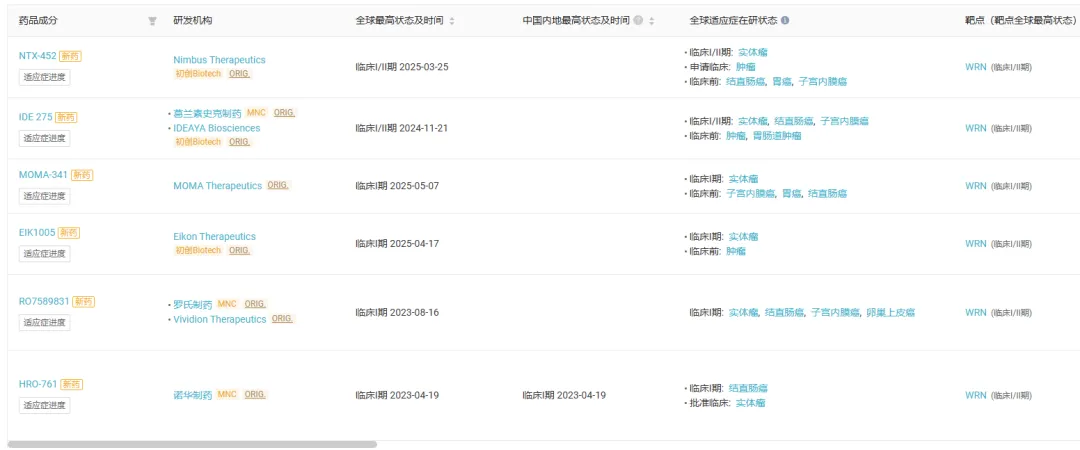
来自:Insight 数据库
原文链接:

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 19
19

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 20
20

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 20
20