 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-06-13
2025-06-13
 892
892

最近,分子胶(Molecular Glue)领域又迎来一波小高潮。
先是在5月20日,Blueprint Medicines修订了与VantAI的协议,达成了潜在高达16.7亿美元的交易。Blueprint 被VantAI最近推出的基础模型Neo-1所吸引,Neo-1模型有助于加快新型诱导邻近疗法的发现和开发,实现了基于人工智能(AI)的分子胶和其他PPI修饰化合物的生成。
旋即在第二天,即5月21日,罗氏与Orionis Biosciences达成了第二次合作,追加20亿美元共同开发针对肿瘤领域创新和具有挑战性靶点的小分子单价分子胶药物。Orionis的AlloGlues分子胶平台,融合了先进的化学生物学工具、工程化细胞检测系统、定制高通量机器人自动化技术以及专用AI基础架构,从而可以加速分子胶的发现和合理设计。
借助人工智能(AI)和大数据,分子胶的合理开发变得越来越有可能。
01
分子胶从“偶然发现”到“合理设计”
分子胶是一类小分子,可改变蛋白质的表面特性以增强或诱导蛋白质-蛋白质相互作用(PPI),从而导致特定的生物效应,如蛋白质降解、通路抑制或激活。
分子胶的独特特性赋予它们高选择性和生物利用度,允许控制药物释放。分子胶在治疗糖尿病、心血管疾病、眼科疾病和癌症等疾病方面显示出巨大的临床潜力。
分子胶最成熟的应用是诱导靶向蛋白质降解(TPD)。通过在靶蛋白和E3 连接酶之间诱导PPI,产生由“靶蛋白-分子胶-E3 连接酶”组成的三元复合物。这种三元复合物的形成诱导靶蛋白的多泛素化,导致其通过泛素-蛋白酶体途径降解,这类分子胶称为分子胶降解剂。
与传统疗法相比,TPD方法的主要优势在于它能够靶向更广泛的靶点,尤其是“不可成药”的靶点。
PROTAC(蛋白水解靶向嵌合体)和分子胶是TPD分子的两大类。与 PROTAC相比,分子胶在几个方面具有优势。例如,分子胶具有更好的物理化学性质、较低的亲和力要求以及减少或没有钩状效应(图1)。这些优异的特性使 分子胶成为药物开发的更好候选者[1]。
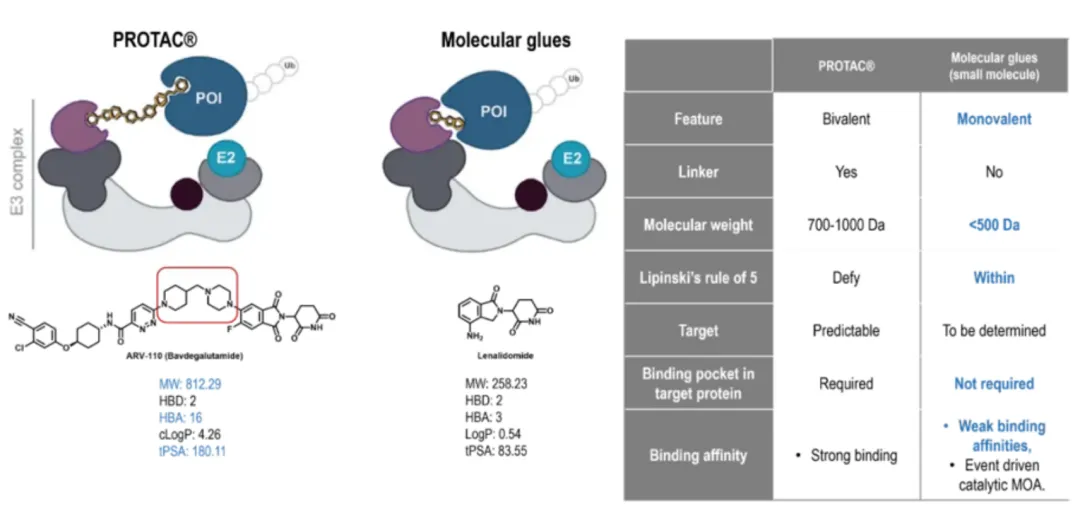
图1. PROTAC和分子胶比较
然而,分子胶的发现比PROTAC更具挑战性,分子胶降解剂的发现主要依赖于各种筛选策略,通常涉及偶然发现、高通量筛选或药物化学指导的理性设计。
分子胶的作用机制(MoA)涉及诱导蛋白质-蛋白质相互作用,这通常伴随着构象变化。因此,分子胶的早期发现过程通常具有较低的命中率。这也使构效关系(SAR)分析和基于结构的药物设计复杂化。此外,分子胶命中对化学修饰高度敏感。鉴于这些挑战,大规模筛查仍然是分子胶发现的主流方法。
不过,随着各类分子胶发现平台的出现,以及人工智能(AI)在药物研发上的应用,分子胶的研发正在从“碰运气”走向系统开发,这也使得分子胶再次成为药物研发的风口,正逐步成为制药巨头们争相布局的重点领域。据不完全统计,近两年,分子胶领域已产生十几笔交易,总金额超过130亿美元,这一数据足以证明其市场潜力。
02
分子胶平台
全球多家公司拥有独特的分子胶发现平台,包括Orionis Biosciences的Allo-Glue™平台,Magnet Biomedicine的TrueGlue平台和药明生物分子胶发现平台等。
2.1 Orionis Biosciences的Allo-Glue™平台
AlloGlues分子胶平台通过重编程蛋白质功能并通过近端或远端变构机制影响疾病靶点(包括曾经被认为“不可成药”的靶点)来诱导或增强特定的蛋白质-蛋白质相互作用。
AlloGlues分子胶平台用系统、大规模的发现、设计和优化各种单价胶取代了二元和偶然发现,该平台集成了多种技术,能够在多个维度上研究分子相互作用的复杂性(图2),包括:
a. 实验和计算机数据采集的规模和速度:通过将专有生物分析与定制自动化、机器人技术、专业数值建模和OrionisBio™ AI/ML工具相结合,大规模发现和分析活细胞中的蛋白质-蛋白质相互作用;
b.发现模式:大规模启用以靶标为中心、反向靶标中心和连接酶为中心的方法;
c.化学多样性:他们的化合物库中的骨架多样性有助于探索大型化学空间;
d.专用 Orionis SAR-Enhancer AI:专有工具,支持对包含超过1万亿个分子的虚拟但易于合成的化合物空间进行多变量计算机模拟查询,从而推动快速的 SAR和胶水优化周期;
e.蛋白质多样性:支持跨~20,000种蛋白质(基因组规模)和数百种合格连接酶的询问范式,以评估活细胞中胶反应性蛋白质的相互作用。
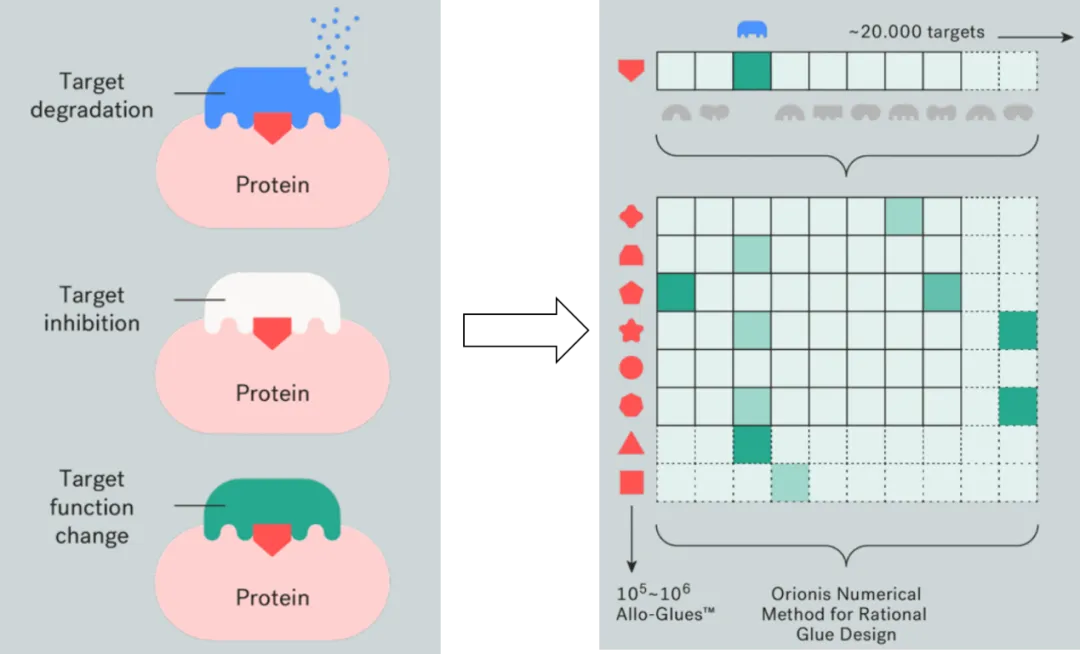
图2. AlloGlues分子胶平台
2.2 Magnet Biomedicine的TrueGlue平台
TrueGlue平台是一种模块化的技术,能够系统地发现用于治疗人类疾病的分子胶。它通过高通量筛选和优化,快速识别能够诱导蛋白质相互作用的分子胶候选物,从而为药物发现提供新的靶点和机制。
当TrueGlue与呈现蛋白结合时,会产生一个neo-PPI界面,介导与疾病靶蛋白形成三元复合物,并导致靶蛋白连接酶依赖性结合。
TrueGlues平台具有以下优点:
a.新型PPI可以克服靶蛋白配体性的局限性;
b.呈现蛋白的组织特异性可以最大限度地减少脱靶毒性;
c.细胞外呈现蛋白可以使细胞因子/受体的胶抑制剂用口服小分子代替可注射生物制剂(图3)。
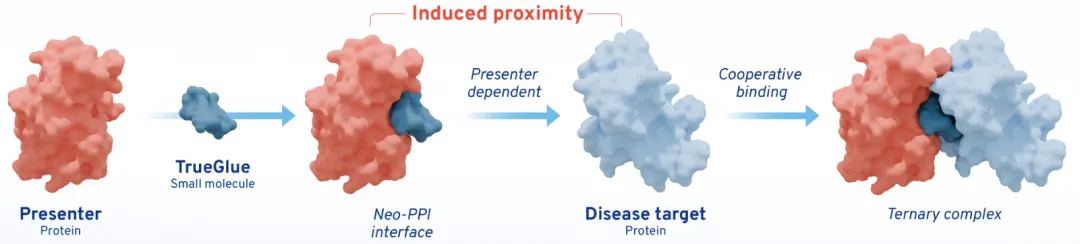
图3. TrueGlue分子胶平台
2.3 药明生物分子胶发现平台
药明生物开发了一个全面的分子胶发现平台,配备了DNA编码文库 (DEL)、亲和选择质谱(ASMS)和高通量筛选(HTS)技术(图4)。
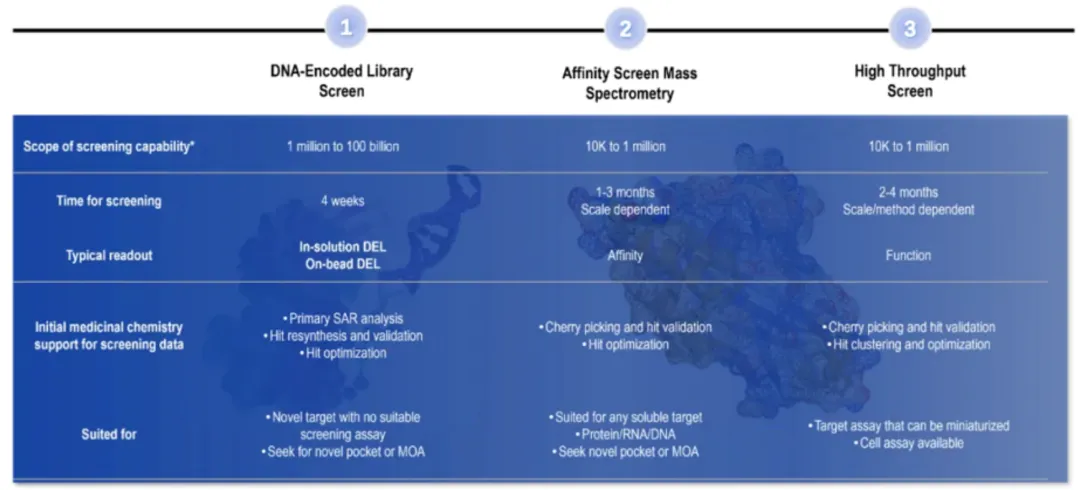
图4. 药明生物分子胶发现平台
药明生物提供两种类型的通用小分子DEL,用于分子胶的发现。一个是多元化的库,包含200多个由不同合成路线构建的子库,拥有超过500亿个结构。这些化合物是根据来自公共信息的6,000多个生物活性骨架设计的,包括已批准或处于临床阶段的药物、公共数据库、专利或文献。这些不同的文库非常适合没有报道的分子胶或配体的靶标(图5)。
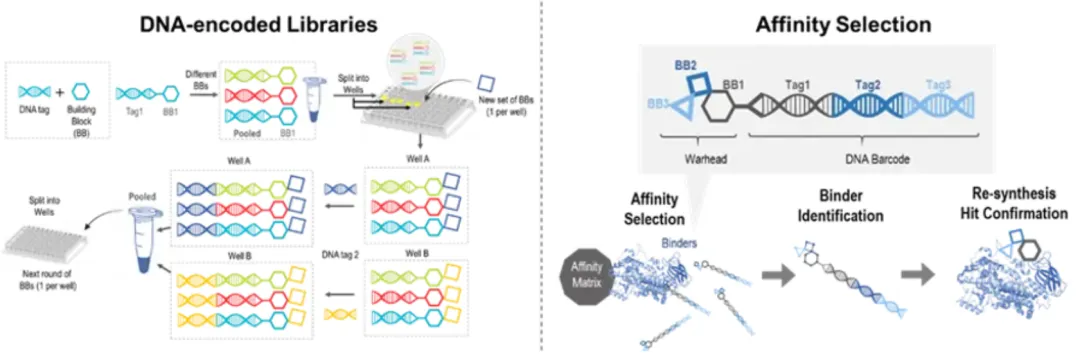
图5. 用于分子胶发现的DEL筛选平台
另一种是以分子胶为重点的文库,基于已报道的小分子配体或分子胶的核心骨架设计。该文库通过广泛的化学修饰显著扩展了核心骨架的化学空间,同时保持了较高的靶标特异性和成功率。
药明生物开发了一种靶向CRBN的免疫调节酰亚胺药物(IMiD)重点文库。CRBN分子胶的溶剂暴露区域对于底物识别和诱导PPI至关重要。通过应用不同的合成路线和构建单元,对溶剂可及界面进行了广泛的修改。这生成了一个包含大约600万种溶液和磁珠上化合物的集中文库。对于具有现有分子胶和配体的靶标,聚焦文库方法可以确保良好的筛选性能和命中率(图6)。
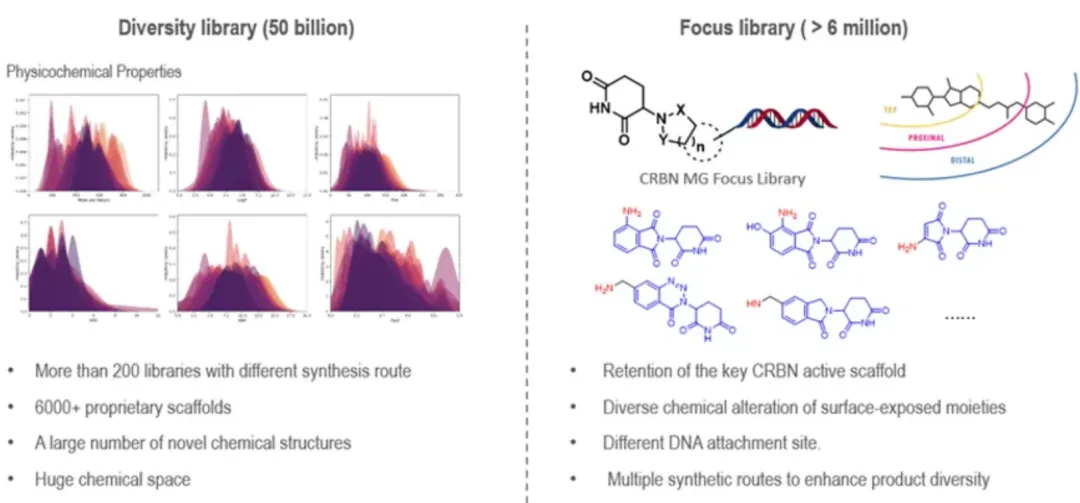
图6. DEL在药明生物分子胶发现中的应用
2.4 Monte Rosa Therapeutics的QuEEN平台
QuEEN平台首先构建了一个包含超过10,000种结构的专有化学库,这些结构专门用于泛素连接酶的重编程。这些化合物经过精心设计,能够与E3泛素连接酶(如CRBN)相互作用,从而诱导目标蛋白的降解(图7)。
QuEEN平台整合了人工智能(AI)技术,构建了预测模型,用于预测分子胶降解剂的活性和选择性。这些模型能够加速药物发现过程,减少实验成本和时间。
QuEEN平台主要有三个模块:1)CRBN配体衍生分子库,2)接近性筛选技术和化学-蛋白质组学验证,3)AI预测模型[2]。

图7. QuEEN分子胶平台
为构建CRBN靶点图谱,Monte Rosa通过计算挖掘人类蛋白质组中类似已知CRBN新底物β-hairpin G-loops的基序(Degron结构)来筛选neo-substrate(图8)。
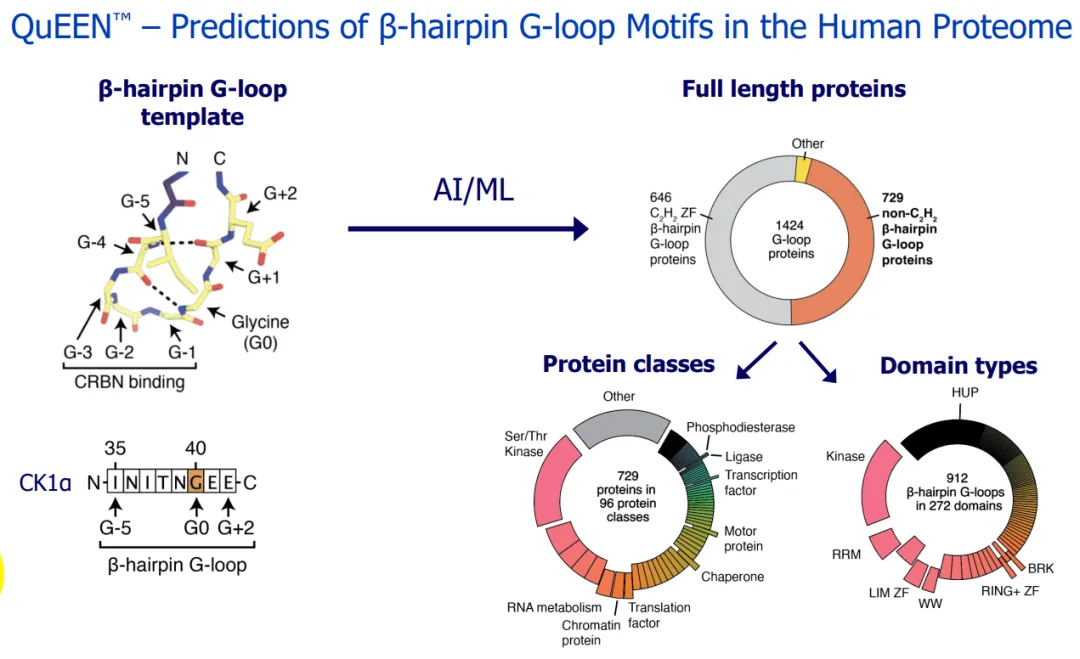
图8. Monte Rosa利用Degron结构筛选neo-substrate
2.5 Proxygen的分子胶平台
Proxygen的分子胶平台是一个高度通用且可扩展的发现引擎,专注于识别和开发分子胶降解剂。
该平台具有高度通用性、整合了尖端基因组学、蛋白质组学和生化技术以及目标导向等特点(图9)。
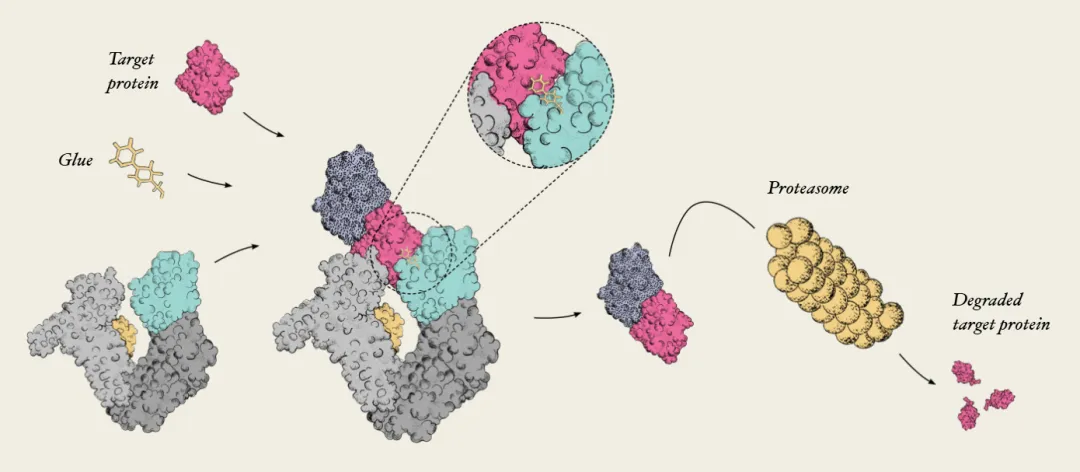
图9. Proxygen的分子胶平台
2.6 达歌生物的GlueXplorer平台
GlueXplorer是由达歌生物开发的全球领先的分子胶药物发现平台,GlueXplorer平台拥有超过10,000种具有独特结构的分子胶化合物,这些化合物及其诱导邻近和降解靶点蛋白的数据构成了一个强大的化合物库。这一丰富的化合物库为新靶点的发现和分子胶的优化提供了坚实的物质基础(图10)。
GlueXplorer平台利用人工智能技术,能够精准预测新型可降解靶点,该平台专注于开发针对以往难以成药靶点的新型分子胶降解剂药物。
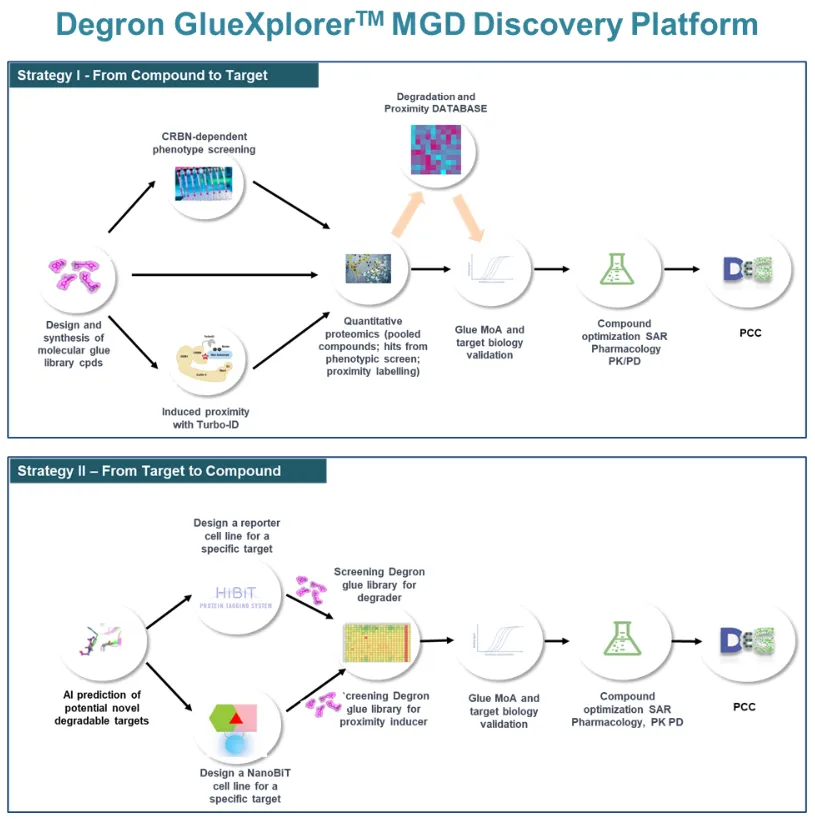
图10. 达歌生物的GlueXplorer平台
03
在研的分子胶降解剂
截至目前,全球共有3款分子胶药物获批上市,包括沙利度胺(Thalidomide)、来那度胺(Lenalidomide)和泊马度胺(Pomalidomide)(图11)[3]。
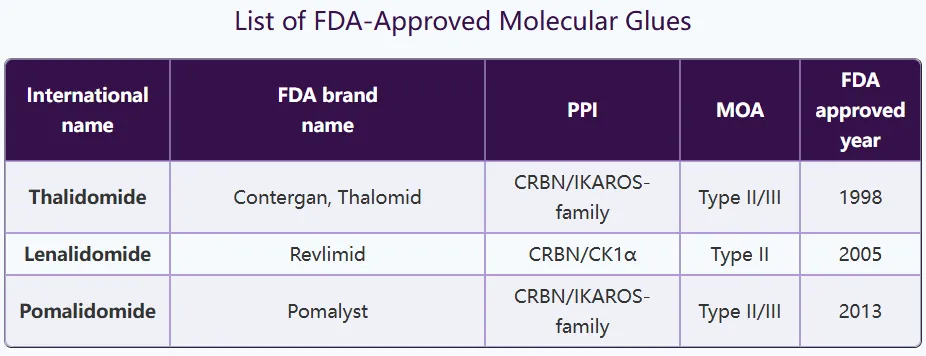
图11. 获批上市的分子胶药物
除上述获批药物之外,还有很多在研的分子胶药物,如Mezigdomide、Golcadomide、Iberdomide和BMS-986470等(图12)。

图12. 部分在研的分子胶降解剂
04
代表性药物
4.1 BMS-986470
胎儿血红蛋白(HbF,α2γ2)的再激活是公认的镰状细胞病(SCD)疾病调节剂,其中治疗有限且仍然存在大量未满足的需求。已经确定了几种HbF的转录抑制因子,包括B细胞淋巴瘤/白血病11A(BCL11A)、锌指和含有BTB结构域7A(ZBTB7A)和广泛间隔的锌指蛋白(WIZ)[4]。
BMS-986470是由BMS开发的一种潜在的首创口服生物可利用的HbF激活CRBN E3连接酶调节剂(CELMoD™)试剂,靶向ZBTB7A和WIZ进行降解来诱导胎儿血红蛋白(HbF)的表达,从而改善镰状细胞病(SCD)的病理。
临床前动物药效显示:在人红细胞生成的小鼠模型中,BMS-986470不影响人成红细胞分化,并显示出hZBTB7A和hWIZ蛋白的显著剂量依赖性降低,以及F细胞和γ-珠蛋白表达的增加。
值得注意的是,与载体对照相比,以最小有效剂量治疗的小鼠的总HbF水平增加了3倍。BMS-986470 还显着诱导表达人CRBN的Townes小鼠外周血中的F细胞和γ-珠蛋白,并在缺氧条件下减少离体镰状细胞。
在每天用BMS-986470治疗16天的幼稚健康食蟹猴中,观察期为2周,WIZ和ZBTB7A的显着剂量依赖性降解很明显,同时循环未成熟红细胞增加,HBG1/2转录本,外周血和骨髓中γ-珠蛋白和红系祖细胞标志物增加。BMS-986470在所有测试剂量下均具有良好的耐受性。
BMS-986470正在进行1/2期临床试验(NCT06481306),旨在评估其在健康志愿者和镰状细胞病(Sickle Cell Disease, SCD)患者中的安全性、耐受性、药代动力学(PK)、药效学(PD)和初步疗效。该试验计划招募184名受试者,预计主要完成日期为2027年1月6日。
4.2 KPG-818和KPG-121
康朴生物是一家于2011年1月成立的创新型生物医药企业,专注于自身免疫疾病、癌症、炎症等治疗领域,以国际领先的分子胶-蛋白质泛素化降解技术NeoMIDES®和gDACs®、X-SYNERGY®等自主专利技术为基础,致力于开发具有全球自主知识产权的创新药物,主要研发管线包括KPG-818和KPG-121等(图13)。

图13. 康朴生物研发管线
KPG-818是由康朴生物开发的一种靶向IKZF1/IKZF3新型口服分子胶免疫调节药物,通过与CRBN蛋白结合,高效降解IKZF1和IKZF1,用于治疗系统性红斑狼疮(SLE)、血液肿瘤和炎症性肠病(IBD)等。
KPG-818 在多种血癌动物模型中表现出出色的体外抗炎特性、广泛的抗增殖活性和显着的体内疗效。
去年6月,KPG-818的一项2a期研究(NCT04643067)取得积极结果:0.15mg KPG-818组的SLEDAI评分和皮肤红斑狼疮疾病面积和严重程度指数(CLASI)活性评分相对于基线和安慰剂有所改善(图14)[5]。
KPG-818 显示出良好的剂量暴露相关性和10小时的半衰期;KPG-818减少了总B细胞、Aiolos T细胞和Aiolos B细胞的数量,并增加了Treg细胞。
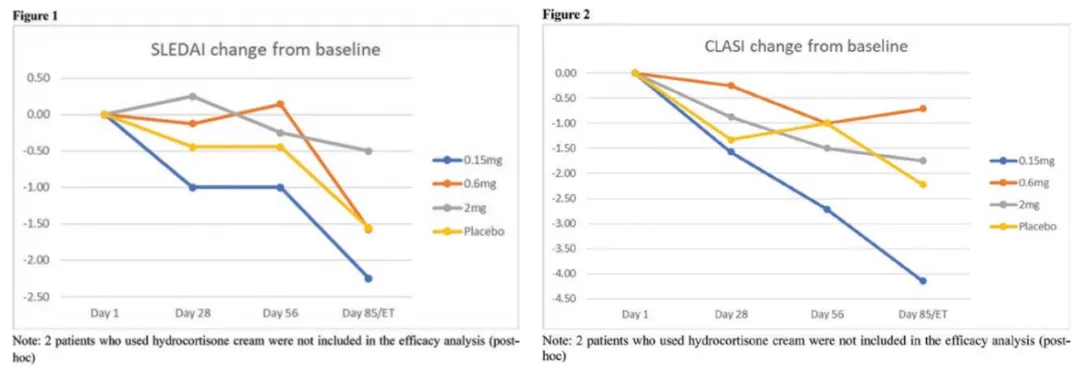
图14. KPG-818的临床2a期试验结果
总得来说,KPG-818 0.15 mg和0.6 mg在该SLE人群中12周的治疗中总体耐受性良好。概念验证结果表明,KPG-818是一种具有新型免疫调节作用机制的药物,在SLE中具有良好的获益/风险比,支持KPG-818在SLE中的进一步临床开发。
2025年4月,康朴生物宣布CDE已批准KPG-818胶囊用于治疗SLE的中度至重度皮肤表现的IIb期临床试验(CTR20241116)。同时,KPG-818 目前正在美国 (NCT04283097) 进行用于治疗血液系统恶性肿瘤患者的 I/II 期研究。
KPG-121是一种新型小分子靶向蛋白降解药物,属于新一代CRBN E3泛素连接酶复合物CRL4CRBN调节剂,它通过靶向CK1α和转录因子Aiolos及Ikaros的泛素化和降解,具有抑制细胞增殖活性和抗血管生成活性,同时增强免疫调节功能。
与来那度胺相比,KPG-121与CRBN的相互作用更强,免疫调节活性更强,抗增殖/抗血管生成特性更强。KPG-121 在临床前研究中与阿比特龙、恩扎卢胺、阿帕他胺或达罗他胺联合使用体外和体内都显示出协同作用。
2024年ASCO会议上,评估KPG-121 联合阿比特龙、恩扎卢胺或阿帕他胺在 mCRPC 患者中的安全性、PK和初步疗效的首次人体 1 期研究结果被公布。
研究结果显示:在8例RECIST可评估疾病患者中,3例(37.5%)部分缓解,3例(37.5%)疾病稳定。总体而言,客观缓解率和疾病控制率分别为37.5% (3/8例)和75.0%(6/8例)。KPG-121的PK评估表明,半衰期范围为2.66至 2.83小时[6]。
2023年11月,康朴生物医药宣布将启动KPG-121治疗转移性去势抵抗性前列腺癌的全球多中心II/III期注册性临床试验。2025年1月,KPG-121联合阿比特龙用于一线治疗转移性去势抵抗性前列腺癌的2/3期临床试验申请已获得美国FDA批准。
4.3 ICP-490
ICP-490是由诺诚健华研发的靶向IKZF1/3的高效选择性的降解剂,通过特异性结合CRL4CRBN-E3泛素连接酶复合体,诱导转录因子IKZF1和IKZF3的泛素化和降解。
2023 年 9 月, ICP-490 联合地塞米松的临床试验获批开展。ICP-490 作为单一疗法或与其他疗法联合治疗在血液肿瘤治疗中显示出强大的潜力。
ICP-490在与单抗药物的联合治疗中表现出免疫调节活性。低剂量的ICP-490可强力诱导IL-2和颗粒酶B的释放,有效提升抗CD38单抗药物在多发性骨髓瘤中的疗效。在非霍奇金淋巴瘤中,ICP-490与BTK抑制剂奥布替尼联合使用时展现出协同抑瘤作用。
ICP-490目前正在进行的2期临床试验包括,包括ICP-CL-01102(NCT06845241)和ICP-CL-01101(NCT05719701)。
ICP-CL-01102是一项多中心、非随机和开放标签的 I/IIa 期临床研究,以评估 ICP-490 在复发或难治性非霍奇金淋巴瘤患者中的安全性、耐受性和有效性,预计主要完成日期为2028年7月1日。
ICP-CL-01101是一项多中心、非随机和开放标签的 I/IIa 期临床研究,旨在评估 ICP-490 在复发和/或难治性多发性骨髓瘤患者中的安全性、耐受性和有效性,预计主要完成日期为2025年7月30日。
4.4 GLB-001和GLB-002
格博生物是一家于2020年12月成立的专注于分子胶靶向蛋白降解药物研发的生物医药公司,公司已建立了多维度蛋白降解筛选平台、创新靶点验证平台、分子胶理性设计平台,以及专有高活性分子库,主要产品管线包括GLB-001和GLB-002等(图15)。
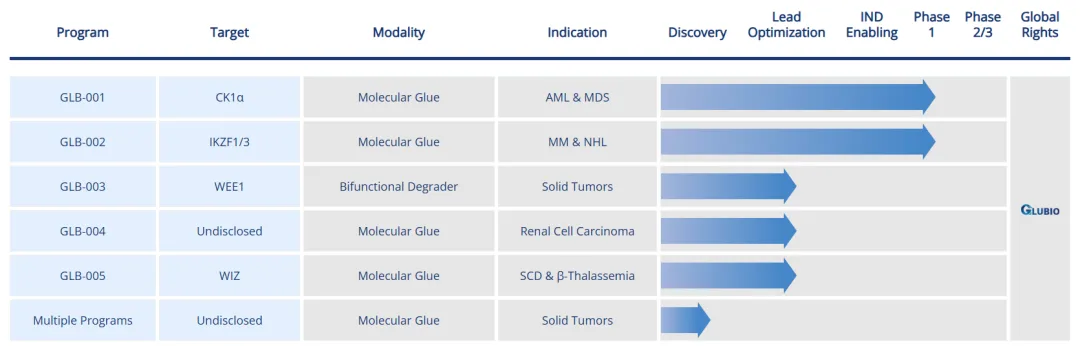
图15. 格博生物的研发管线
GLB-001是由格博生物研发的一款靶向酪蛋白激酶1α(CK1α)的分子胶蛋白降解剂,于2024年2月获得NMPA批准在髓系恶性肿瘤中开展临床研究,是国内首款进入临床开发阶段的靶向CK1α分子胶蛋白降解剂。
2023年4月,GLB-001已获得FDA批准进入临床研究,用于复发/难治性急性髓系白血病(R/R AML)或复发/难治性较高危骨髓异常增生综合征(R/R HR-MDS)的治疗(GLB-001-01,NCT06146257)。
GLB-001-01是一项首次人体(FIH)、1 期、开放标签、剂量递增和扩展临床研究。该研究的剂量递增部分(1a期)将评估口服GLB-001的安全性、耐受性、PK、PD和初步疗效。大约24名参与者(最多42名参与者)可以参加该研究的1a期。
将遵循剂量扩展部分(1b期)以了解剂量、暴露、毒性、耐受性和临床活性之间的关系,确定最低活性剂量,并为2期研究选择推荐剂量。最多24名参与者(每个剂量水平12名参与者)可以参加该研究的1b阶段。
GLB-002是由格博生物研发的一款靶向IKZF1/3的分子胶蛋白降解剂,于2023年10月7日获得NMPA批准在非霍奇金淋巴瘤(NHL)及多发性骨髓瘤(MM)等血液肿瘤中开展临床试验(GLB-002-01,NCT06219356)。
小结
分子胶是一类备受关注的小分子药物类型,获批上市的分子胶药物中来那度胺销售额2021年全球销售额达到峰值128.9亿美元,2005-2023年累计销售额高达近900亿美元。这一巨大市场吸引国内外药企纷纷布局,分子胶井喷期即将到来。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 638
638

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 647
647

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 616
616