 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-18
2025-06-18
 1051
1051
Umabs DB作为目前全球最全面的抗体药物专业数据库,收录全球近10000个从临床前到商业化阶段抗体药物,涉及靶点1600+,涉及疾病种类2400+,研发机构2900+,覆盖药物蛋白序列、专利和临床等多种专业信息。Umabs DB药物数据库已正式开放上线,可访问www.umabs.com注册享受7天免费试用。
2025年6月17日,根据CDE官网显示,泽璟生物一项DLL-3/CD3双抗药物ZG006,联合PD-1/TIGIT双抗药物ZG005,在晚期小细胞肺癌或神经内分泌癌中的临床试验申请获得批准,推测为一线治疗的探索。
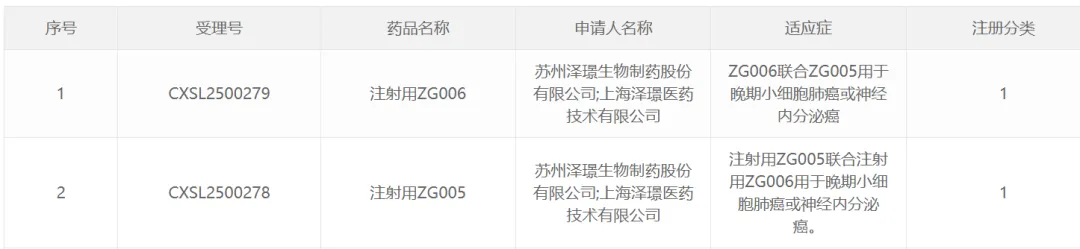
本次ASCO会议上,泽璟制药自主研发的新药DLL-3/CD3双抗Alveltamig(ZG006)、PD-1/TIGIT双抗Nilvanstomig(ZG005)的临床研究数据及最新进展进行了发布。DLL-3/CD3双抗Alveltamig(ZG006)为双表位DLL-3/CD3双抗,采用非对称结构设计。
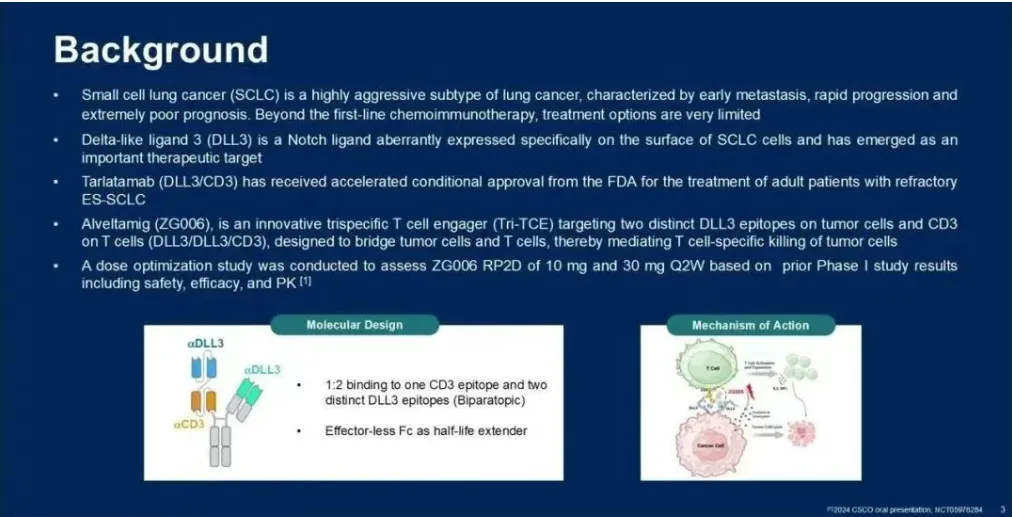
本次ASCO会议期间一项ZG006作为单药治疗SCLC患者的随机、多中心、开放标签II期研究进行结果汇报,这些患者此前至少接受过两线标准全身治疗失败。
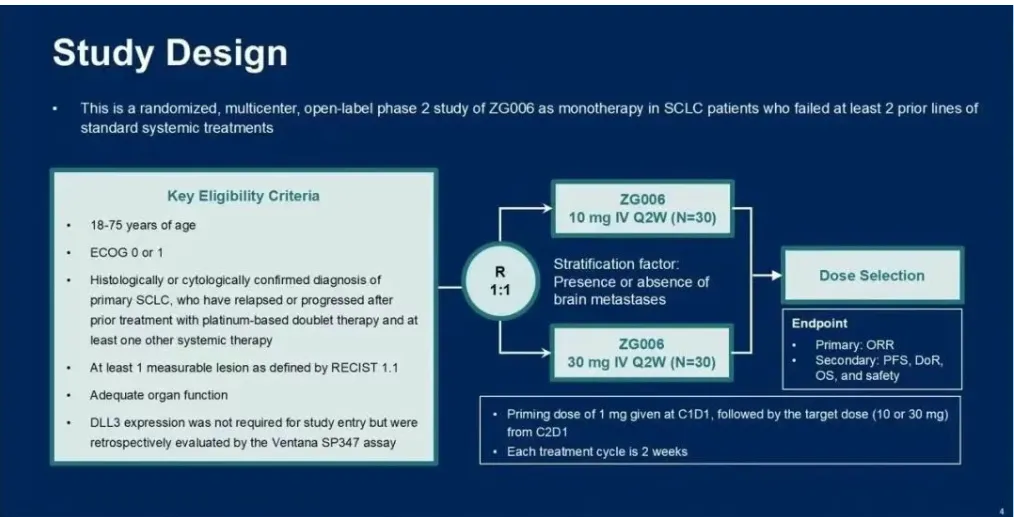
根据ZG006 I期研究结果,本II期剂量优化研究正在评估10 mg和30 mg 每两周一次 的ZG006剂量水平,起始剂量均为1
mg。将有60名患者以1:1的比例随机分组接受ZG006治疗。主要终点是根据RECIST1.1评估的客观缓解率(ORR)。研究不强制要求DLL3表达,但会通过免疫组化(IHC)进行回顾性评估。
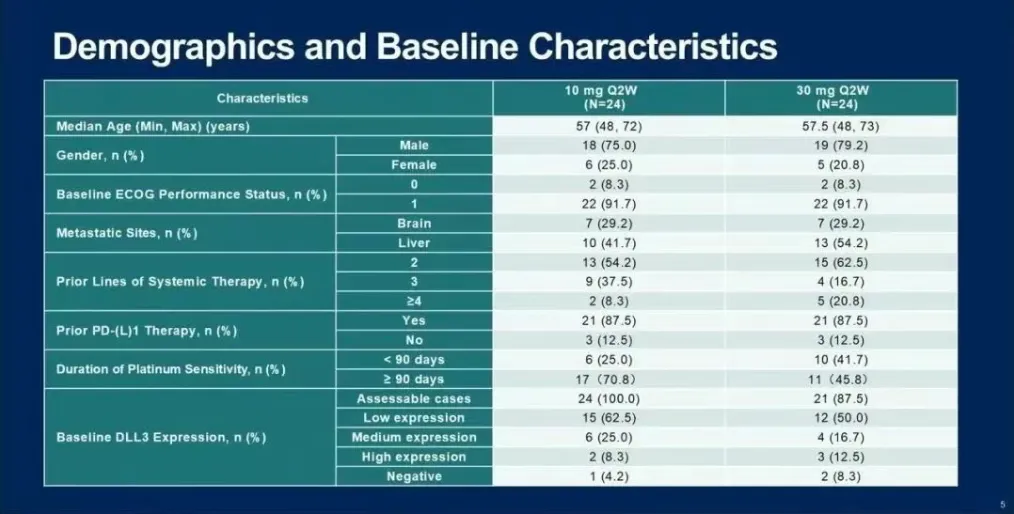
截至2024年12月31日,共有40名SCLC患者被随机分组(10 mg组19人,30 mg组21人),并接受了至少一剂ZG006。在27名(10
mg组13名,30 mg组14名)至少进行了一次基线后肿瘤扫描的SCLC可评估疗效患者中,18名患者获得了部分缓解(7名在10 mg组,11名在30
mg组),其中5名已确认,其余待确认。总体而言,ORR为66.7%,DCR为92.6%。10 mg组的ORR为53.8%,DCR为84.6%。
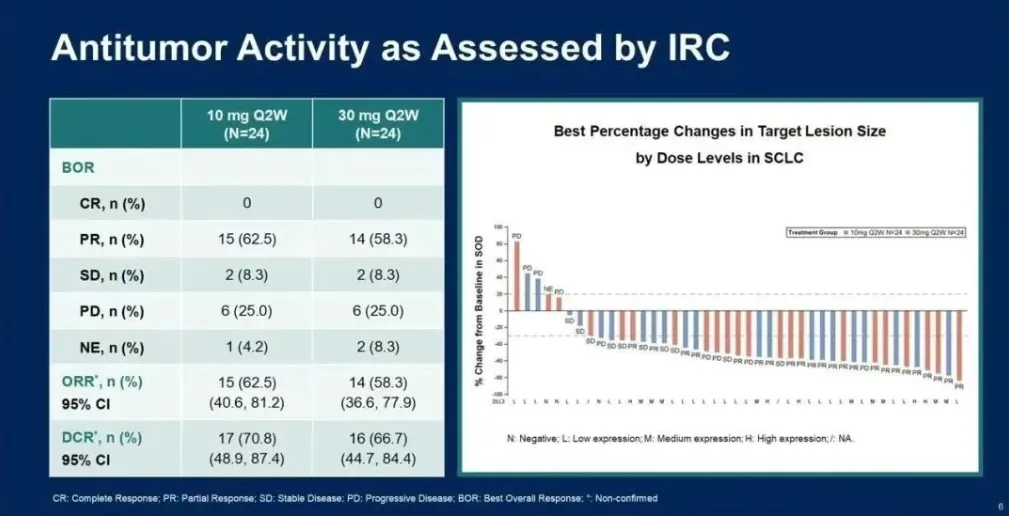
30
mg组的ORR为78.6%,DCR为100.0%。缓解持续时间(DoR)和无进展生存期(PFS)尚未成熟,将在后续随访中更新。在所有27名患者中,21名(77.8%)患者基线时DLL3表达为低(N=17)或中(N=4),他们表现出相当不错的抗肿瘤疗效,有15例PR,ORR为71.4%。
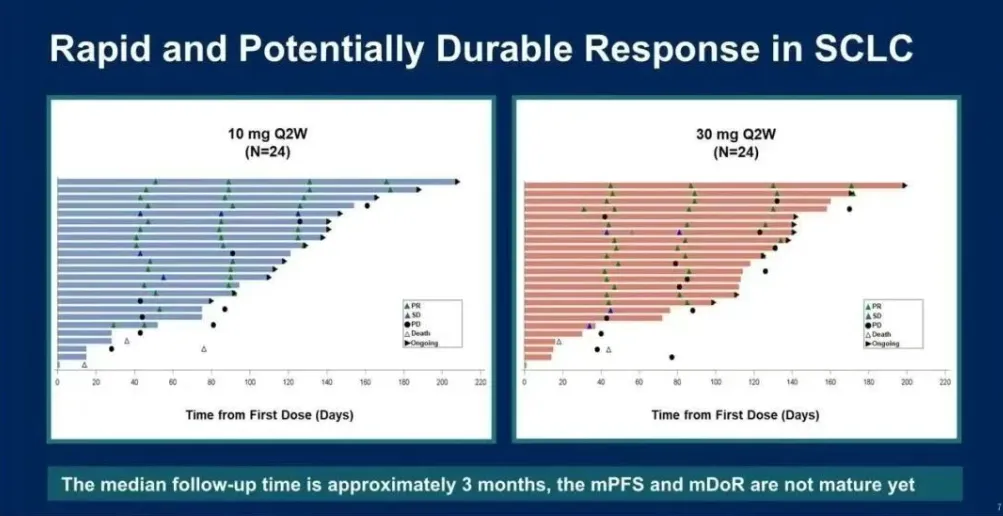
治疗相关不良事件(TRAEs)发生在35名患者(87.5%)中;最常见(≥20%)的TRAEs包括:发热(57.5%)、细胞因子释放综合征(CRS,47.5%)、呕吐(27.5%)、皮疹(25.0%)、食欲下降(25.0%)、天冬氨酸转氨酶升高(22.5%)、白细胞计数下降(22.5%)和血小板计数下降(22.5%)。
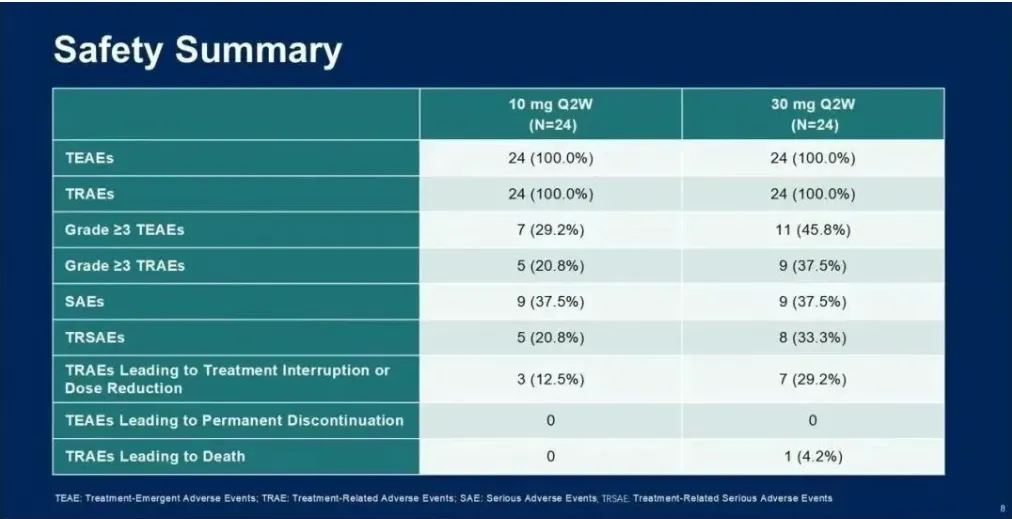
只有5名患者(12.5%)经历了3/4级TRAEs,包括1例3级CRS,并且没有患者因TRAEs导致治疗中断或死亡。5名患者(12.5%)经历了严重TRAEs。在两个剂量组之间未观察到安全性方面的显著差异。
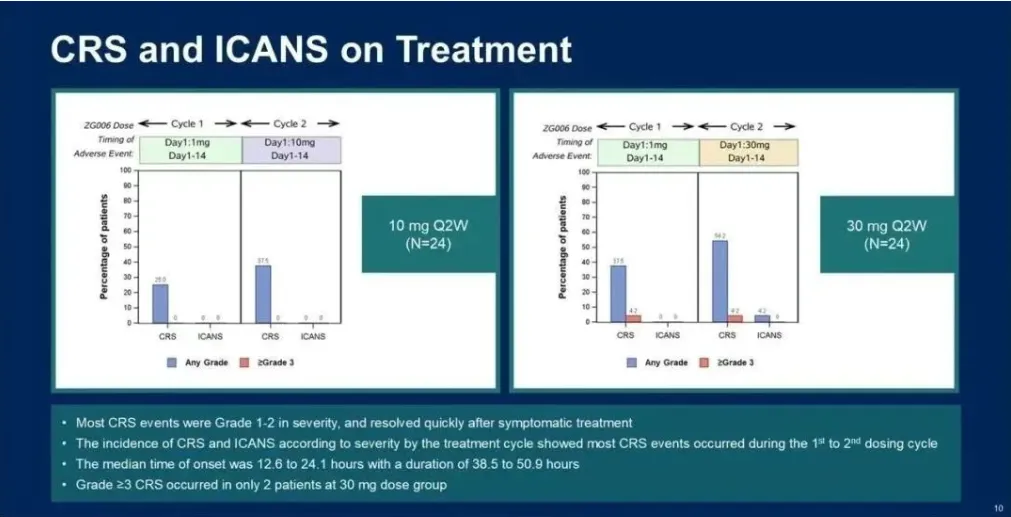
整体来看,在安进的DLL-3/CD3双抗Tarlatamab确立小细胞肺癌的二线治疗地位背景下(二线大胜:安进启动DLL-3/CD3双抗第2项小细胞肺癌一线三期临床),泽璟的Alveltamig(ZG006)基于差异化的设计,在有效性和安全性均表现出更佳的数据,未来具有超越Tarlatamab的潜力。
此外本次ASCO会议中,泽璟也介绍了PD-1/TIGIT双抗Nilvanstomig(ZG005)联合依托泊苷及顺铂在晚期神经内分泌癌患者中的安全性、药代动力学特征及初步疗效的I/II期临床研究(ZG005-004)数据及最新进展。
截至2025年1月10日,共纳入21例患者。所有患者Ki-67指数均≥55%,66.7%的患者存在肝转移。最常见的原发肿瘤部位为胃肠道,占38.1%。中位治疗周期为4个周期(2-4个周期)。
有效性方面,在12例可评估疗效的患者中,6例部分缓解(PR)(其中4例为确认的PR),其中2例接受ZG005 10 mg/kg + EP方案,4例接受ZG005 20 mg/kg + EP方案;另有5例患者病情稳定(SD)。ORR为50%,DCR为91.7%。
安全性方面,在Part 1剂量递增阶段未观察到剂量限制性毒性(DLT)。最常见的TRAE包括贫血、白细胞计数减少、中性粒细胞计数减少和丙氨酸氨基转移酶升高。3例患者发生≥3级的TRAE。4例患者发生严重不良事件(SAEs),其中仅免疫介导性肠炎 1例与ZG005相关。
综上,在晚期神经内分泌癌的患者中,ZG005联合化疗安全性耐受性良好,显示了良好的疗效,支持其开展进一步的临床研究。显然基于ZG006和ZG005在小细胞肺癌中为代表的神经内分泌癌中初步积极单药数据,未来联合治疗更值得期待。
此前小细胞肺癌的广泛期一线治疗方面,标准疗法一度从最早的顺铂+依托铂苷,过渡到卡铂+依托铂苷,直到2019年多个PD-1/L1抗体药物相继在此领域取得突破,将一线中位PFS提升到5.1~6.9个月,中位OS提升到12.3~19.3个月,突破显著。
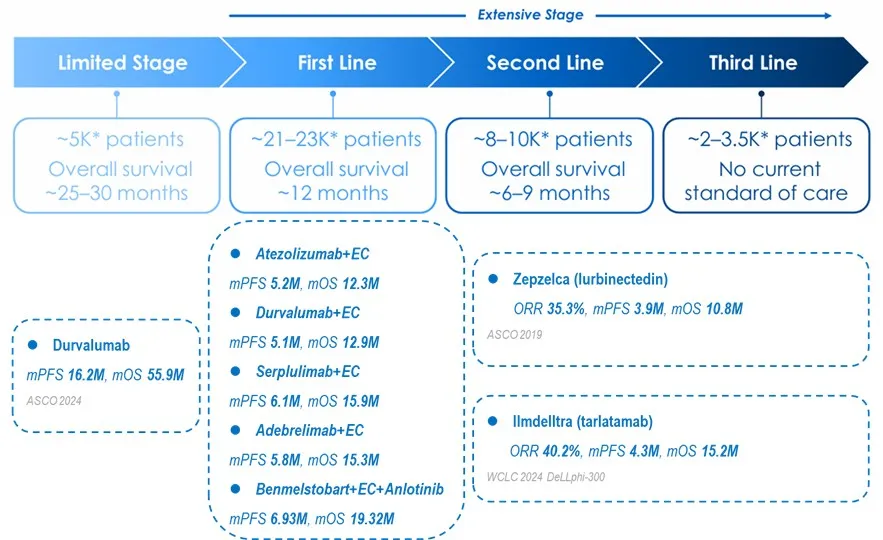
二线治疗方面,此前的拓扑替康仅能让不足30%的患者获益,中位OS仅为8个月作用,同时耐受性差存在较强的血液毒性。近年来批准的lurbinectedin和DLL-3/CD3双抗则将二线治疗的响应率提高到40%,中位生存期提高到10.8~15.2个月。
此次ASCO会议期间,lurbinectedin+Tecentriq联合疗法,以及Tarlatmab分别在小细胞肺癌的一二线治疗改写格局(小细胞肺癌之夜:一线二线治疗相继突破),也迎来了全面加速。
整体上未来小细胞肺癌的治疗将以IO为主的疗法为主,罗氏以lurbinectedin+Tecentriq开发,BioNtech则以PD-L1/VEGF双抗+化疗为主,安进则以Tarlatmab+PD-1为主(二线大胜:安进启动DLL-3/CD3双抗第2项小细胞肺癌一线三期临床),未来肯定还有DLL-3和B7H3+IO的联合疗法探索,但是泽璟的DLL-1/CD3+PD-1/TIGIT双IO联合疗法探索显示是最具差异性的,未来值得期待。

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-11-04
2025-11-04
 33
33

 产业资讯
产业资讯
 深蓝观
深蓝观  2025-11-04
2025-11-04
 32
32

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-11-04
2025-11-04
 27
27