 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-06-18
2025-06-18
 736
736
2025年6月16日,D&D Pharmatech,一家致力于开发突破性肝脏和代谢疾病疗法的临床阶段生物技术公司,宣布了其旨在评估DD01(一款长效GLP-1R/GCGR双重激动剂)在超重/肥胖的代谢功能障碍相关脂肪性肝炎(MASH)患者中的疗效与安全性的II 期DD01-DN-02研究达到了主要终点。
D&D Pharmatech计划在给药48周后继续进行临床试验,以确认是否符合FDA的最终批准要求。基于该机构的主要评估项目结果预计将于明年上半年公布。

该消息发布后,D&D Pharmatech的股票16日上午8点24分盘前交易价为11.82万韩元,较13日收盘价9.77万韩元上涨20.98%。
D&D Pharmatech在美国12个临床试验地点对67名患有超重和肥胖、伴有MASH 的患者进行了这项研究。
DD01-DN-02试验采用每周一次给药方案,以20 mg为起始剂量持续两周,随后进入40 mg维持剂量阶段。在第12周的预计疗效与安全性评估中,研究达到了主要终点,75.8%的受试者肝脏脂肪下降≥30%,而安慰剂组仅为11.8%。研究也达到了其他次要终点:72.7%的受试者肝脏脂肪下降≥50%,57.6%下降≥70%(均p<0.0001);平均肝脏脂肪含量下降62.3%,而安慰剂组仅为8.3%。此外,48.5%的DD01组患者实现肝脏脂肪含量正常化(经磁共振成像-质子密度脂肪分数[MRI-PDFF]测定≤5%),而安慰剂组无患者实现此标准。
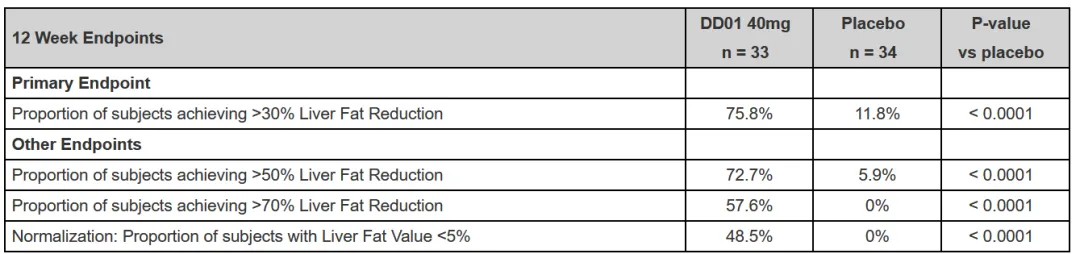
除肝脏脂肪下降外,DD01还在多个无创MASH进展指标上展现出积极疗效,包括肝脏硬度(MRE)、 pro-C3水平和增强型肝纤维化(ELF)评分的显著改善。
12周的减肥数据显示,虽然安慰剂治疗的受试者没有明显的体重减轻,但42.4%的DD01治疗受试者体重减轻了5%以上。HbA1c检测的结果也令人鼓舞,虽然研究人群未被选为糖尿病患者,但在DD01治疗12周后,与安慰剂相比,HbA1c降低具有统计学意义。
安全性数据方面,DD01耐受性良好。胃肠道 (GI) 副作用最为常见,通常为轻度至中度,持续时间较短且可控。迄今为止,仅有3名受试者因胃肠道相关不良事件而停止治疗。
DD01是一款每周一次的GLP-1R/GCGR双重激动剂,在患有T2D和MASLD的肥胖/超重患者中的半衰期为7-8天。在一项1期研究表明DD01可快速减少肝脏脂肪变性,改善葡萄糖耐量。目前的2期结果证实并扩展了这些发现,揭示了MASH患者的额外益处。DD01的作用与其双重激动剂药理学一致。临床结果显示,DD01的疗效显著快速。DD01快速获得稳健的结果,其耐受性与其他经过验证的MASH治疗相当。
D&D Pharmatech 总裁兼首席执行官 Seulki Lee 博士表示: “DD01 在 MASH 患者中仅用 12 周就取得了显著的积极效果。其改善程度与长期使用 FGF 和 GLP-1 类药物治疗所取得的疗效相当,这些药物已在 MASH 患者中通过组织学数据进行了验证。考虑到肝脏和代谢益处以及良好的耐受性,DD01 有可能为患者和医生提供易于管理、促进减肥且适合糖尿病患者的 MASH 治疗。”
Summit&Pinnacle临床研究董事会联席主席,休斯顿研究所所长Mazen Noureddin博士评论道:“DD01的肝脏脂肪减少程度令人震惊,近四分之三的患者在短短12周内至少减少了30%,近一半的患者在12周内达到了正常化。MRE观察到的肝脏僵硬的改善虽然很早,但进一步支持了这种GLP-1/GCG双重激动剂的生物活性,该方法旨在直接作用于肝脏。
这些一致的MRI-PDFF结果为DD01提供了强有力的信心,表明随着该计划的推进,DD01有可能达到两个关键的监管终点——MASH分辨率和纤维化改善。再加上良好的代谢作用和非常低的治疗停药率,DD01正在成为一种分化良好、有前景的治疗方法,无论是在其类别内还是与其他正在开发的强效药物相比。”
总结
多家公司一直在争夺MASH市场的份额,包括Novo Nordisk semaglutide(GLP-1 受体激动剂),Eli Lilly tirzepatide(GIP/GLP-1 双重受体激动剂),以及Boehringer Ingelheim 的 survodutide(GLP-1/胰高血糖素受体双重激动剂)等。
诺和诺德的semaglutide最近在III期ESSENCE试验中取得成功,司美格鲁肽2.4mg可使62.9%的中重度MASH患者实现肝炎缓解且无纤维化恶化(对比安慰剂34.3%),同时36.8%的患者纤维化改善,获得了美国FDA对MASH的优先审查权(预计2025年获批)。
2024年6月,礼来公布了tirzepatide用于治疗代谢功能障碍相关脂肪性肝炎(MASH)患者的2期临床试验SYNERGY-NASH达到了主要终点。疗效评估显示,试验达到主要终点,在52周的治疗中,接受5 mg、10 mg、15 mg tirzepatide治疗的患者,分别有51.8%、62.8%和73.3%的患者实现了MASH缓解,且肝纤维化没有恶化,而服用安慰剂的受试者中这一比例为13.2%。当时,礼来在一份新闻公告中警告道,SYNERGY-NASH无法明确证明tirzepatide可以显著改善纤维化。尽管如此,礼来仍在将tirzepatide推向 MASH。
勃林格殷格翰公司的survodutide在去年完成的二期临床试验中,以6毫克剂量连续服用48周,结果显示,在接受Survodutide治疗的患者中,LFC显著降低>30%、>50%和>70%的患者比例分别达到87.0%、78.2%和52.7%,而安慰剂组分别为19.7%、3.0%和0.0%。而DD01在12周内,就有超过70%的患者脂肪肝减少了50%以上。
另外,Hanmi制药也正在推进其GLP-1/GIP/GCG三重激动剂efocipegtrutide用于MASH,该产品目前处于2b期阶段。

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-11-04
2025-11-04
 33
33

 产业资讯
产业资讯
 深蓝观
深蓝观  2025-11-04
2025-11-04
 32
32

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-11-04
2025-11-04
 27
27