 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2025-06-19
2025-06-19
 847
847
6月20日-6月23日,全球规模最大的糖尿病会议——第85届美国糖尿病协会(ADA)大会将在美国芝加哥召开,来自全球各地的药企将在会上展示代谢领域创新药物的临床和临床前研究成果。近日,ADA摘要全文已基本公布。据医药魔方统计,信达生物、恒瑞医药、先为达生物、华东医药等十余家国内药企携研究成果亮相大会。国内药企本次展示的研究成果以GLP-1类药物为主,医药魔方从中挑选表现突出的10项GLP-1临床研究成果进行介绍。
参加ADA 2025的中国企业临床研究成果
药物:玛仕度肽(Mazdutide)
药物类型:多肽GCGR/GLP-1R激动剂
公司:信达生物
全球研发赛道排名:1/6
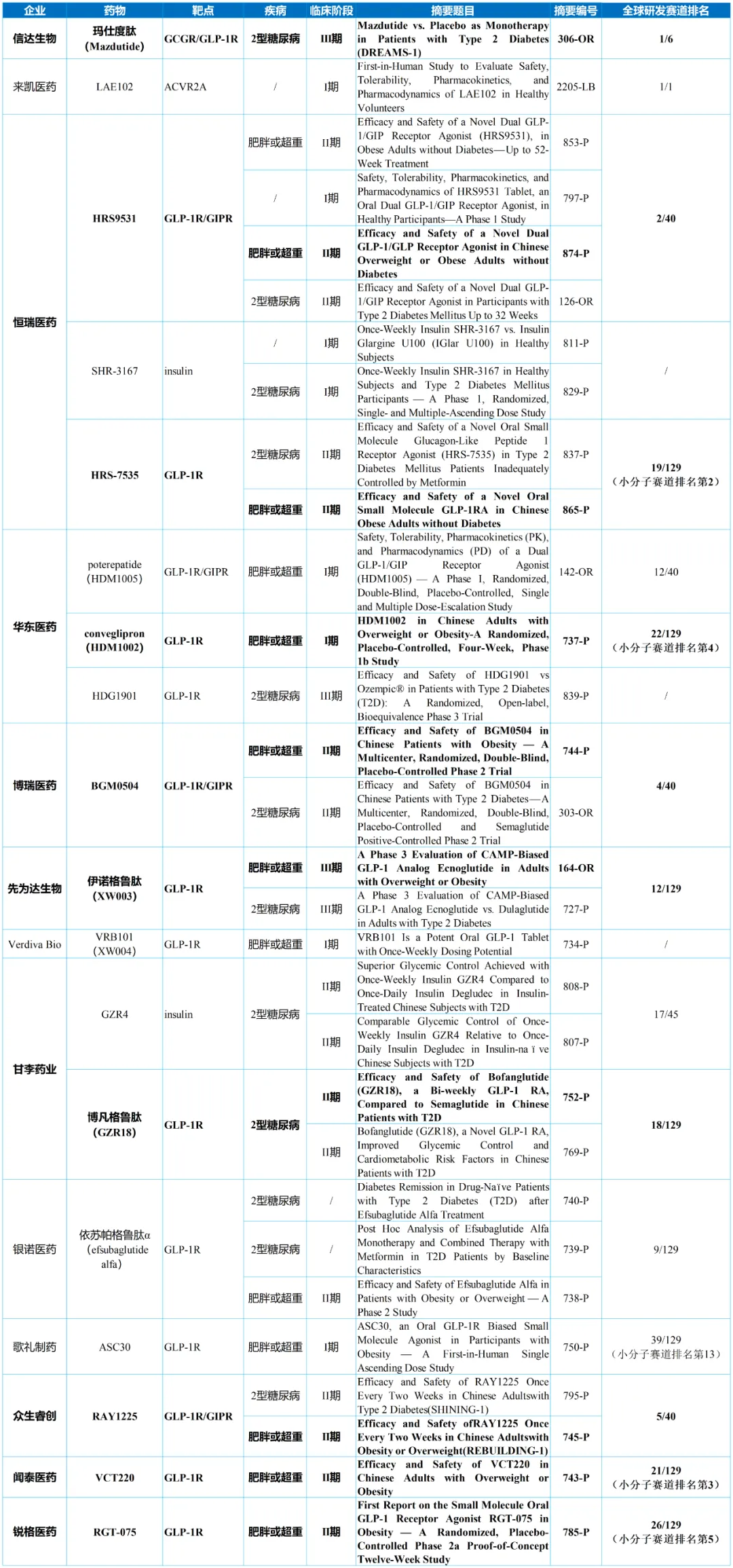
DREAMS-1研究是一项为期24周的随机、双盲、安慰剂对照III期临床试验(n=320),评估了玛仕度肽单药(4mg或6mg)对比安慰剂在单靠饮食和运动控制不佳的2型糖尿病患者中的疗效和安全性。研究的主要终点是治疗第24周时HbA1c水平较基线的平均变化。
基线时,入组患者的平均HbA1c水平为8.24%,平均年龄为50.4岁,平均糖尿病病程为1.9年,平均体重为77.7kg。
结果显示,在第24周,玛仕度肽组在HbA1c水平较基线的平均变化方面显著优于安慰剂组(最小二乘均值治疗差异:玛仕度肽4mg组为−1.43%;玛仕度肽6mg组为−2.02%;两组p值均<0.0001)。在达到HbA1c水平<7.0%、体重降幅≥5%、同时达到HbA1c水平<7.0%且体重降幅≥5%的患者比例,以及第24周体重较基线的平均百分比变化等指标上,玛仕度肽的表现也显著优于安慰剂。
安全性方面,最常见的不良事件是胃肠道反应,且大多为轻度至中度。未报告严重低血糖事件。
药物:HRS9531
药物类型:多肽GIPR/GLP-1R激动剂
公司:恒瑞医药
全球研发赛道排名:2/40
本研究是一项随机、双盲、安慰剂对照II期临床试验(n=61),评估了HRS9531(8.0mg,n=49)对比安慰剂(n=12)在不伴糖尿病但至少伴有一种体重相关合并症的超重或肥胖(BMI:28.0-40.0kg/m²或24.0-28.0kg/m²)中国成人受试者中的有效性和安全性。研究的主要终点是从基线至第36周时体重的百分比变化。
两组患者的基线特征总体相当。患者的平均基线体重为84.6kg,平均基线BMI为31.3kg/m²。
在第36周时,与安慰剂组相比,HRS9531组体重相对于基线的百分比变化的最小二乘均值差为-21.1%(95% CI: -25.6%~-16.6%;P<0.0001)。HRS9531组体重降幅≥5%、≥10%、≥15%、≥20%和≥25%的受试者比例分别为93.9%、91.8%、87.8%、59.2%和30.6%,而安慰剂组中相应的比例分别为16.7%、8.3%、0%、0%和0%。
此外,与安慰剂组相比,在第36周时,HRS9531组改善了腰围、BMI、收缩压、空腹血糖、空腹血清胰岛素、HbA1c水平,并降低了甘油三酯水平。
安全性方面,大多数治疗期间不良事件(TEAE)为轻度且与胃肠道相关,最常见的是腹泻、恶心和呕吐。没有受试者因TEAE而永久性停止治疗。
药物:HRS-7535
药物类型:口服小分子GLP-1R激动剂
公司:恒瑞医药
全球研发赛道排名:19/129(小分子赛道排名:2/59)
该研究是一项为期36周的多中心、随机、双盲、安慰剂对照临床试验(n=235),评估了HRS-7535(30/60/120/180mg,每日1次)在不伴糖尿病的肥胖或超重(BMI:28-40kg/m2)受试者中的安全性和有效性。研究的主要终点是治疗第26周(核心治疗期)时受试者的体重相对于基线的百分比变化。
基线时,受试者的平均BMI为32.5kg/m2,平均体重为91.6kg,女性占比48.5%,男性占比51.5%。
结果显示,治疗第26周,30mg、60mg、120mg、180mg HRS-7535剂量组、安慰剂组受试者的体重降幅分别为-2.99%、-7.17%、-6.17%、-9.36%、-2.50%;经安慰剂组校正后,30mg、60mg、120mg、180mg HRS-7535剂量组受试者的体重降幅为-0.49%(p=0.7091)、-4.67%(p=0.0005)、-3.67%(p=0.0061)、-6.87%(p<0.0001)。
治疗第36周,180mg HRS-7535剂量组受试者的体重降幅为-9.50%,安慰剂组降幅为-1.40%。此外,180mg HRS-7535剂量组有35.4%的受试者体重至少降低10%,安慰剂组这一比例为6.5%。
安全性方面,HRS-7535组和安慰剂组发生TEAE的比例分别为87.2%-95.8%和87.0%。HRS-7535组最常见的TEAE为胃肠道事件,包括恶心(16.7%-54.2%)、腹泻(16.7%-21.7%)、呕吐(15.7%-37.5%),严重程度多为轻度至中度,滴定时发生频率较高。未观察到肝酶升高的趋势。HRS-7535组有5例(2.1%)受试者因TEAE停药。
药物:conveglipron(HDM1002)
药物类型:口服小分子GLP-1R激动剂
公司:华东医药
全球研发赛道排名:22/129(小分子赛道排名:4/59)
本研究是一项双盲、安慰剂对照、多剂量递增Ib期研究(n=60),旨在评估HDM1002在不伴糖尿病的超重或肥胖(BMI:24.0-36.0kg/m²)中国成人受试者中的安全性、耐受性、药代动力学(PK)以及体重减轻效果。
在这项研究中,受试者按5:1的比例随机分配至HDM1002(50/100/200/400mg,每日1次或100mg,每日2次)或安慰剂组接受为期4周的治疗。除50mg剂量组外,所有队列均进行了剂量滴定。各队列平均体重范围为74.1-90.8kg,共58例受试者完成了4周治疗。
多次给药后,在50-400mg(每日1次)剂量范围内,最大血药浓度(Cmax)呈剂量依赖性增加,而药时曲线下面积(AUC)的增加略高于剂量比例(Cmax的β值95% CI为0.772-1.266,AUC0-24h的β值95% CI为1.124-1.587)。在28天的治疗期内,较高剂量下观察到轻微的药物蓄积。
在治疗第29天观察到剂量依赖性的体重减轻。在200mg及以上剂量组中,平均体重变化范围为-4.3kg~-6.1kg,百分比变化范围为-4.9%~-6.8%。
最常见的TEAE为胃肠道相关的恶心(54.0%)和呕吐(30.0%)。所有TEAE均为轻度至中度。无死亡或严重不良事件发生。两名受试者因TEAE(呕吐和代谢性酸中毒)中止治疗,4例受试者因TEAE而降低剂量。
药物:BGM0504
药物类型:多肽GLP-1R/GIPR激动剂
公司:博瑞医药
全球研发赛道排名:4/40
该研究是一项随机、双盲、安慰剂对照临床试验(n=120),评估了BGM0504(5/10/15mg,每周1次)在不伴糖尿病的中国肥胖人群中的安全性和有效性。
结果显示,从基线到第24周,5mg、10mg、15mg BGM0504剂量组受试者的体重较基线平均降幅(扣除安慰剂)分别为-10.77%(-10.2kg)、-16.21%(-15.5kg)、-19.78%(-20.1kg),腰围较基线减少8.00-12.98cm(扣除安慰剂,p<0.001)。所有剂量组达到体重较基线降低≥5%、≥10%和≥15%的受试者比例均显著高于安慰剂组(p<0.001),并且10mg和15mg剂量组达到体重较基线降低≥20%的受试者比例亦高于安慰剂组(p<0.05)。此外,所有剂量组受试者的收缩压较基线平均降幅(扣除安慰剂)为-11.60~-13.03mmHg,舒张压较基线平均降幅(扣除安慰剂)为-5.98~-7.50mmHg(p<0.05)。
药物:伊诺格鲁肽(XW003)
药物类型:多肽GLP-1R激动剂
公司:先为达生物
全球研发赛道排名:12/129
该研究是一项随机、双盲、安慰剂对照临床试验(n=664),评估了伊诺格鲁肽(1.2/1.8/2.4mg,每周1次)在中国超重或肥胖人群中的安全性和有效性。基线时,受试者的平均体重为91.3kg,平均BMI为32.5kg/m²。
结果显示,从基线到第48周,1.2mg、1.8mg、2.4mg伊诺格鲁肽剂量组受试者的体重较基线平均降幅为-9.90%~-15.4%,安慰剂组为-0.3%(p<0.0001);伊诺格鲁肽组受试者体重较基线降低≥5%、≥10%和≥15%的受试者比例分别为77.7%~92.8%、51.2%~79.6%、63.5%。此外,伊诺格鲁肽组受试者的心脏代谢指标也实现了改善,包括血脂水平和肝脏脂肪含量。
在该研究中,伊诺格鲁肽具有良好的安全性和耐受性。伊诺格鲁肽组报告的不良事件(AE)发生率为92.8%~93.4%,安慰剂组为84.2%。伊诺格鲁肽组有10例(2.0%)受试者因AE停药,有5例(1.0%)受试者报告了与治疗相关的严重AE。最常见的AE是食欲下降、腹泻、恶心和呕吐,这些症状的严重程度大多为轻度至中度并且是短暂性的。
药物:博凡格鲁肽(GZR18)
药物类型:多肽GLP-1R激动剂
公司:甘李药业
全球研发赛道排名:18/129
该研究是一项多中心、随机、开放标签、阳性药物对照临床试验(n=272),评估了博凡格鲁肽(12/18/24mg,每2周1次)对比司美格鲁肽(1mg,每周1次)在未接受过药物治疗或接受稳定口服降糖药治疗的中国2型糖尿病患者中的降糖效果和安全性。
结果显示,治疗第24周,博凡格鲁肽组患者的糖化血红蛋白(HbA1c)水平降幅优于司美格鲁肽组,其中18mg剂量组(-2.28% vs -1.60%)和24mg剂量组(-1.94% vs -1.60%)降糖优势更加显著。在其它次要疗效指标上,博凡格鲁肽的表现也超过了司美格鲁肽。
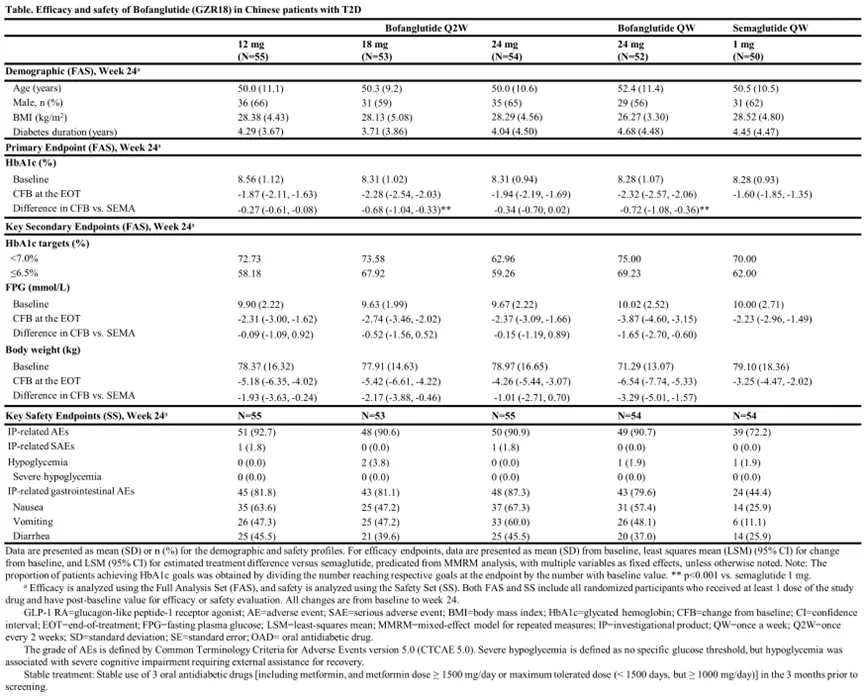
最常见的TEAE是1-2级胃肠道反应。没有3级或更高级别的AE发生,也没有与博凡格鲁肽相关的严重低血糖事件发生。
药物:RAY1225
药物类型:多肽GLP-1R/GIPR激动剂
公司:众生睿创
全球研发赛道排名:5/40
本次公布的II期研究(REBUILDING-1)旨在评估每2周1次的RAY1225在不伴糖尿病的超重或肥胖中国成人受试者中的疗效、安全性和耐受性。
目前共分析了来自A部分(目标剂量为3mg、6mg)和B部分(目标剂量为9mg及以上)的132例受试者。治疗第24周,3mg、6mg、9mg剂量组受试者体重的平均百分比变化分别为-10.06%、-12.97%、-13.05%,安慰剂组为-3.62%(p<0.001)。与安慰剂组(30.0%)相比,RAY1225组中约73.2%~95.1%的受试者实现了体重降幅≥5%(p<0.05)。此外,RAY1225对心血管代谢指标的改善也有益处,且安全性良好。
药物:VCT220
药物类型:口服小分子GLP-1R激动剂
公司:闻泰医药
全球研发赛道排名:21/129(小分子赛道排名:3/59)
该研究是一项为期16周的随机、双盲II期临床试验(n=250),旨在评估VCT220(80/120/160mg,每日1次)在不伴糖尿病但至少伴有一种体重相关合并症的超重或肥胖(BMI:24-28kg/m²或≥28kg/m²)中国成人受试者中的疗效、安全性和耐受性。
基线时,入组受试者的平均体重为91.76kg,平均BMI为32.03kg/m²,93.6%的受试者BMI≥28kg/m²。
结果显示,第16周时,与安慰剂相比,VCT220所有剂量组在体重的平均百分比变化、实现体重降幅≥5%或体重降幅≥10%目标的受试者比例均显著更高,同时改善包括血压和腰围在内的心血管风险因素。
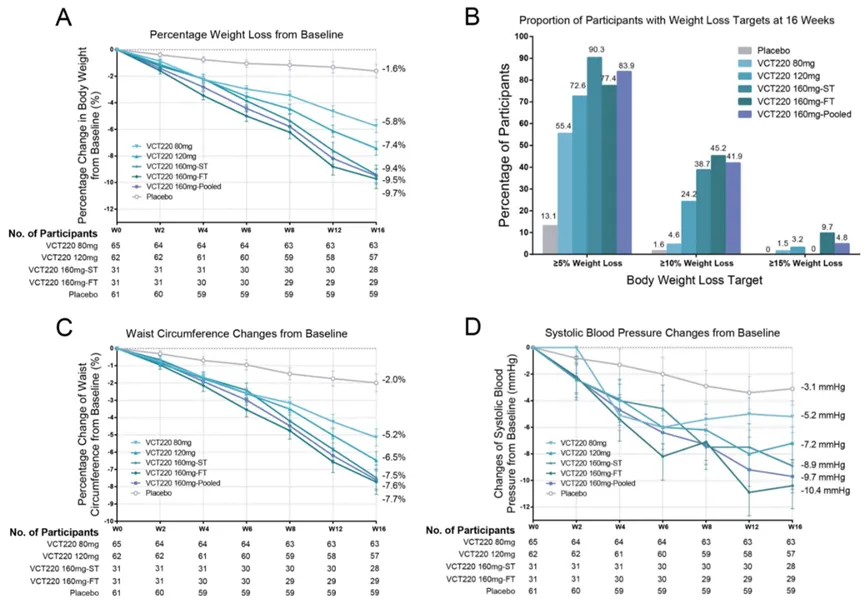
最常报告的不良事件(AE)为胃肠道相关,且大多为轻至中度,98.0%的受试者显示出良好的依从性。没有受试者发生与药物相关的严重AE。
药物:RGT-075
药物类型:口服小分子GLP-1R激动剂
公司:锐格医药
全球研发赛道排名:26/129(小分子赛道排名:5/59)
该研究是一项为期12周的随机、双盲IIa期临床试验(n=73),评估了RGT-075(125mg,每日1次,n=50)对比安慰剂(n=23)在不伴糖尿病但至少伴有一种体重相关合并症的超重(BMI≥27kg/m²)或肥胖(BMI≥30kg/m²)成人受试者中的疗效和安全性。
基线时,受试者的平均年龄为50.2岁,平均体重为102.5kg,平均BMI为37.1kg/m²。
结果显示,第12周时,RGT-075组体重的最小二乘值平均百分比变化为-5.4%,而安慰剂组为-0.45%(p<0.0001)。此外,观察到收缩压(经安慰剂组调整后,-10.8mmHg,p=0.0022)和舒张压(经安慰剂组调整后,-4.9mmHg,p=0.0371)下降显著且具有临床意义,心率未见增加。
安全性方面,RGT-075组最常见的AE是恶心(40%)和呕吐(24%),且均为轻度或中度。未观察到肝脏异常情况以及与RGT-075相关的严重AE。两组因AE停药的比例均为4%。

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-11-04
2025-11-04
 15
15

 产业资讯
产业资讯
 深蓝观
深蓝观  2025-11-04
2025-11-04
 13
13

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-11-04
2025-11-04
 14
14