 产业资讯
产业资讯
 建国路128号
建国路128号  2025-06-21
2025-06-21
 944
944
2025ASCO,信达报告了其PD-1/IL-2(α-bias)双特异性抗体融合蛋白IBI363在结直肠癌、黑色素瘤和晚期非小细胞肺癌的临床1期数据,是ASCO年会上研究最为全面的 PD-1/IL-2 靶向治疗,临床数据大超预期,引发了投资界、产业界和学术界的广泛关注。
此前,这个领域一系列的失败让大家已经对PD-1/IL2联用的治疗方式信心低迷,但IBI363亮眼的临床数据,让大家看到了二代IO、尤其是PD-1/IL2的新希望。
其实,PD-1 plus一直是非常关注和火热的方向。
比如最近,辉瑞公司向三生制药支付12.5亿美元的预付款,以获得PD-1/VEGF双特异性抗体SSGJ-707在中国以外的权利,包括里程碑付款在内的交易总价值达到60.5亿美元。默克紧随向LaNova支付5.88亿美元的预付款,以获得另一种PD-1/VEGF双特异性抗体LM-299 ,潜在总价值可达33亿美元。
BioNTech 以 8 亿美元预付款(总额高达 9.5 亿美元)收购 Biotheus,从而获得 PD-L1/VEGF-A 双特异性抗体 BNT327/PM8002 的完全控制权。
Summit Therapeutics 额外花费 7000 万美元扩大了其 ivonescimab 的地域许可,同时筹集 2 亿美元资金支持开发。康方生物与 Summit 于 2022 年达成的原始许可协议涉及 5 亿美元的预付款,总潜在价值为 50 亿美元。
-01-
PD-1 plus的机制
PD-1是普遍存在于活化的T细胞、B细胞、单核细胞及其他免疫细胞的跨膜蛋白。它能和配体PD-L1或者PD- L2结合,负向的调节人体免疫反应。也就是,当免疫细胞过于兴奋时,PD-1会和PD-L1握握手,一起让免疫细胞冷静下来。
在肿瘤发生中,肿瘤浸润淋巴细胞(TILs)识别癌细胞,T细胞通过TCR(T细胞受体)识别癌细胞表面的MHC-肽复合物,激活的T细胞开始释放IFN-γ,以调节其他免疫细胞,并起到杀伤癌细胞的作用。但是,聪明的癌细胞也进化出了一套免疫逃逸的方式,利用T细胞释放的IFN-γ激活癌细胞内的STAT3信号通路,从而大量表达PD-L1。
正常生理条件下,PD-1/PD-L1的作用是抑制自身免疫,或者预防自身免疫疾病的发生,也就是防止免疫细胞太兴奋 ,造成对友军的误伤。但癌细胞也利用了这一点,也让自己大量表达PD-L1,假装成正经友军,去提醒免疫细胞:你太兴奋了,要冷静一下。如此一来,T细胞的增殖变慢,细胞因子分泌变少,进入耗竭状态,这样,癌细胞就躲过了免疫细胞的杀伤。
而靶向PD1治疗呢,就是利用PD1抑制剂,提前把PD-1堵住,这样用PD-L1伪装自己的肿瘤细胞就不能和免疫细胞的PD1结合,继续伪装成友军了,T细胞也可以不被抑制。那么T细胞就可以杀伤肿瘤了。
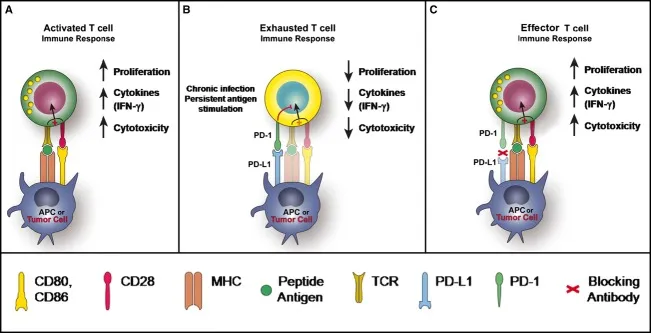
PD-1能开启免疫治疗时代,是因为它证明了靠激活免疫细胞功能来达到杀伤肿瘤的设想是有效的,也确实对一些恶性肿瘤起到了很好的治疗效果。
对黑色素瘤,一线ORR是30%~40%左右,二线ORR在25%左右。在非小细胞肺癌上,对于PD-L1高表达(≥50%)的患者,ORR约为45%。且该靶点在肾细胞、头颈癌HNSCC,尿路上皮癌、霍奇金淋巴瘤、胃癌、肝癌等14+个适应症上获批。
但是,随着临床经验的积累,主要适应症的疗效上限逐渐显现,PD-1单药的局限性也慢慢凸显。根据2021年统计数据,整体来说PD-1抗体仅有20-24%的缓解率,40-65%的原发性耐药率,14%的严重副作用。且由于PD-1治疗对PD-L1阳性患者有用,大多数PD-L1阴性患者并未能获益。
为了改善这些问题,科学家想到了和其他免疫检查点或者免疫激活点的联合治疗,比如同时block其他的免疫检查点(如TIM3,TAG-3,TIGIT等),或者刺激共刺激分子(4-1BB、OX40、CD27或者CD40),激活T细胞(IL2,IL15)等等。
-02-
IL-2的协同机制
IL-L2也是一直备受关注的免疫激动剂。
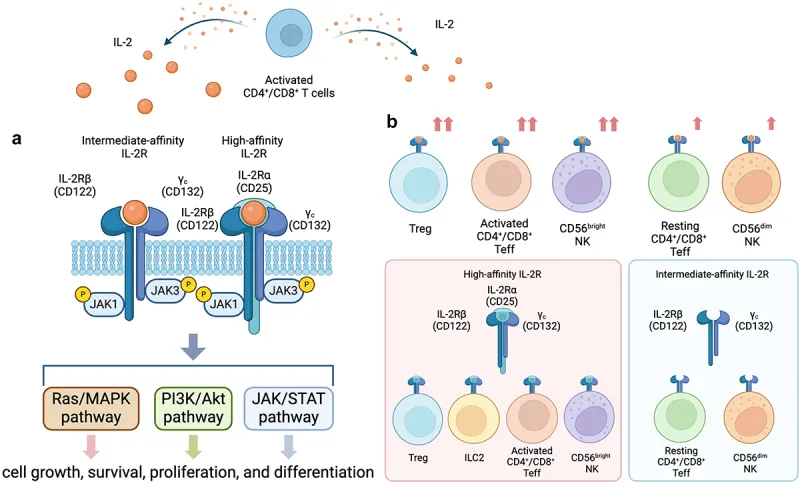
作为一个只有15 kD的细胞因子,IL-2对免疫细胞的多种信号通路和生理功能产生影响。当IL-2剂量比较低时,优先和三聚体IL-2R (IL-2 Receptor)结合。三聚体IL-2R由 IL-2Rα (CD25), IL-2Rβ (CD122)和一个通用的γ链组成,对IL-2有更高的亲和力,比二聚体IL-2R高10-100倍,主要表达在Treg表面(免疫抑制调节性T细胞 )。
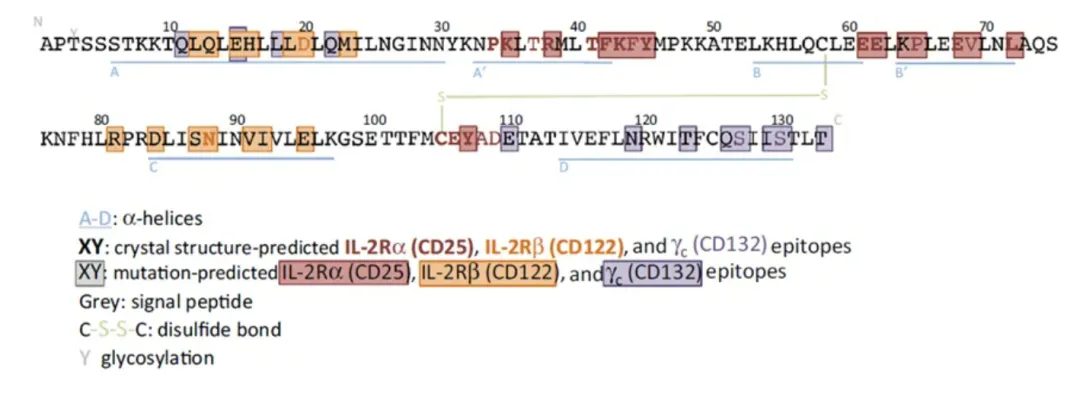
当IL-2剂量高时,这些细胞上的三聚体IL-2R的饱和,IL-2则会和二聚体IL-2R结合并激活响应信号通路。二聚体IL-2R由IL-2Rβ
(CD122)和通用的γ链组成,主要表达在Teff(静息的记忆效应T细胞)和NK细胞上。
IL-2可以诱导免疫细胞增殖和激活,但具有双向效应:它既能结合IL-2Rβγ二聚体,诱导T细胞增殖并杀死癌细胞,也能结合IL-2Rαβγ三聚体,激活Treg细胞增殖产生免疫抑制作用。
重组IL2分别于 1992 年和 1998 年成为FDA批准的第一个用于治疗转移性肾细胞癌 (RCC)
和转移性黑色素瘤的免疫疗法。但是,IL2的体内半衰期很短,只有几分钟,需要高剂量频繁使用。但高剂量IL-2毒性很强,产生了大量不良反应,这些都限制了IL-2的疗效和适应症扩展。IL2疗法已经退居二线。
随着研究的深入,科学家发现PD-1抗体与IL2是协同作用。PD-1导致CD8T细胞IL2生产减少,且负向干扰了γ链受体信号。而PD-1抗体可以重启IL2的生产,恢复T细胞的增殖,且治疗效果高度依赖于IL2的信号传导。
一个疗法只对PD-L1高表达的癌细胞有效,且容易产生耐药性。一个受限于过强的毒性和脱靶效应(无差别攻击),科学家们就想到了两者结合的联合治疗。
根据IL-2设计的分子形式不同,MOA有些许的差别。但是总体而言,通过阻断PD-1/PD-L1信号通路,解除T细胞抑制状态,恢复TIL的细胞活性,同时,通过IL-2刺激效应T细胞的激活、增殖和分化,两者结合,达到更好的治疗效果。
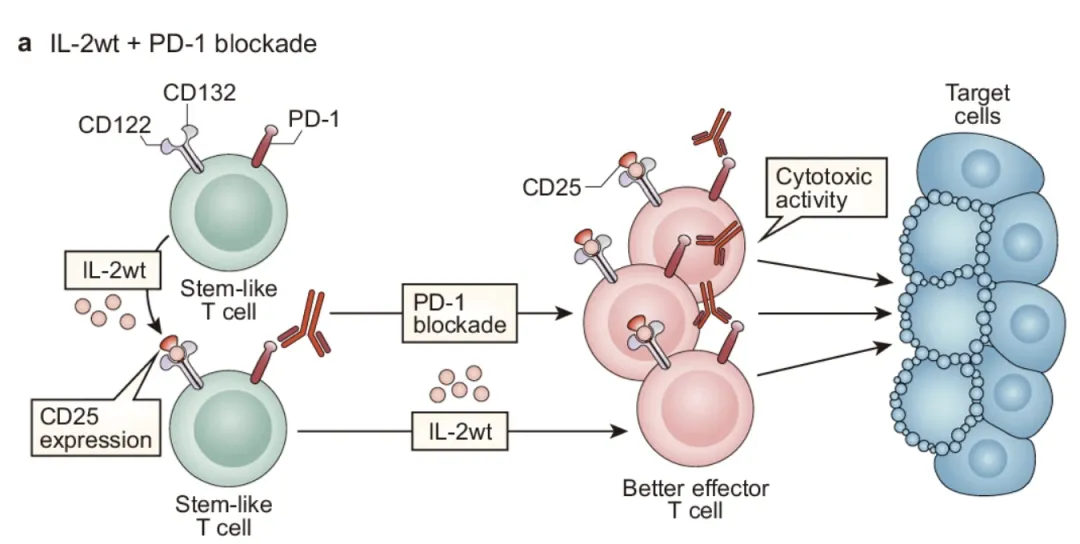
由于IL2能结合IL-2Rαβγ三聚体,激活Treg细胞增殖产生免疫抑制作用。早期IL2的主流设计是希望和中等亲和力的IL-2Rbeita/gamma结合,而不和高强度的三聚体IL-2R结合,从而希望IL2既能激活CD8T的扩增,而不激活Treg的扩增。
-03-
PD-1/IL2的竞争格局
1)BMS、赛诺菲:早鸟折翼
最早尝试的是BMS,2018年BMS斥资36亿美元获得Nektar的IL-2受体激动剂NKTR-214部分权益,并将其与BMS公司的Opdivo、Opdivo+Yervoy联用,用于9种肿瘤类型的20多个适应症上。
NKTR-214的设计也是早期公司们采用的IL2主流设计方式,利用PEG去block IL2和IL-2Rα的结合,如图,绿色是IL2,深蓝色是IL2Rα,淡蓝色是IL2Rβ,粉色是γc。PEG连接在IL2与IL2Rα结合的活性位点上,从而阻挡他们的结合。
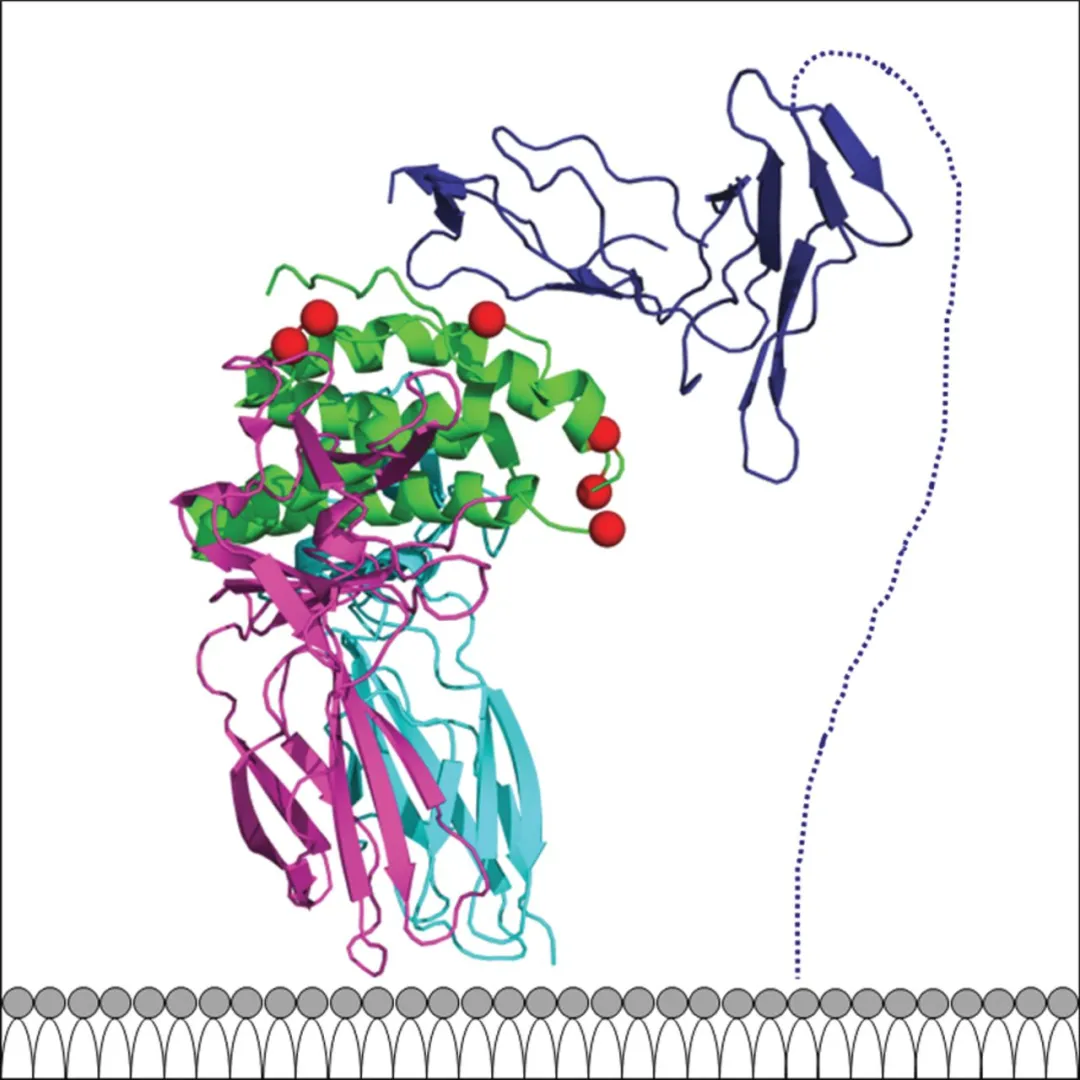
起初,NKTR-214是无活性的前体药物,进入体内的酸性环境后,PEG逐渐释放,暴露出IL2的活性位点,当PEG解离只有2个链时,IL2可以与IL-2Rβ和IL-2Rγ
结合,优先与CD8
T和NK上的二聚体结合,激活CD8和NK的扩增,而当PEG继续解离成一条链或者没有时,才会与Treg上的三聚体IL2R结合,从而实现优先扩增CD8T和NK的效果。
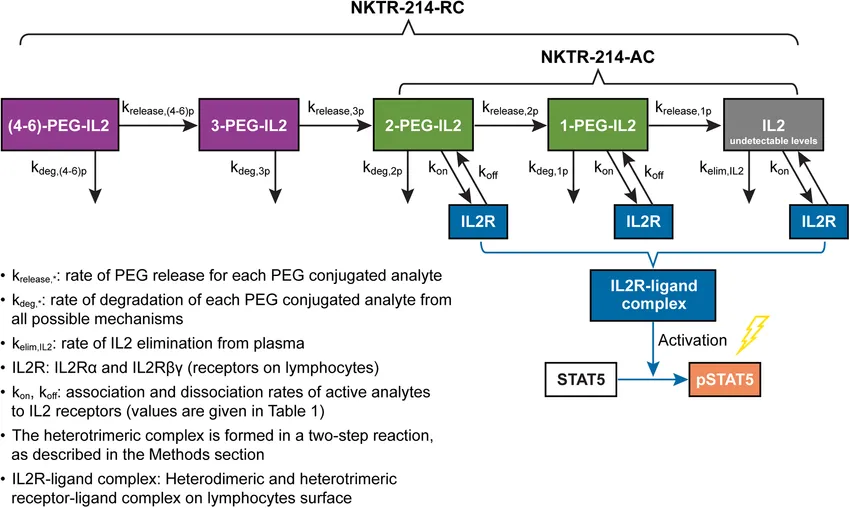
这是一个复杂的过程,虽然在临床前进行了一系列动力学的模拟和表征,证明这个复杂的设想是可被实现的。在早期与O药的组合疗法也取得了积极的结果,在2019年获得了FDA的突破性疗法认定,用于初次治疗无法切除或转移性黑色素瘤患者。
该联合治疗的适应症也扩展到了肾细胞癌和非小细胞肺癌等多种实体瘤。
在一期临床中,NKTR-214单药临床1期数据并不好,和PR均为0,但与“O药”联用后的数据比较惊艳,黑色素瘤的ORR为63.6%,针对肾细胞癌的ORR为71.4%,特别是非小细胞肺癌上,4例非小细胞肺癌,PD-L1表达均为阴性,客观有效率和疾病控制率为75%,其中1名肿瘤完全缓解未确认,中位起效时间1.7个月。临床2期ORR有所下滑,官方给出的解释是CMC的工艺问题,大家依然抱有很期望。
但是,2022年3月14日,BMS宣布NKTR-214联合“O药”治疗黑色素瘤的3期临床结果未达到预期,终止了NKTR-214的开发。
同时间段,赛诺菲也终止了THOR-707(PEG偶联的IL-2)的开发。THOR-707是赛诺菲以25亿美元从Synthorx公司收购的产品,和NKTR-214有相似的原理,也是非ɑ偏向性IL-2。止步于II期临床试验, 虽然与K药联用展示出了一定的效果,但单药数据并不好。赛诺菲表示并没有信心继续开发。
2)罗氏、Anaveon:前景不明
除了IL-2与PD-1联用,很多公司也在开发两者的融合蛋白。
罗氏有一款同时靶向双靶点的融合蛋白Eciskafusp alfa (RG6279),是2022年以2.5亿美元从Good Therapeutics收购来的。该分子的设计是将IL2连接到PD-1抗体的Fc端,使之不能和IL-2Rα结合,但是依旧可以和IL-2Rβ和IL-2Rγ结合。
该分子可以首先通过PD-1抗体识别并阻断PD-1和PD-L1的结合,然后再结合T细胞和NK细胞上的二聚体IL2R,以扩增T和NK细胞。2023年开展其1期临床研究(NCT04303858),目前数据还未披露。
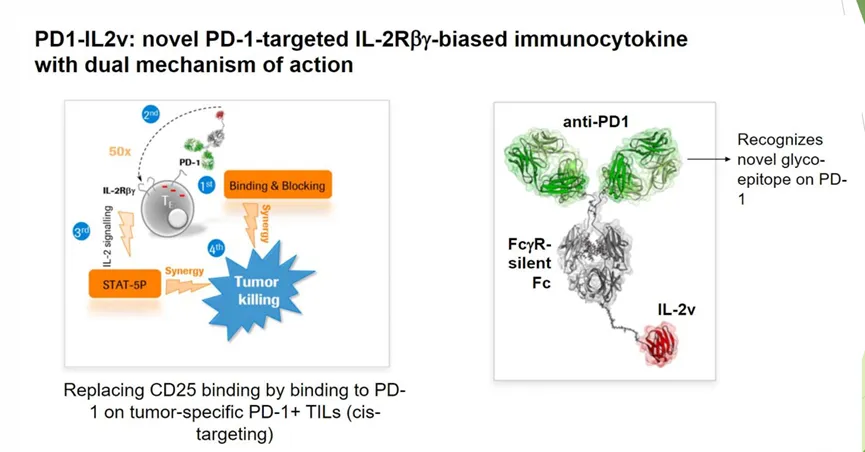
瑞士的Anaveon是一家专门开发IL2激动剂的公司,其中
ANV600能同时靶向PD-1和IL2R,其靶向PD-1的抗体臂只能结合到PD-1上的某一个表位,但并不会block
pembrolizumab和其他免疫检查点抑制剂对PD-1的block,而另一端有一个IL2和IL2抗体的融合蛋白,其可以选择性靶向 IL-2Rβ/γ,也是一个
偏向IL-2Rβ/γ的IL2 construct。
2024年7月,ANV600联合K药在多种实体瘤患者中启动1/2期临床NCT0647076。2025年ASCO上,目前还在临床I期剂量递增阶段,在II期中会对接受过PD-1抗体治疗的耐药或者复发黑色素瘤患者进行进行单药治疗,对HNSCC和无可靶向突变的非小细胞肺癌进行K药联合治疗。
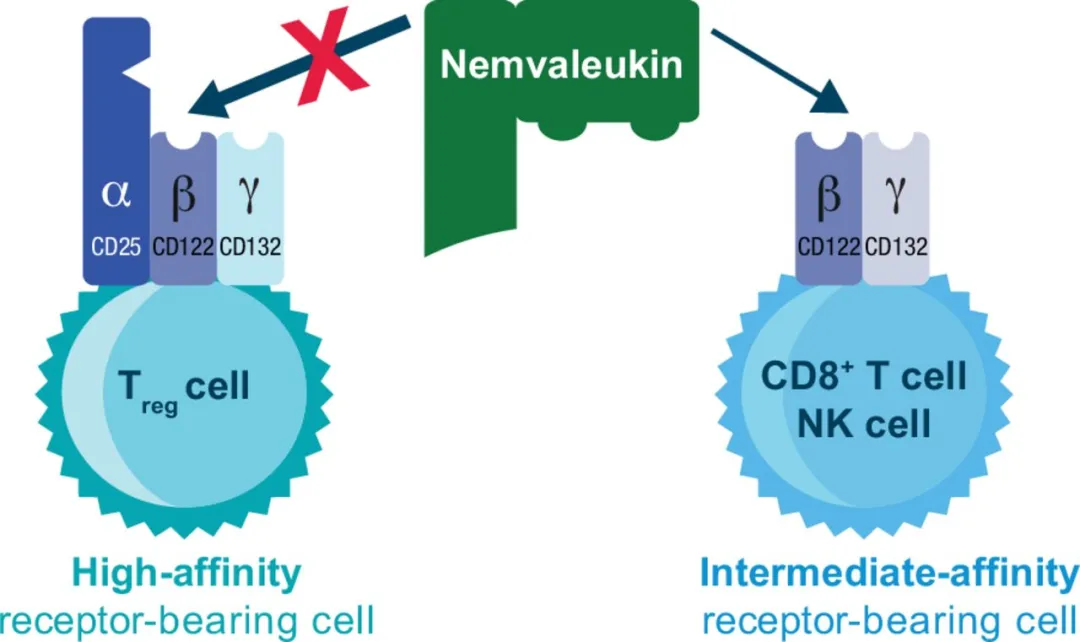
在这个方向上,Alkermes是走得最快的,但于今年3月份公布的卵巢癌临床三期数据似乎提前预告了这个方向可能不可行。
该公司也有一款非偏向IL-2Rα的分子Nemvaleukin alfa(ALKS 4230),由经过改造的IL-2和高亲和力IL-2Rα受体链融合组成,因此其只能选择性和IL-2Rβ/γ结合。该分子2022年启动临床试验,评估与K药联用在实体瘤上的治疗效果。
今年三月,基于临床三期数据,终止了该药在卵巢癌的开发。三期ARTISTRY-7试验中(NCT05092360),nemvaleukin联合组的OS中位数为10.1个月,研究者选择化疗组为9.8个月(HR 0.98)。但其在其他实体瘤(比如注册性黏膜黑色素瘤试验)上的研究还在继续。
3)信达、再生元、梯瓦:未来可期
目前,最早开发的已经有临床数据的非α偏向型IL2几乎全部宣告失败,这也引起了研究者的讨论和反思:是不是非ɑ偏向性这种策略本身可能存在问题,过分强调了ɑ链激活对Treg细胞和内皮细胞的负面影响,而低估了ɑ链在肿瘤特异性T细胞短暂上调时对IL-2信号传导和抗肿瘤免疫调节的重要性?
在这一点上,信达做得和其他公司都不一样。
信达也是PD-1/IL2开发最早的几家公司之一,早期也是选择了主流的非IL2Rα偏向的设计,与NKTR-214思路相似,只不过用岩藻糖代替了PEG去修饰IL2,block其与IL2Rα的结合。
但是,不知道中间发生了什么,亦或是他们有了什么新发现,他们很早就调转桥头,转向IL2Rα偏向的设计,也是最早几家公司里唯一一个保留了IL2Rα结合能力的公司。
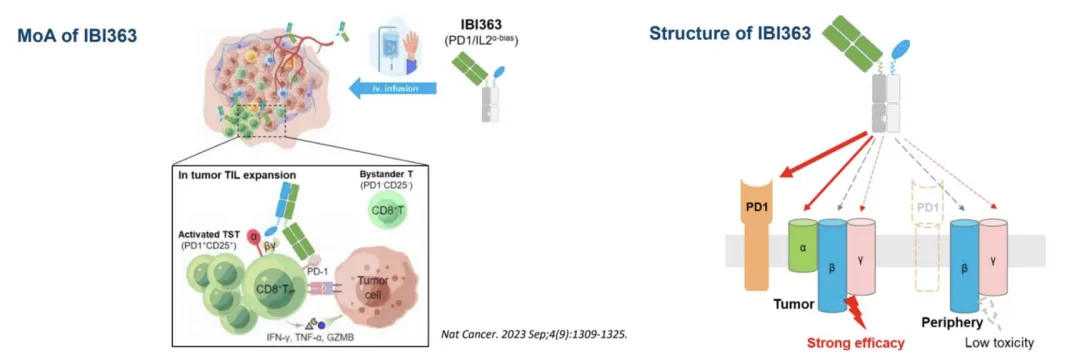
目前的临床数据似乎证明这个策略是正确的。
临床一期中,鳞癌高剂量组ORR达36.7%,mPFS 9.3个月,12月OS率70.9%,显著优于多西他赛标准治疗;在PD-L1低表达患者中ORR仍达46.2%;EGFR野生型腺癌中吸烟者获益更显著,mOS未达到。
结直肠癌中,单药治疗中位总生存期达16.1个月,显著超越标准治疗的6.4-9.3个月;联合贝伐珠单抗客观缓解率达15.1%,无肝转移患者更高达31.3%;机制研究证实可将"冷肿瘤"转为"热肿瘤",为86%免疫治疗无效的结直肠癌患者带来新希望。
BI363在免疫治疗耐药的"冷肿瘤"黑色素瘤(肢端型和黏膜型)中实现突破:客观缓解率达23.3%,疾病控制率76.7%,中位无进展生存期5.7个月,显著优于既往研究的不足3个月;中位总生存期14.8个月,12月总生存率61.5%;中位缓解持续时间14.0个月,安全性可控,已启动关键注册II期研究。
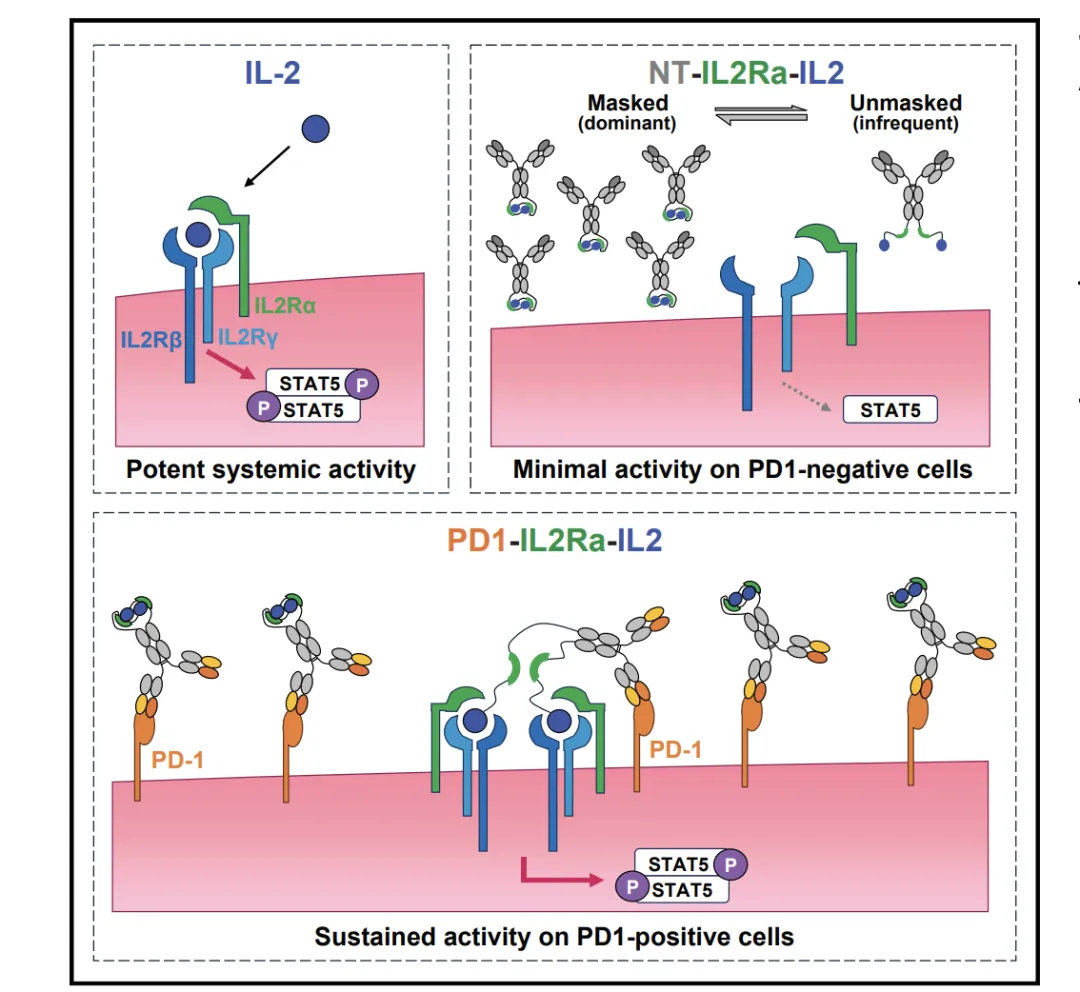
除此之外,再生元也有一款α偏向的PD-1/IL2融合蛋白,他们的PD-1/IL2融合蛋白在抗体Fc链末端通过Linker连接IL-2受体α和IL-2分子。这种设计使IL-Rα与IL-2结合形成掩蔽状态(Mask),此时IL-2无生物学功能;但存在动态解离的非掩蔽状态(Unmask),IL-2恢复活性。
融合蛋白在两种状态间动态转换,主要处于无功能的Mask状态。非靶向时,由于unMask状态极短,细胞IL-2R无法捕获IL-2,不激活STAT5。当PD1抗体与靶细胞PD1结合时,unMask状态的融合蛋白能被细胞表面IL-2R识别,发挥IL-2功能。
该设计通过PD1靶向性和IL2Ra掩蔽机制,既降低了IL-2毒性,又提升了靶向活性。目前在临床1期,暂未披露数据。
梯瓦也有一款a偏向的抗PD-1/IL-2抗体融合蛋白TEV-56278,目前在临床1期。不知是否被是受信达ASCO的良好数据的影响,就在6月16日,复星医药与Teva(梯瓦)共同宣布,双方通过各自的子公司就在研药物TEV-56278的开发达成战略合作。
-04-
一些国内其他更早期的管线
除了上述这些,国内还有一些公司拥有PD-1/IL2管线。
君实着手的比较晚,2024 年 11 月从 Anwita Biosciences 引进了一款非α偏向性的抗PD-1/IL-2c融合蛋白(AWT020),目前正在澳大利亚开展1期临床研究,拟开发的适应症包括抗PD-1难治性非小细胞肺癌、肾细胞癌、黑色素瘤和尿路上皮癌等。
除了上述公司以外,恒瑞也有一款,但没有查询到更多的信息。
博致生物(2019年创办、张江企业)有一款IL2前药在进行临床,对 PD-1 通路的剂量依赖性抑制,拟用于治疗局部晚期/转移性实体瘤,应该也要和PD-1治疗联用。2024年10月刚开始临床。
科弈药业有一款βγ偏向的PD1/IL2融合蛋白(KY-0118),高亲和力结合并阻断PD-1,将IL-2v选择性递送到PD-1阳性的T细胞,从而靶向和偏向性激活肿瘤特异性T细细胞。
目前,KY-0118注射剂单药(及皮下)疗法以及联合PD-L1单抗疗法均已获得中国、美国临床试验批件。中国单药临床处于Phase Ib,黑色素瘤 DCR为3/3 (100%),PFS最长14+个月;肾癌PFS最长21+个月以上;三阴性乳腺癌首例首次临床评估CR(缩小100%),PFS维持14+个月以上。
临床前,博安生物(绿叶子公司)有一款PR201(PD-1/IL-2),克睿基因(2016年由徐元元创立于苏州)有一款 IL-2Rβγ 偏向的PD-1-IL-2v双抗(CGC-602)。
-05-
PD-1/IL-2的未来:乾坤未定,变数犹存
非α偏向策略的失利,让α偏向设计在PD-1/IL-2赛道脱颖而出。信达IBI363的亮眼数据无疑提振了市场信心,但这仅仅是漫长征程的第一步。
在技术层面,α偏向策略的长期有效性和安全性仍需更大规模、更长时间的临床试验来验证。目前大部分候选药物都还处于早期临床阶段,能否在后期临床中持续展现优势,甚至最终获得监管部门的批准,都还存在很大的不确定性。
竞争格局方面,虽然信达暂时领先,但其他玩家也都在积极布局α偏向策略。恒瑞、君实、科弈等公司凭借自身研发实力和临床经验,也在加速追赶中。这场竞赛才刚刚开始,鹿死谁手犹未可知。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 775
775

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 789
789

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 743
743