 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-06-24
2025-06-24
 593
593
在实体瘤靶向治疗的探索版图中,间皮素(Mesothelin, MSLN)因其高度特异性的表达谱和多元的分子机制,正逐渐成为一颗引人瞩目的「潜力之星」,全球管线布局涵盖免疫毒素疗法、单抗、疫苗、ADC 和细胞疗法等。
然而,这颗新星的升腾之路布满荆棘,默沙东、罗氏、拜耳等制药巨头纷纷折戟,全球迄今无一成功上市,最高研发阶段尚处于临床 II 期。而国内药企正以突破性进展悄然改写此困局。
肿瘤治疗新靶点
MSLN 是一种糖基磷脂酰肌醇(GPI)锚定的细胞表面糖蛋白,最早在 1992 年被发现特异性表达于卵巢癌细胞,而除胸膜、腹膜和心包膜间皮细胞外的正常人体组织中几乎不表达,故得名为间皮素。
后续更多的证据显示,MSLN 的异常表达并不仅限于卵巢癌,其在多种实体瘤中均呈现过表达,包括肺癌、胰腺癌、胃癌、胆管癌以及恶性间皮瘤等。与正常组织中的低表达水平相比,MSLN 在肿瘤组织中的这种高度选择性过表达,为肿瘤特异性靶向治疗提供了理想的理论基础。
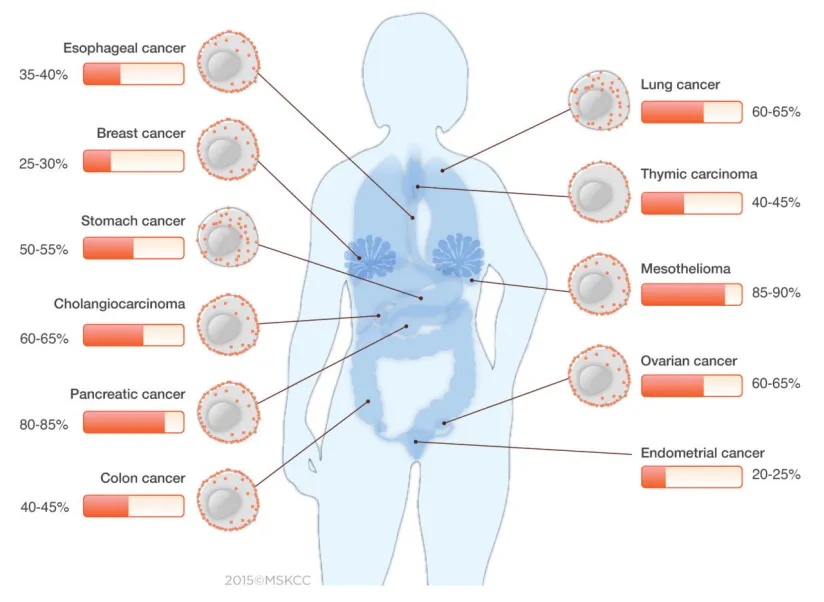
截图来源:《Cancer discovery》(PMID: 26503962)
目前研究发现,MSLN 在肿瘤中发生发展的作用机制复杂而多元。异常的 MSLN 表达促进肿瘤细胞的增殖和侵袭。同时,MSLN 也被证实与 CA125 相互作用介导细胞粘附,在卵巢癌细胞腹膜转移中起到重要作用。
从信号通路来看,MSLN 的过表达可以激活 NFκB、MAPK 和 PI3K 通路,增强对细胞凋亡的抵抗,或诱导 MMP7 和 MMP9 的表达来促进细胞增殖、迁移和侵袭。
总的来说,MSLN 在肿瘤中的特异性高表达以及驱动肿瘤发生发展的多重机制,使其成为了一个极具潜力的肿瘤治疗新靶点。
巨头折戟
MSLN 作为颇具潜力的肿瘤靶点,其蕴含的临床价值持续吸引着全球制药巨头重兵布局,罗氏、默沙东、拜耳、BMS 等纷纷投身其中。然而,MSLN 靶向药物的研发征程堪称荆棘密布。
从研发进度看,拜耳的 Anetumab Ravtansine(研发代号:BAY 94-9343)曾是最具希望的 MSLN ADC 之一。该药物采用全人源抗间皮素抗体,通过可裂解连接子与强效微管蛋白抑制剂 DM4 偶联,DAR 为 3.2。
I 期临床试验结果显示,在包括间皮瘤、卵巢癌、胰腺癌等多种接受过大量治疗的间皮素高表达实体瘤患者中,Anetumab Ravtansine 显示出可控的安全性和初步的抗肿瘤活性信号。
然而,当推进至 II 期临床阶段时,其在卵巢癌和恶性胸膜间皮瘤患者中的表现却令人失望,其疗效数据或劣于对照组,或未能展现出统计学意义的显著差异。
同样是较早入局的默沙东,曾和 Aduro BioTech 携手启动 MSLN 靶向疫苗 CRS-207 与帕博利珠单抗联合治疗的两项 II 期临床试验,分别瞄准恶性胸膜间皮瘤和胃癌。然而,这两项临床均因为入组率低且缺乏临床活性而被终止。
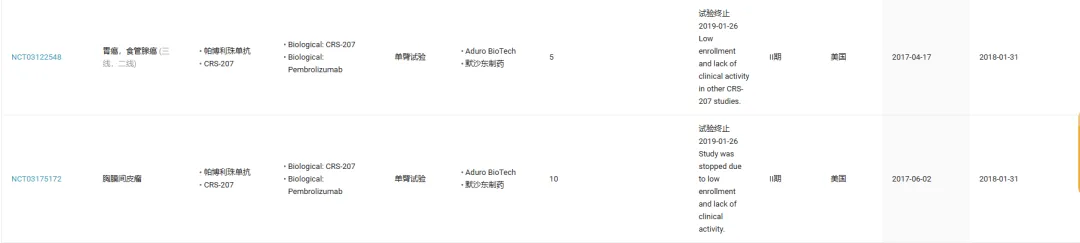
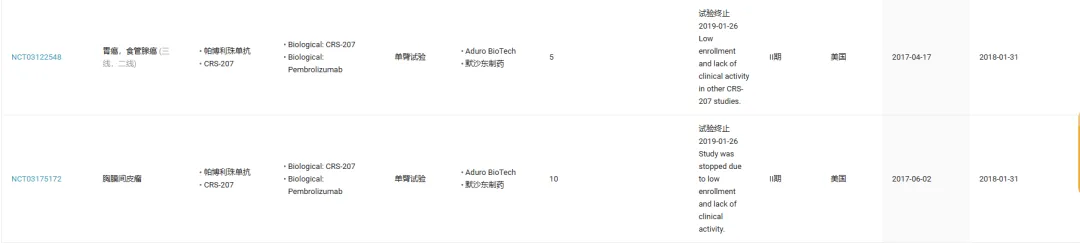
截图来源:Insight 数据库
罗氏则押注于一款重组免疫毒素 LMB-100。该药物可与 MSLN 结合,并带有一种强效的细菌毒素。然而在一项针对胰腺癌的 II 期临床试验中,LMB-100 因为严重的安全性问题亮起红灯,提前终止了研究。
众多巨头的相继受挫,无疑为 MSLN 靶向治疗领域蒙上了一层阴影,不断考验着后继者的研发能力和信心。
国产突围
尽管 MNC 在 MSLN 死亡之谷中艰难跋涉,全球仍有众多药企前赴后继,其中国内药企锋芒渐露,尤其在 ADC 和细胞治疗领域展现出创新活力。
荣昌生物的 RC88 是一种具有 first-in-class 潜力的 MSLN ADC,采用了其自主研发的创新桥接技术连接 MSLN 靶向抗体以及小分子细胞毒素 (MMAE),可有效地将细胞毒素定向传递给癌细胞,实现较好的肿瘤杀灭效果。
2024 年 ASCO 大会上,荣昌生物首次公布了 RC88 单药治疗 MSLN 表达的晚期实体瘤的 I/II 期临床研究结果。该项研究纳入了标准治疗失败的 MSLN 表达晚期恶性实体瘤患者,主要终点是基于 RECISTv1.1 标准的 ORR。
在接受过 2 至 4 线既往治疗的 31 例卵巢癌患者中,ORR 和确认的 ORR 分别为 45.2% 和 41.9%,中位 DoR 为 8.02 个月。与目前的标准治疗方案(ORR 为 12%)相比,RC88 具有显著改善 MSLN 表达的晚期实体瘤患者预后方面的潜力。
在 16 例 EGFR/ALK 野生型非鳞状非小细胞肺癌患者中,ORR 和 cORR 分别为 31.3% 和 25%。其中 12 名 MSLN 高表达(PS2#≥50)患者的 ORR、cORR、中位 PFS 和中位 DoR 分别为 41.7%、33.3%、6.87 个月和 9.13 个月。
18 例曾接受过系统治疗的宫颈癌患者的 ORR 和 cORR 分别为 33.3% 和 27.8%,其中在既往接受过≥ 2 线治疗的 12 名患者中,ORR 和 cORR 分别为 41.7% 和 33.3%。
除了单药治疗以外,荣昌生物还拓展了联用策略。2023 年,分别与信达和君实达成合作,探索 RC88 与信迪利单抗或特瑞普利单抗联用的临床潜力。
另外,和铂医药同样拥有一款 MSLN ADC 药物 HBM9033(PF-0805266)。该药物在分子设计上由全人源 IgG1 单克隆抗体与基于喜树碱的强效 TOP1i 载荷,通过可被蛋白酶裂解的连接子连接而成,DAR 均值达到 8,旨在解决以往靶向 MSLN ADC 疗法的局限性。
2023 年 12 月,辉瑞以 11.3 亿美元获得了该药的全球临床开发和商业化权利。次年 6 月,辉瑞启动首个 HBM9033 针对晚期实体瘤的 I 期开放标签、多中心研究。2025 年 AACR 大会上,辉瑞公布了该药的临床前数据。
体外研究显示, HBM9033 能有效杀伤 MSLN 阳性细胞,并通过「旁观者效应」杀伤共培养的 MSLN 阴性细胞。即使在生理浓度可溶性 MSLN 存在下,HBM9033 仍具备细胞杀伤能力。
体内研究显示,在多种肿瘤模型(卵巢癌、肺癌、结直肠癌细胞系及患者来源异种移植模型)中,HBM9033 的疗效均显著优于基于 DM4 的 MSLN 基准 ADC。在由 MSLN 阳性和阴性细胞混合组成的异源移植模型中,HBM9033 也展现出更强的抗肿瘤活性和旁观者效应。
细胞治疗是 MSLN 靶向领域的另一重要突破口。根据 Insight 数据库,进入临床阶段的国产 MSLN 靶向药物共 23 款,其中细胞疗法独占 21 席。除单靶点的 MSLN CAR-T 外,还有多靶点 CAR-T(如 CD40/MSLN、MSLN/PD-1/MUC1/CTLA4、MSLN/CLDN18.2 等)以及 CAT-NK 等。
2025 年 ASCO 大会上,上海细胞治疗集团开发的新型非病毒 aPD1-MSLN JL-Lightning-CAR-T 疗法(BZT2312)展现了 MSLN 靶向的实体瘤治疗的突破性进展。I 期数据显示,仅需 30 小时即可完成从单采血到制剂的全过程,7 例入组的晚期恶性间皮瘤患者,均接受了单次静脉回输,总体 ORR 为 57%, DCR 为 86%。
此外,在第二剂量组(DL2,n=2),1 例患者达到 PR ,1 例患者实现 CR,ORR 与 DCR 均为 100%(2/2)。其中,CR 患者在 3 个月时获得肿瘤完全缓解,持续 CR 已超过 12 个月。在第三剂量组(DL3,n=4),4 例患者中有 2 例达到 PR,2 例为 SD,ORR 为 50%(2/4),DCR 为 100%(4/4)。
除此之外,目前国内大部分项目均处于临床早期阶段,公开披露的临床数据有限。
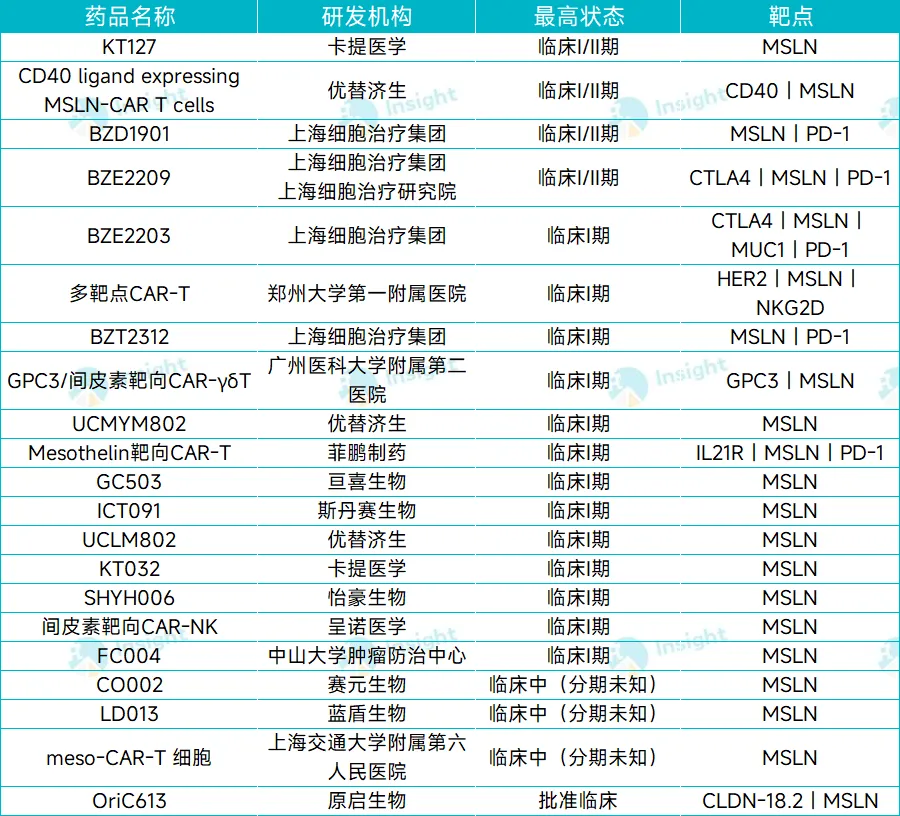
截图来源:Insight 数据库,统计截止日期:2025 年 6 月 23 日
结语
从靶点机制探索到临床转化应用,MSLN 靶向治疗已历经近二十年的曲折征程。从早期 MNC 的折戟沉沙,到如今国产药企凭借创新技术平台和差异化策略重整旗鼓,这一靶点正迎来价值重估的关键时期。
MSLN 最终能否成功突围,成为实体瘤治疗领域的又一重要靶点,还需要更多的临床数据来说话。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 775
775

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 789
789

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 743
743