 产业资讯
产业资讯
 医麦客
医麦客  2025-06-24
2025-06-24
 755
755
近年来,抗体偶联药物(ADC)凭借其精准的靶向能力和强效杀伤作用,已成为全球创新药领域最炙手可热的赛道之一。根据 Frost&Sulliva 预测,到 2030 年,全球 ADC 药物市场规模有望增长至 647 亿美元,复合年增长率(GAGR)将达到 30%。
这一市场的爆发性增长,直接反映了赛道的白热化竞争与资本的高度聚集。从企业布局来看,全球已有超百家企业扎堆涌入,研发热度持续攀升,新药研发管线如雨后春笋般激增。
其中,我国已然成为全球 ADC 研发的中坚力量,国产 ADC 新药研发项目数量约占全球管线的一半。我国创新药企更是成为诸多 MNC 争相合作的对象,「天价 BD」一次次刷新行业认知。资本的涌入进一步催化了技术裂变,双抗 ADC、双载荷 ADC 等多种新型 ADC 集中涌现。
恒瑞首款 ADC 获批,
全球已上市 ADC 达 19 款
近日,恒瑞医药自主研发的注射用瑞康曲妥珠单抗(SHR-A1811)正式获批上市,适应症为 HER2 突变型非小细胞肺癌。
作为恒瑞首款获批上市的 ADC,该产品在关键性 HORIZON-Lung 试验中展现出高达 74.5% 的客观缓解率(ORR)和 11.5 个月的中位无进展生存期(mPFS),12 个月 PFS 率更是达到了 48.6%,刷新全球同类研究纪录。
值得注意的是,瑞康曲妥珠单抗从获批临床至今仅 5 年。目前,其在肺癌、乳腺癌、结直肠癌、胃癌或胃食管结合部腺癌、胆道癌以及上皮性卵巢癌、输卵管癌或原发性腹膜癌治疗领域的 8 项适应症均获国家药品监督管理局突破性疗法认定。
至此,全球获批上市 ADC 药物已达 19 款(详见下表)。接下来,我们先就这些上市 ADC 简单做一个盘点回顾。
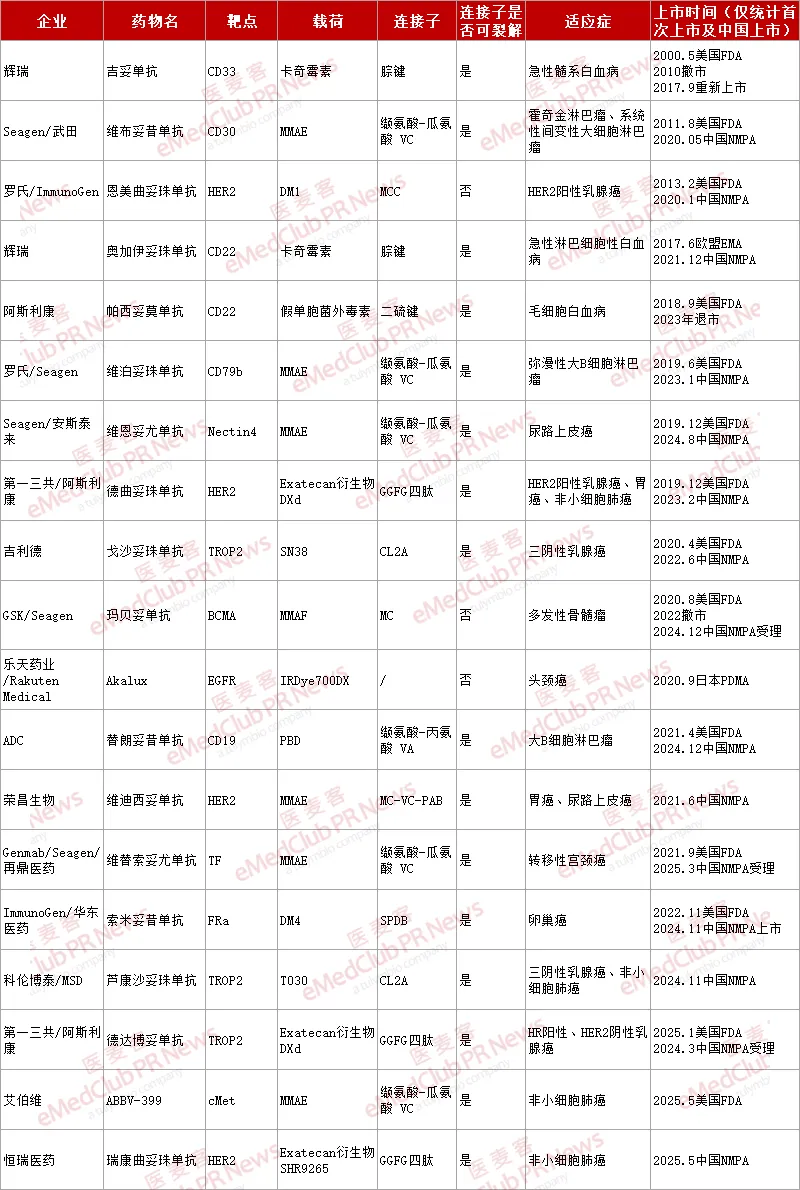
▲ 已上市 ADC 产品(医麦客整理,如有错漏,欢迎指正)
从适应症来看,这 19 款 ADC 首选适应症均定位在肿瘤。其中,有 7 款用于治疗血液肿瘤(如淋巴瘤、白血病),12 款用于治疗实体瘤(乳腺癌、胃癌、尿路上皮癌等)。早期上市的 ADC 适应症多为非实体瘤,可能是因为早期技术不成熟,考虑到 ADC 不稳定易裂解。
从靶点分布来看,这些 ADC 覆盖了 CD33、CD30、CD22、HER2、CD79b、Nectin4、TROP2、BCMA、EGFR、CD19、TF、FRa 和 cMet 这 13 种靶点。靶点呈现两极分化格局,HER2、TROP2 等热门靶点扎堆研发,临床资源争夺激烈。
从载荷类型来看,9 款 ADC 采用了微管破坏类药物,8 款为 DNA 抑制剂,剩余 2 款为其他毒性药物。从连接子类型来看,有 16 款 ADC 采用了具有「旁观者效应」的可裂解连接子,对肿瘤的杀伤效果可能更强;3 款使用了不可裂解连接子,稳定性更好,脱靶毒性更低,但通常杀伤效果不如可裂解连接子。
尽管 ADC 药物已展现出显著的临床价值,但其研发仍面临多重挑战。脱靶毒性仍是最突出的挑战,如部分 ADC 可能因连接子稳定性不足,导致载荷提前释放从而引发不良反应等。靶点特异性不足也制约药物临床疗效,且当下靶点同质化严重。此外,肿瘤微环境的异质性等因素也使得多数 ADC 在胰腺癌、胶质瘤等高异质性肿瘤中折戟。这些未解决的挑战正成为后续研发突破的关键方向。
40 款 3 期管线在研,
差异化创新成破局关键
据不完全统计,当前全球进入 3 期临床的 ADC 管线约 40 款(详见下表),国内外研发企业正通过靶点选择创新、载荷机制迭代、适应症多维拓展等策略,持续突破 ADC 技术边界。
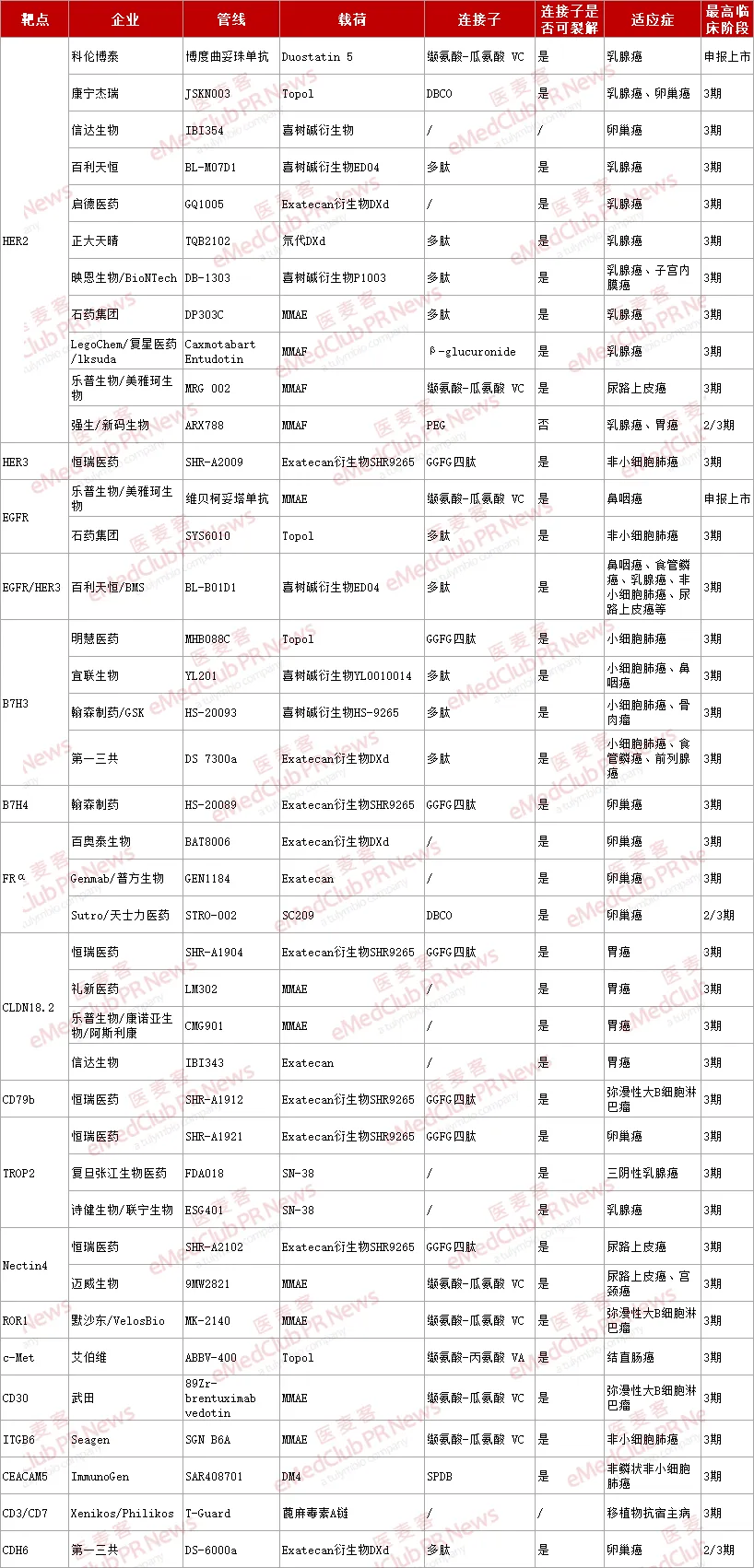
▲ 全球 3 期临床阶段的 ADC 管线(医麦客整理,如有错漏,欢迎指正)
在靶点选择方面,差异化布局的趋势逐渐明显。尽管 HER2 仍是热门靶点,但 3 期临床试验中出现的新靶点数量显著增加,新增了 HER3、B7 H3、B7 H4、CLDN18.2、ROR1、ITGB6、CEACAM、CDH6 等多种靶点。虽然 HER2 ADC 管线仍占到近 28%(11/40)的比例, 但 B7 H3 和 CLDN18.2 为代表的新兴靶点已开始展露头角,分别占 10%(4/40)。
值得关注的是,除了对单一靶点的探索外,EGFR/HER3、CD3/CD7 等双靶点组合的 ADC 管线进入后期研发,突破传统单靶点研发思路,为复杂肿瘤耐药机制提供了潜在的全新解法。相较于国际市场,国内企业在靶点选择上虽仍存在同质化倾向,但 CLDN18.2 等具有亚洲人群优势的靶点开发已形成特色布局。
适应症整体布局来看,3 期临床管线主要集中在实体瘤领域,40 款管线中仅 3 款针对血液瘤,覆盖了乳腺癌、卵巢癌、子宫内膜癌、尿路上皮癌、胃癌、肺癌、鼻咽癌、食管鳞癌、骨肉瘤、前列腺癌、弥漫性大 B 细胞淋巴瘤、结直肠癌、移植物抗宿主病等 13 种适应症。具体到细分领域,可以看到 ADC 药物市场正呈现「纵向深耕、横向拓展」两大主要趋势。
一是对现有靶点适应症潜力的深度挖掘,如 HER2 ADC 向卵巢癌、子宫内膜癌、尿路上皮癌等领域的拓展;Nectin4 ADC 向宫颈癌的拓展;EGFR ADC 向非小细胞肺癌、鼻咽癌的拓展等。第二是针对罕见瘤种、难治性癌症和非肿瘤适应症(自免疾病、感染等)的突破。随着基因工程、抗体筛选等技术的进步,ADC 药物的特异性和稳定性逐渐增强,安全系数得到了提升,适应症也逐渐从肿瘤治疗向其他疾病拓展,例如 B7 H3 ADC 用于骨肉瘤、CD3/CD7 ADC 用于移植物抗宿主病等。
除了靶点之外,研究人员也在积极探索具有更高细胞毒性和更低副作用的新型载荷。除传统的微管蛋白有效载荷(如 MMAE、MMAF、DM4)和 DNA 损伤剂(如卡奇霉素、PBD)外,以喜树碱类衍生物(如 DXd)为代表的拓扑异构酶 I 抑制剂成为了主流,这类载荷通过特异性结合 DNA-拓扑异构酶复合物的界面,从而抑制拓扑异构酶修复机制,导致 DNA 损伤,发挥抗肿瘤作用。
以 DXd 为例,其是 exatecan 的衍生物,化合物活性更高、溶解性更好。研究发现,DXd 在保留了 exatecan 效力的同时,还能够使每个抗体结合多达 8 个 DXd 分子,而不会出现严重聚集。与第一代 ADC 相比,这类创新 ADC 临床前治疗窗口有所改善。
对于连接子的改进也是 3 期临床管线的一大亮点。整体来看,可裂解连接子仍占主导(占比超 92%), 但裂解机制更加多样化,从化学可裂解逐渐过渡到酶可裂解。
其中,多肽类连接子由于在血浆中非常稳定,可能提供更宽的治疗窗口,因而得到了广泛使用。近年来,各种新型肽基连接子更是不断涌现,如含有β-丙氨酸的间隔基可降低疏水性,改善 ADC 的药代动力学特性。
结语
从全球 ADC 赛道的发展趋势来看,该领域已逐步从靶点「跑马圈地」阶段迈向技术「深水区」的较量。目前,19 款已上市的 ADC 奠定了其在肿瘤治疗中的重要地位,而 40 款处于 3 期临床、超 300 款处于 1 期/2 期临床管线的密集布局,预示着未来几年将是 ADC 获批的爆发期。特别值得关注的是我国创新药企的崛起,多项 License out 刷新纪录,国产 ADC 正在这一领域与欧美企业展开直接竞争。
技术创新将成为未来竞争的核心壁垒。针对 ADC 药物研发中存在的脱靶毒性、靶点同质化以及肿瘤微环境异质性等核心挑战,各大药企正积极探索新的解决方案。例如,通过优化连接子的设计和稳定性,减少 ADC 在正常组织中的非特异性释放,从而降低脱靶毒性;开发针对新靶点的 ADC 药物,以避免靶点同质化带来的竞争压力。此外,针对肿瘤微环境的异质性,研究者们也在探索如何使 ADC 更有效地穿透肿瘤组织,达到更好的治疗效果。
随着对 ADC 研发领域的不断深入探索,在人工智能(AI)等新技术的联合应用下,无论是靶点发现还是技术平台的迭代,适应症的拓展还是耐药机制的破解,ADC 领域的创新将以更快的速度推进。随着更多差异化创新管线进入临床后期,ADC 有望为全球更多患者提供更精准、更安全的治疗选择。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 775
775

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 789
789

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 743
743