 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-06-25
2025-06-25
 478
478
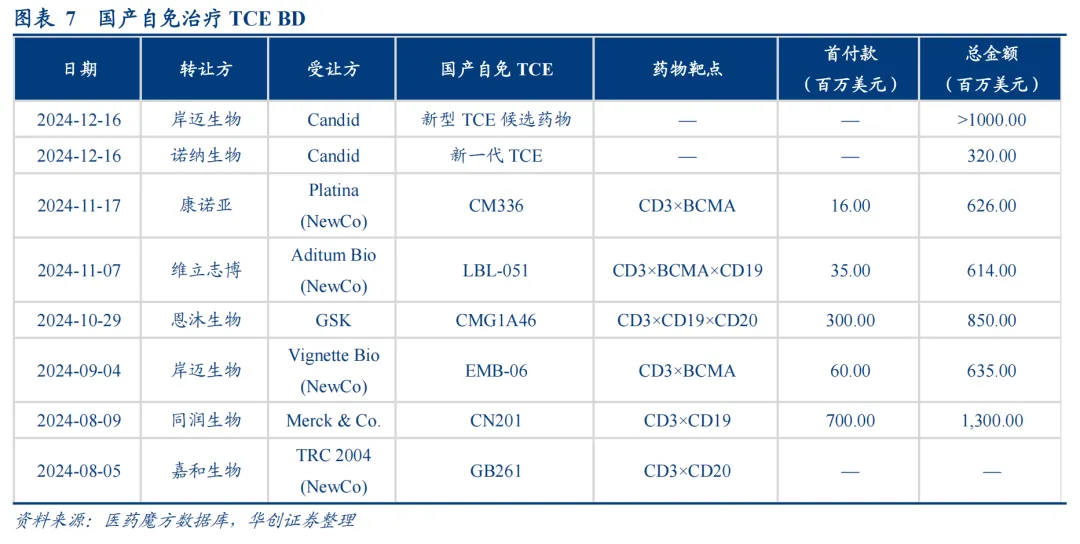
继2024年下半年的BD狂潮后,T细胞衔接器再起波澜。
6月23日,和铂医药以4700万美元的首付款和近期里程碑付款+高达6.23亿美元的额外付款及未来销售分成将BCMAxCD3双抗HBM7020大中华区外的权益授予大塚制药。据和铂医药官网显示,HBM7020主要的开发适应症为自身免疫疾病。
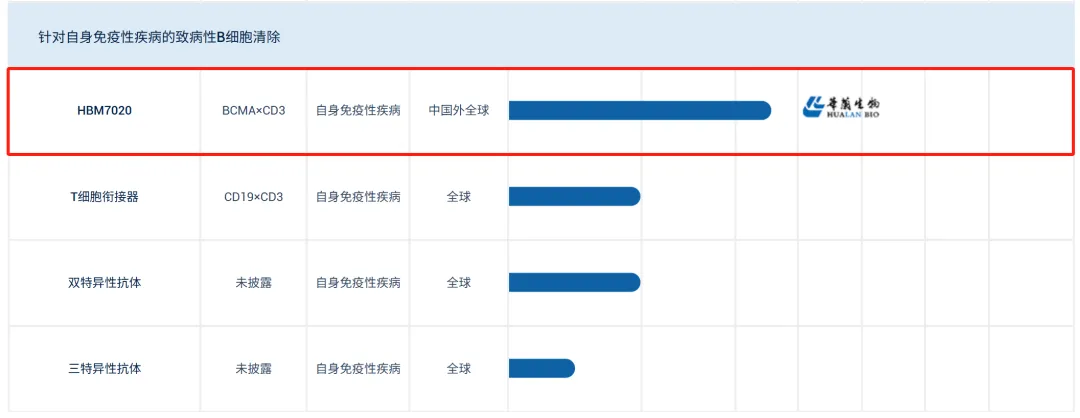
近日,罗氏公布了全球首个CD20xCD3双抗Mosunetuzumab(以下统简称:Mosu)自免临床数据,该药已经在2022年中获得欧盟批准治疗复发性或难治性滤泡淋巴瘤。在本次公布治疗中度系统性红斑狼疮(SLE)初步临床数据中,表现出可有效清除外周血B细胞并长期维持的疗效。
值得注意的是,过去全球T细胞衔接器自免疾病开发走在最前沿的为IGM Biosciences和Cullinan Therapeutics,两者核心开发T细胞衔接器均为肿瘤转自免,前者在年初停止开发两款CD3双抗并裁员73%,后者则是最近从智翔金泰引进了BCMAxCD3双抗,被外界视为一种信号。
2025年下半年,将会有大量的T细胞衔接器公布首次临床数据,这预计将为T细胞衔接器的BD交易热度再送上一把火。
01
BCMAxCD3双抗,领航者打样
2025年以来,BCMAxCD3双抗领域仍在持续发生BD交易,包括智翔金泰与Cullinan的交易、和铂医药与大塚制药的交易等,并且首付款有逐渐攀升的迹象,这很可能得益于赛道先驱的珠玉在前。
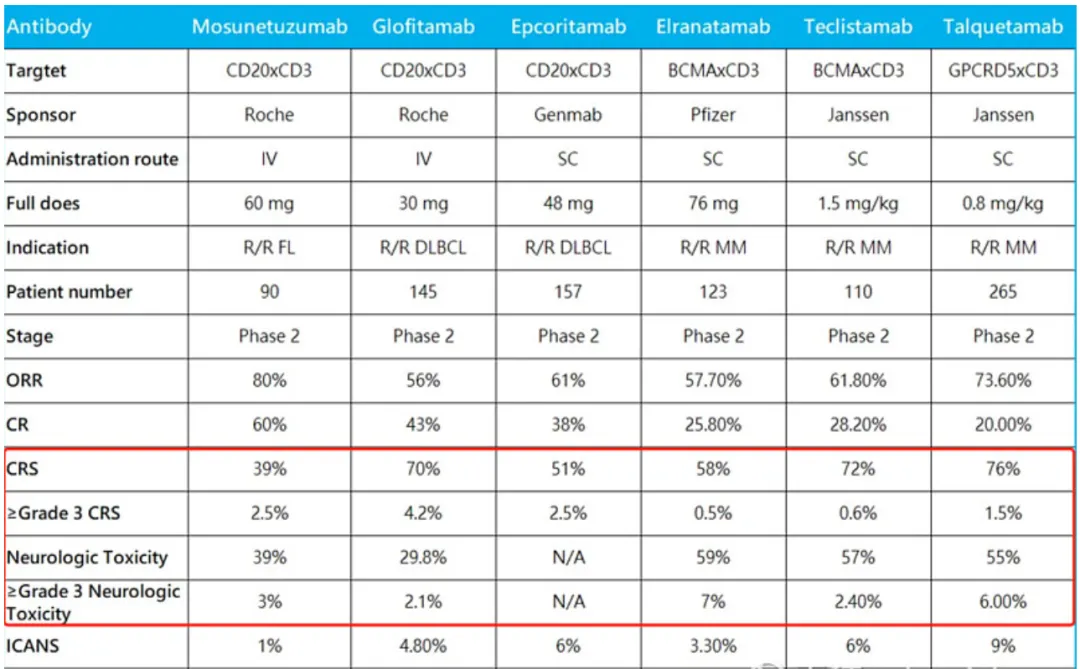
2024年9月,《新英格兰医学杂志》发表的一篇研究数据显示,一名有6年病史的SLE患者在接受BCMAxCD3双抗Teclistamab治疗后能够快速且在无药物维持的情况下,生物标志物降至正常或接近正常水平,患者粘膜皮肤和肌肉骨骼症状完全消失,实现了完全缓解。

在不错的疗效背景下,我们核心需要了解的是该病例给予的剂量和安全性。剂量方面,该患者接受了Teclistamab注射(剂量逐步递增),第1、7天分别为0.03和0.6mg/kg;第2周和第5周为1.5mg/kg(最终剂量);安全性方面,安全性方面,这力患者的不良反应包括2级细胞因子释放综合征(CRS)、肺炎、鼻窦炎和低丙种球蛋白血症,与Teclistamab在MM患者报告的副作用相似。
对比Teclistamab在MM的临床设计,可以发现该药在SLE和MM的剂量相似(爬坡再到1.5mg/kg),尽管Teclistamab相比其他BCMA疗法具备安全性优势,不过CRS发生率很高和有一定程度的免疫效应细胞相关神经毒性综合征(ICANS)发生率,这在自免适应症中有些难以接受。
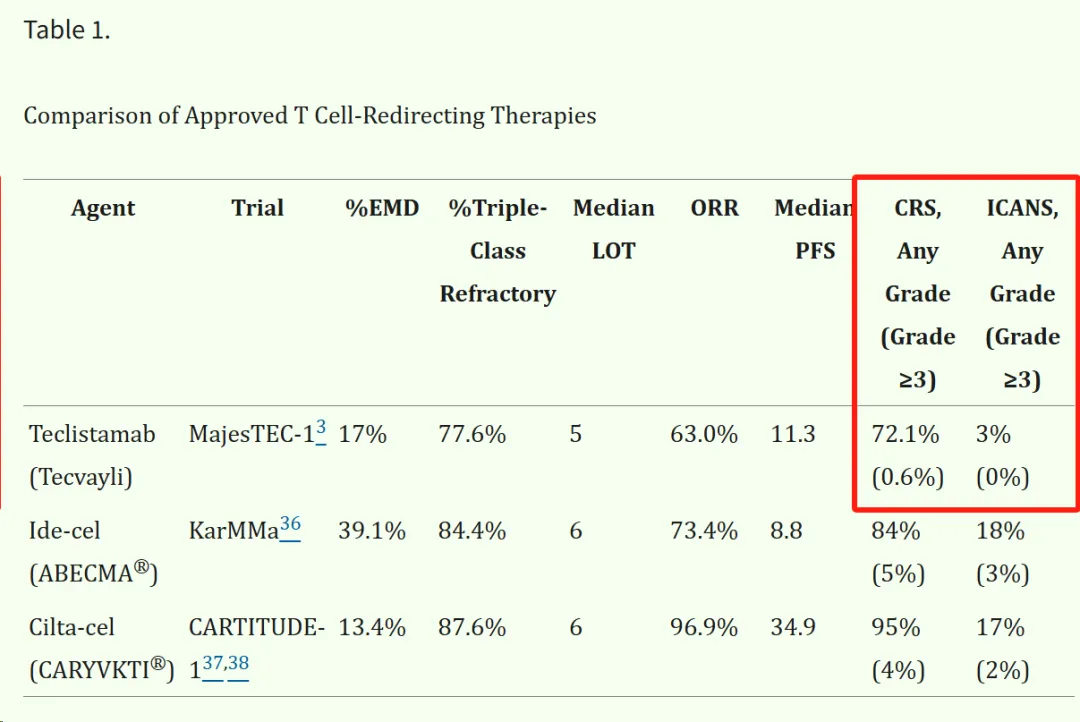
当然,原本就定向肿瘤适应症的T细胞衔接器管线出现这样的问题也很正常,关键在于后续迭代分子或者剂量降低后的疗效和安全性能否兼顾,Teclistamab暂时没有给出示范。
同样在NEJM,康诺亚最新发布的BCMAxCD3双抗CM336在自身免疫性溶血性贫血(AIHA)数据加了一把火,在两名多线治疗失败(包括CD19 CAR-T、BTK抑制剂)的AIHA患者中,两名患者在接受治疗后分别在第13天获得部分缓解(PR)、在第21天获得完全缓解(CR),并且疗效持续超过半年;安全性方面,仅观察到1级皮肤硬结及低丙球蛋白血症,没有发生严重不良反应,亦未出现CRS或ICANS,未见感染事件。
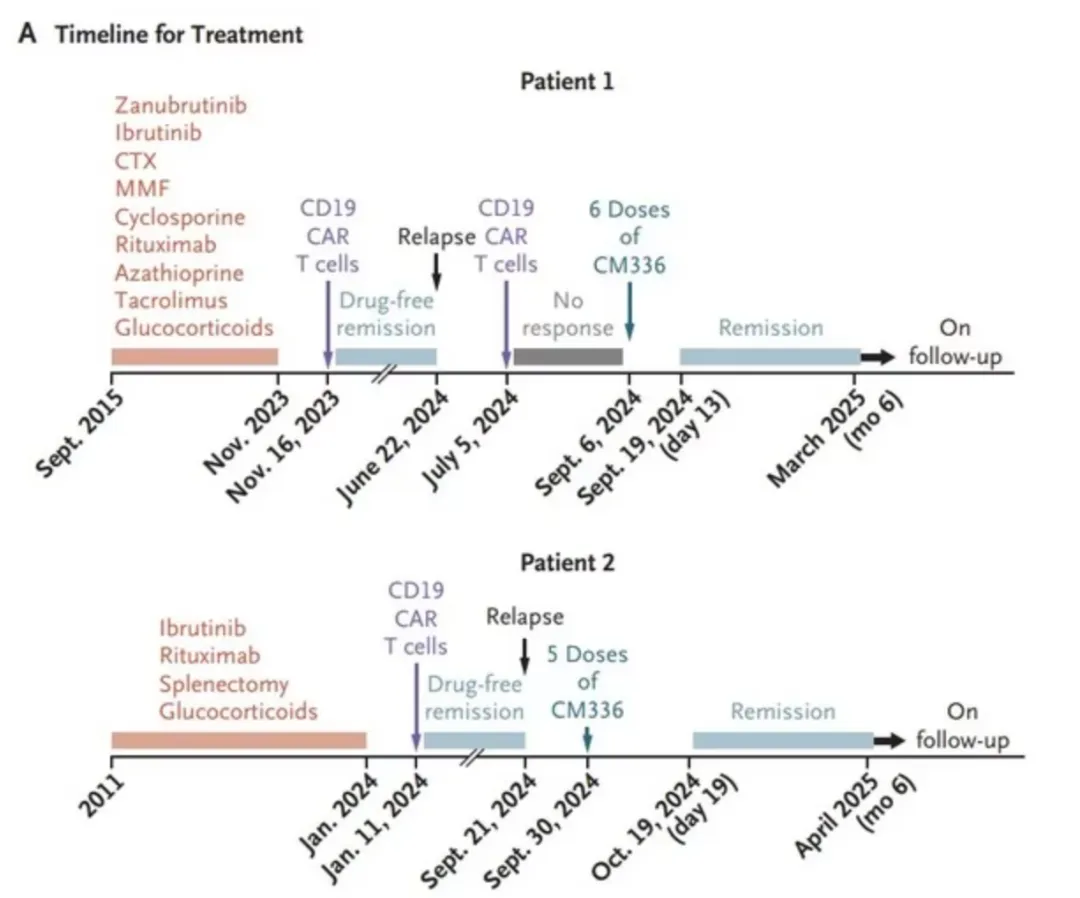
(两名AIHA患者治疗情况 图源:NEJM)
CM336在AIHA患者中初步的疗效和较低的安全性风险给后面的自免BCMAxCD3双抗打了个样,这可能在未来促成更多的赛道交易。
02
罗氏Mosunetuzumab数据,评价几何?
Mosu在EULAR 2025大会上公布了治疗系统性红斑狼疮(SLE)的1b期的结果,该研究一共纳入了15名成年SLE患者,筛查时系统性红斑狼疮疾病活动指数 2000(SLEDAI-2K)总分≥4,为中度SLE患者,试验分为2个剂量探索队列(非分割,21天)和3个剂量递增队列(分割,28天),所有患者在完成最后一次治疗后须至少随访12个月监测安全性。
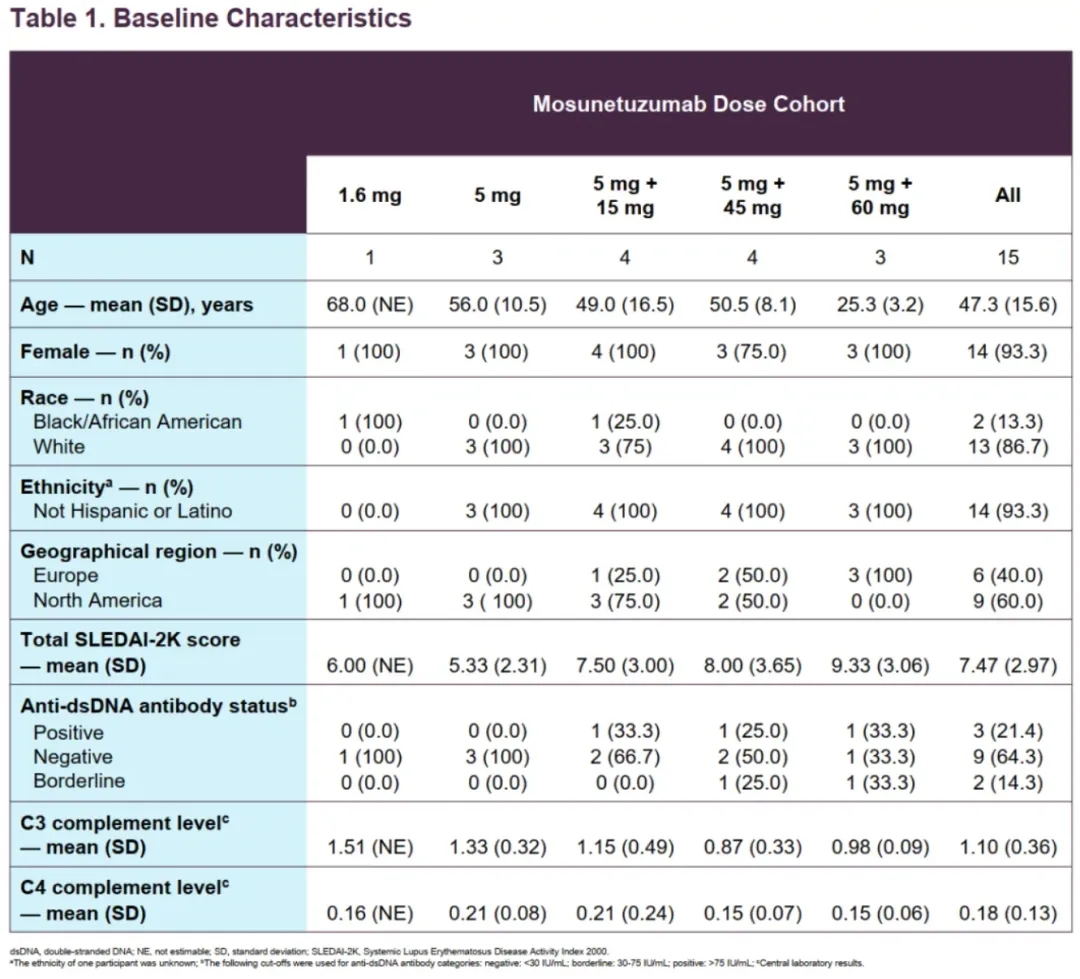
疗效层面,在2个非分割低剂量组(1.6mg及5mg)尽管可以快速耗竭B细胞,但短时间内B细胞数量会快速反弹;在3个分割高剂量组,接受Mosu治疗的所有患者B细胞数量降至检测下限且能够持续疗效200天左右;另外,分割高剂量组患者在接受Mosu治疗后SLEDAI-2K评分均出现评分降低,部分患者能够降低至2分,而少数初始评分较高的患者在270天评分能降低到6分。
安全性方面,15例患者中有4例发生CRS(均为1~2级),均为首次给药后出现;另外,常见副作用还有淋巴细胞减少、感染等,均为轻度;还有1例最高剂量组的患者在接受爬坡期后37天死于间质性肺炎,后研究者和申办方评估与Mosu无关。
目前基于已披露B细胞耗竭策略的T细胞衔接器临床数据而言,Mosu在疗效维持时间、安全性应该算中规中矩,而疗效当前仅有中度SLE患者人体数据,需要未来进一步在重度SLE患者层面评估。但仅仅以当下的数据情况来说,Mosu在自免疾病想要大展拳脚,压力不小,毕竟CAR-T的B细胞耗竭深度带来的疗效和持续时间摆在那里,当然其安全性和可及性也有待考察。
至少我们认为,Mosu的数据大概率不会对后续新的CD20xCD3双抗数据披露带来肃杀气氛,不妨期待一下后续康诺亚的CM355、嘉和生物的GB261后续数据读出。
03
机会投射
全球TCE自免管线资产超过30款,但大部分都在临床前,而光是治疗SLE进入临床的TCE管线就超过10条,而这些管线将在未来2年内密集披露数据。
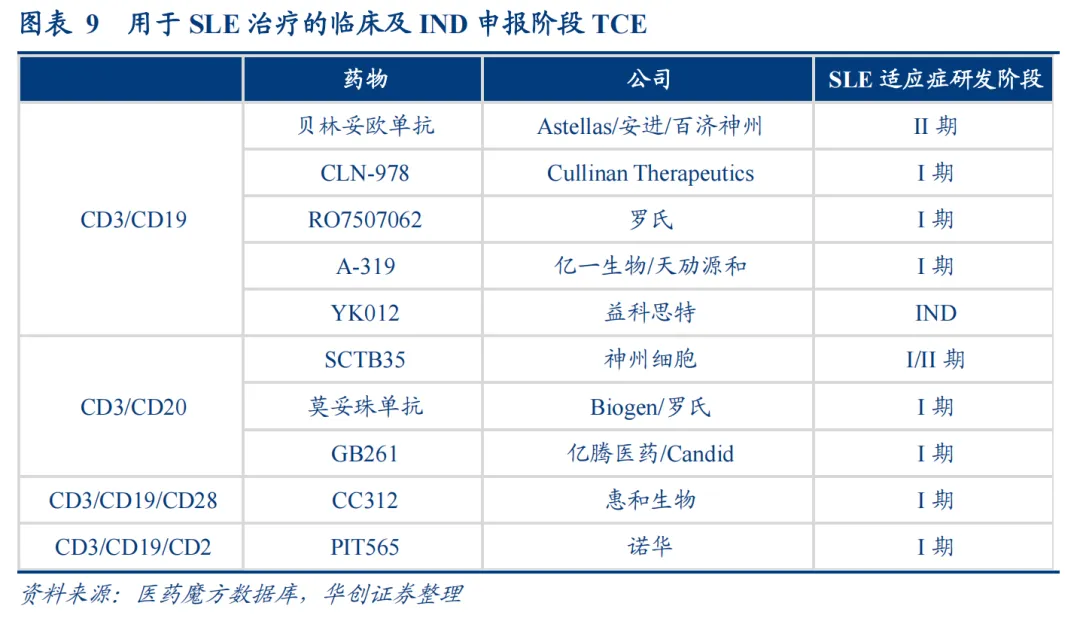
Cullinan的CD3xCD19双抗CLN-978是海外市场关注的焦点之一,该分子在经工程改造对CD19有很高的结合亲和力(即便是CD19表达量极低的B细胞、临床前显示优于安进的贝林妥欧单抗)、对CD3具有更低的亲和力(降低安全性风险)及可实现皮下注射(注射便捷性)。
早CLN-978治疗弥漫性大B细胞淋巴瘤(DLBCL)临床小样本数据显示,3名患者每周接受30mg皮下注射,首次给药后96小时内2名具有可检测基线B细胞的患者外周B细胞分别减少了93%和98%,而两名肿瘤体积较大的患者在首次给药后出现了一级CRS事件,其他不良事件为低级别或于机制相关事件(如淋巴细胞减少症);而CLN-978的一期SLE临床,将在2025Q4获得初步数据。
另一个关注度很高的便是默沙东高价买下的同润生物的CD3xCD19双抗CN201,在2024年ASCO大会上,CN201初步肿瘤临床数据,51例患者中15例患者(29.4%)出现CRS(仅2例为3级),未见患者出现ICANS,这样的安全性表现在同类型的TCE中展现出BIC潜力,这也让投资者对其后续数据倍加期待。
(图源:雪球用户chuminhua)
密集的数据催化,可能会带动MNC或海外资金对于T细胞衔接器资产的进一步热潮,如果数据不及预期,可能会引发另外一个方向的探索和BD机会——髓系细胞疗法(MCE)。
MCE国内比较代表性管线为CD20xCD47融合蛋白IMM0306,一方面阻断CD47-SIRPα信号通路激活巨噬细胞吞噬功能,同时高亲和力结合CD20,单次给药即可实现B细胞清零并维持3个月以上,而如TCE代表性药物Teclistamab需要每4-6周重复给药以维持疗效;IMM0306有望在近期公布治疗SLE的早期临床数据,以便进一步验证其成药性和安全性。
另外,赛诺菲在2025年3月宣布以6亿美元的首付款收购Dren Bio的MCE管线DR-0201也验证了MCE路径的潜力,目前,DR-0201正在开展两项I期临床试验,分别针对复发或难治性B细胞非霍奇金淋巴瘤和自身免疫性疾病,DR-0201在临床前和临床研究中均显示出显著的B细胞清除效果。
结语:TCE的自免路径验证已经初见曙光,后面就是Me Better和BIC的事情了,相信国产分子在这块能够发光发热,而未来相信有更多中国底色的Newco,能够被MNC高价收购。
而下一个BD潮,会不会是MCE?

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 761
761

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 776
776

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 729
729