 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-06-28
2025-06-28
 6230
6230
6 月 27 日,NMPA 官网显示,信达/礼来的胰高血糖素(GCG)/胰高血糖素样肽-1(GLP-1)双受体激动剂「玛仕度肽」(研发代号:IBI362)获批上市,适用于在控制饮食和增加体力活动基础上对成人患者的长期体重控制,初始体重指数(BMI)为:BMI≥28 kg/m2(肥胖);或 BMI≥24 kg/m2(超重),并伴有至少一种体重相关的合并症(例如高血糖、高血压、血脂异常、脂肪肝、阻塞性睡眠呼吸暂停综合征等)。
截图来源:NMPA 官网
玛仕度肽是信达生物与礼来制药共同开发的一款 GLP-1R/GCGR 双重激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动 GLP-1R 促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动 GCGR 增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。
值得一提的是,根据 Insight 数据库,玛仕度肽是一款全球 First-in-Class 药物,是全球首个且唯一获批的 GCG/GLP-1 双受体激动减重药物。
本次获批主要基于一项在超重或肥胖受试者中开展的 III 期注册临床研究(GLORY-1)的研究结果。该研究结果已于 2025 年发表于《新英格兰医学杂志》。
GLORY-1 研究共入组 610 例肥胖(BMI ≥ 28 kg/m²)或超重( 24kg/m² ≤ BMI < 28 kg/m²)并伴有至少一种肥胖相关并发症的受试者,受试者基线平均体重为 87.2 kg,基线平均 BMI 为 31.1 kg/m²。
这些受试者随机接受玛仕度肽 4 mg、6 mg和安慰剂,每周一次、皮下注射给药 48 周。研究主要终点为第 32 周时体重较基线的百分比变化和体重较基线降幅 ≥5% 的受试者比例。
研究结果显示,各剂量玛仕度肽相较安慰剂均可显著降低体重。基于疗效估计目标,第 32 周时,玛仕度肽 4 mg、6 mg 和安慰剂组体重较基线百分比变化的均值分别为−10.97%、−13.38%和−0.24%;第 48 周时分别为−12.05%、−14.84% 和 −0.47%。
第 32 周时,玛仕度肽 4 mg、6 mg 和安慰剂组体重较基线降幅 ≥5% 的受试者比例分别达 76.3%、84.0% 和 10.9%。第 48 周时,玛仕度肽 4 mg、6 mg 和安慰剂组体重较基线降幅 ≥15% 的受试者比例分别达 37.0%、50.6% 和 2.1%。
此外,玛仕度肽可明显降低超重或肥胖受试者的肝脏脂肪含量:
在基线肝脏脂肪含量 ≥5% 的受试者中,第 48 周时,玛仕度肽 4 mg、6 mg 和安慰剂组受试者全肝平均脂肪含量相对基线的百分比变化均值分别为 −63.26%、−73.18% 和 +8.20%;
在基线肝脏脂肪含量 ≥10% 的受试者中,第 48 周时,玛仕度肽 4 mg、6 mg 和安慰剂组受试者全肝平均脂肪含量相对基线的百分比变化均值分别为 −65.85%、−80.24% 和 −5.27%。
详细结果如下:
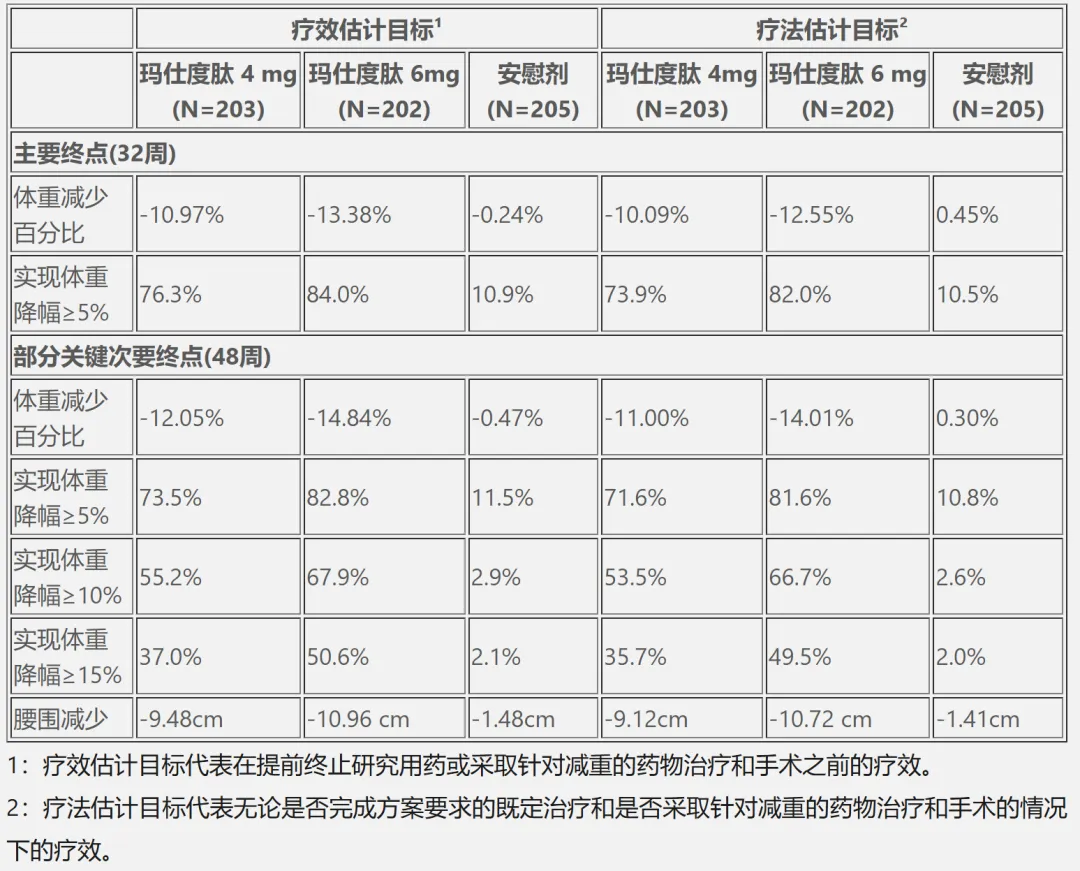
截图来自:信达生物官网
GLP-1R 靶点近年大热,基于在肥胖症和糖尿病为主的代谢类疾病上的优异表现备受看好,已经带动礼来和诺和诺德市值大涨,使前者成为全球市值第一的 MNC 企业。而信达慧眼独具,早在 2019 年 8 月就与礼来达成合作,在中国开发玛仕度肽。这也使其研发进度遥遥领先,如今领先于国内其他药企,率先获批上市。
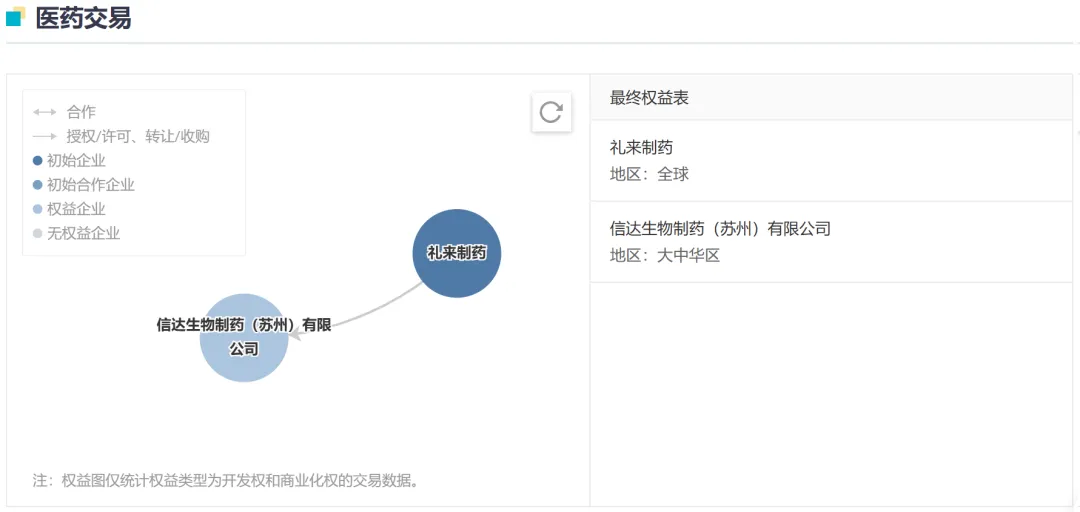
截图来自:Insight 数据库
除本次首批的肥胖适应症以外,玛仕度肽另有一项 NDA 已于 2024 年 8 月获 CDE 受理,正在审评审批中,适应症为:成人 2 型糖尿病患者的血糖控制(受理号:CXHS2400070/1/2)。根据 Insight 数据库「中国上市策略 & 时长预测」模块,该项适应症申请有望在年内获批。
2025 年度是信达在肿瘤以外的综合产品线的「破局之年」。3 月份,首款眼科新药「替妥尤单抗」获批上市;去年 9 月报产的银屑病新药「匹康奇拜单抗」也有望在 2025 年末获批。如今,玛仕度肽又作为慢病领域代表性产品之一重磅登场。
作为一款高潜大单品,玛仕度肽也是承托起信达在 2027 年度达成 200 亿元销售额「小目标」的重要成员之一。毕竟,礼来的替尔泊肽自 2022 年获批之后,次年即空降全球药品销售额 TOP100,隔年即成为年销 164.7 亿美元的超级重磅炸弹,创下史无前例的增速纪录。
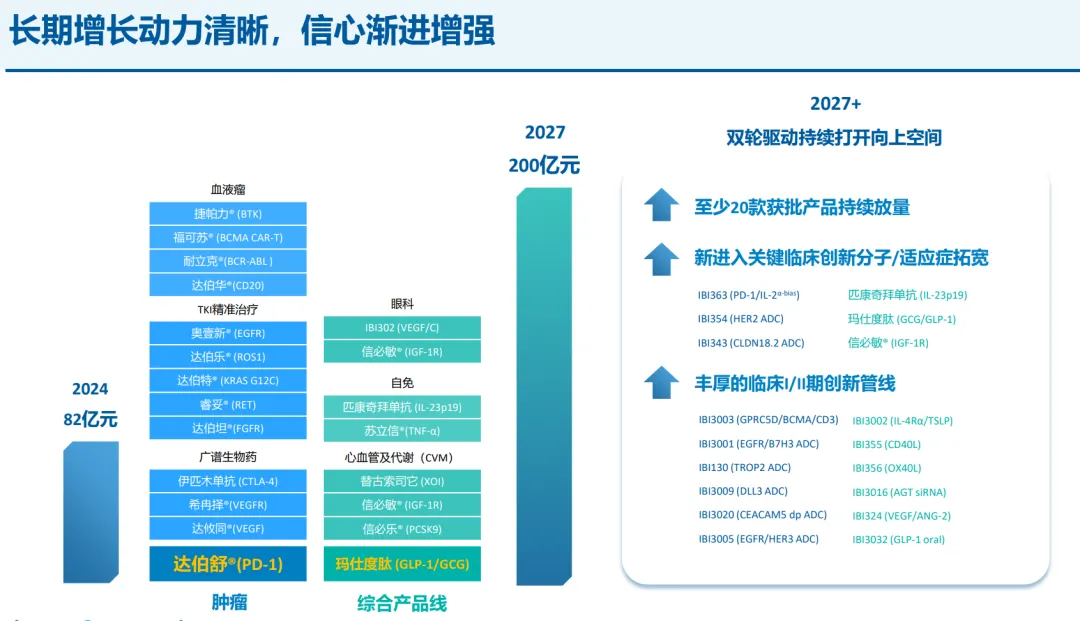
截图来自:信达生物 2024 年报 PPT
玛仕度肽在慢病领域进行了积极深入的探索,当前共开展了 7 项 III 期临床研究,其中 GLORY-1、DREAMS-1 和 DREAMS-2 研究均已达成终点:
在中国超重或肥胖受试者中开展的 GLORY-1
在中国中重度肥胖受试者中开展的 GLORY-2
在中国超重或肥胖合并 MAFLD 受试者中开展的对比玛仕度肽和司美格鲁肽的 GLORY-3
在初治的中国 2 型糖尿病受试者中开展的 DREAMS-1
在口服药物治疗血糖控制不佳的中国 2 型糖尿病受试者中开展的对比玛仕度肽和度拉糖肽的 DREAMS-2
在中国 2 型糖尿病合并肥胖的受试者中开展的对比玛仕度肽和司美格鲁肽的 DREAMS-3
在中国阻塞性睡眠呼吸暂停合并肥胖患者中开展的 GLORY-OSA
已公布 III 期临床结果
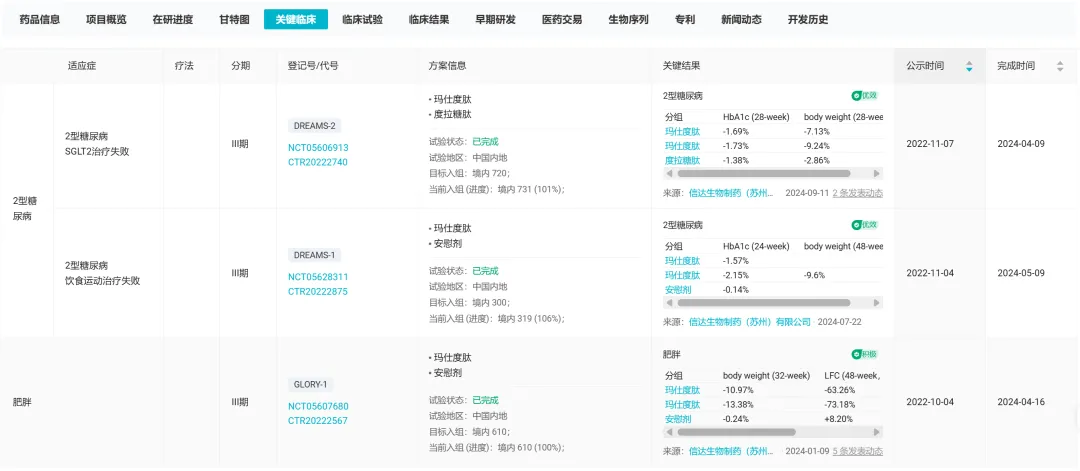
截图来自:Insight 数据库
不过,虽然为首款国产 GLP-1R/GCGR 双靶点激动剂,玛仕度肽在国内的上市仍将面临竞争对手的挑战:两大 GLP-1 巨头诺和诺德的司美格鲁肽、礼来的替尔泊肽也已经在国内获批了糖尿病及肥胖适应症。
但基于对自家产品的信心,信达已经迎难直上,针对以上两者开展了头对头的直接 PK:头对头司美格鲁肽,GLORY-3 和 DREAMS-3 两项 III 期临床试验正在进行中;头对头替尔泊肽,信达开展了一项玛仕度肽高剂量版本(15mg)的 I/II 期头对头研究。
放眼全球,从同机制角度,勃林格殷格翰/Zealand 的 Survodutide 也已经开发至临床 III 期,进度仅次于玛仕度肽;阿斯利康的 AZD9550、信立泰引进的 DD01、图微安创的 TB001、Altimmune 的 Pemvidutide、默沙东/韩美制药的 Efinopegdutide 等均处于 II 期临床。

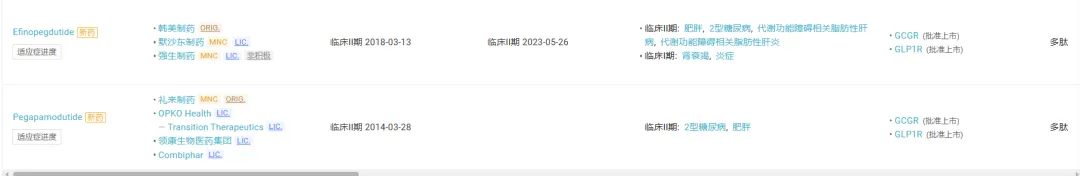
截图来自:Insight 数据库
不过近年来,三靶点热潮涌动,全球已有 14 款进入临床开发,布局企业包括 MNC 的礼来、诺和诺德,国内的恒瑞、华东医药、中新、联邦、民为、东阳光。虽然除礼来外还未有企业将该类药物推进至 III 期,但后续随着临床结果的释放,撼动减重领域的可能性犹未可知。

 产业资讯
产业资讯
 药智数据
药智数据  2026-02-12
2026-02-12
 19
19

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2026-02-12
2026-02-12
 19
19

 产业资讯
产业资讯
 bioSeedin柏思荟
bioSeedin柏思荟  2026-02-12
2026-02-12
 16
16