 产业资讯
产业资讯
 研发客
研发客  2025-06-28
2025-06-28
 827
827
香港特別行政区政府卫生署、香港药物及医疗器械监督管理中心筹备办公室助理署长陈诗涛,在香港卫生署今日正式公布“香港药物及医疗器械监督管理中心”(以下简称香港药械监管中心,CMPR)成立时间表及新药“第一层审批”路线图后,第一时间告诉研发客说:“成立香港药械监管中心(CMPR)及推行第一层审批,可以让国内外企业在制定药械产品上市策略时多一个选择。以国内企业来说,创新药可选择香港为其中一个率先上市和注册的地区。我们亦会即极争取获得其他药械监管机构的信赖和认可,让香港审批的药械产品更快获得新兴市场的接纳及审批。由此,可助力国内创新药械产品出海。 ”
香港生物医药创新协会会长卢毓琳也向研发客表示:“这一消息对于当下国内众多希望出海的创新药企业意义更为重大,因为香港是助力它们迈向国际的关键一步。”
香港媒体评价认为,这一举措标志着香港向建设国际医疗创新枢纽迈出关键一步。根据规划,该中心将于2026年底正式成立,并计划于同年第四季度举行开幕仪式。香港卫生署将从2026年起分阶段推行“第一层审批”新药注册机制,预计到2030年全面实施。
整合监管职能,打造国际权威
香港卫生署署长林文健医生表示:“特区政府致力于将香港建设成为全球领先的创新科技枢纽,其中医疗创新是关键领域。'香港药械监管中心'成立后,将整合西药、中药及医疗器械的监管职能,全面提升现行制度。”该中心的愿景是“创新进取、追求卓越、专业权威、誉满全球”,目标是发展成为能够独立审批新药物和医疗器械注册申请的国际权威监管机构,推动本地医学研发和测试产业发展。
林文健强调,中心将通过优化药械监管促进创新与研发,让患者早日受益于最新科研成果,使病人能够及时获得经证实安全有效的创新药械,同时推动本地医疗及生物科技产业发展。
筹备工作紧锣密鼓
据悉,香港卫生署已于2024年6月成立“香港药械监管中心”筹备办公室。过去一年来,筹备工作主要聚焦三大核心方向:促进优质监管、推动药械创新以及加强内地与国际合作。
CMPR未来重点工作包括:
1)制定新法例及修订现行监管药剂制品的法例,赋予中心监管西药和中药的法定权力,并建立医疗器械法定监管制度;
2)持续提升专业能力,包括加强检测分析能力、审评能力和检查能力,强化监管效能,分阶段推行新药"第一层审批"机制;
3)深化与本地、内地及国际监管机构的合作,争取国际认可,计划于2025年11月举办PIC/S周年研讨会,并争取在2025至2027年间加入ICH成为监管机构成员;
4)配合将于今年第四季度公布的《中医药发展蓝图》,完善中药规管制度,发挥香港作为国家推动中医药国际化桥头堡的作用。
“第一层审批”分阶段推进
在药品审批制度改革方面,特区政府自2023年11月起实施“1+”机制,即新药如能提供符合要求的本地临床数据并经本地专家认可,只需提交一个(而非原来的两个)参考药物监管机构的许可便可申请注册。这一机制已于去年11月扩展至所有新药。
数据显示,自“1+”机制实施以来,已有11款新药通过该机制获批注册,其中5款(包括治疗大肠癌、阵发性夜间血红蛋白尿症等药物)已纳入医院管理局药物名册,实现了"好药港用"的目标。
林文健透露,卫生署正在积极推进各项准备工作,包括2025年第二季制定"第一层审批"路线图,制定良好作业指引、改善电子注册平台、引入新的申请类别和收费模式等。从2025年第三季起,将与持份者建立伙伴关系,共同探讨改善监管制度及精简申请程序的可行措施。
“第一层审批”将自2026年起分四期实施,首阶段将涵盖已注册化学和生物元素产品的延伸应用(如新适应症、新剂型等)的注册申请,逐步扩大适用范围,预计2030年全面推行,届时将涵盖所有药械产品。林文健强调,“第一层审批”将全面审评药物上市前和上市后的安全、效能和素质,涵盖整个产品生命周期。
卢毓琳表示,过去10年,在中国医药创新促进会宋瑞霖执行会长和他的大力推动下,CMPR的动议得以成立。此次,香港制定了明确且具体的实施计划与路线图,原本预计需要7年达成的目标,如今期望能在3年内实现。
“尽管相关规划仍在推进落实阶段,但香港特区政府正以务实的工作作风,稳步推进各项举措,集中资源与精力全力落实。这一态势与当下中国药企出海的大趋势高度契合,香港凭借其独特的优势,在中国药企出海中占据重要的战略地位。”卢毓琳说。
定位国际,发展长远
根据长远规划,初期“香港药械监管中心”将隶属卫生署,但政府计划未来将其升格为独立的监管机构,以推动机构可持续发展并深化国际合作。2026年,中心将颁布ICH的《临床试验质量管理规范》及PIC/S的《药物分销质量管理规范》等主要良好规范,进一步提升监管水平。
业界普遍认为,这一系列改革将显著提升香港在药械监管领域的国际地位,为香港特区乃至国家的医疗健康产业发展注入强大动力,同时为创新药械的研发和应用创造更有利的环境。通过建立与国际接轨的监管体系,香港有望成为全球医药创新和产业发展的重要枢纽。
不过,陈诗涛坦言,在实施过程中,主要挑战在于最主要是专业能力的构建及争取获得其他药监的认可及信赖。“我们定位是要成为国际权威监管机构,CMPR会积极与包括NMPA等全球具有国际化视野和经验的顶尖级监管人员共同合作,致力于达到目标,这将是一个持续努力的过程。”陈诗涛说。
CMPR成立时间表
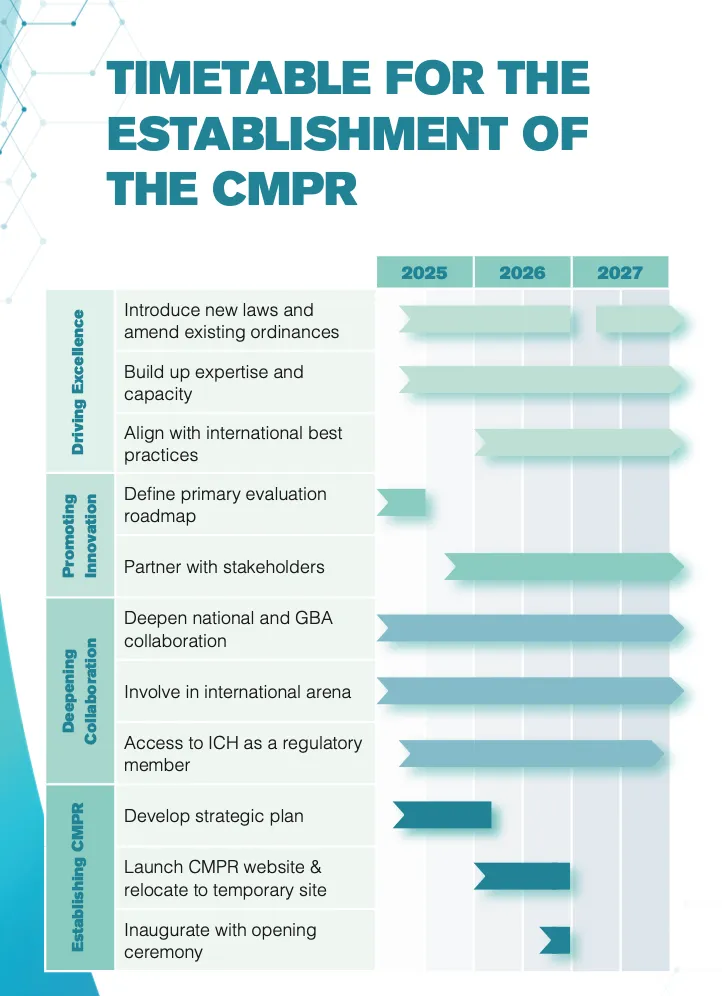
来源:《The Hong Kong Centre for Medical Products Regulatory.Towards Primary
Evaluation》

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 116
116

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 105
105

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 106
106