 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-07-02
2025-07-02
 624
624
2025年6月30日,国家药监局(NMPA)一纸批文点燃希望:恒瑞医药1类新药艾玛昔替尼(艾速达®)正式获批用于成人重度斑秃,成为国产首款口服斑秃靶向药(受理号:CXHS2400089)。

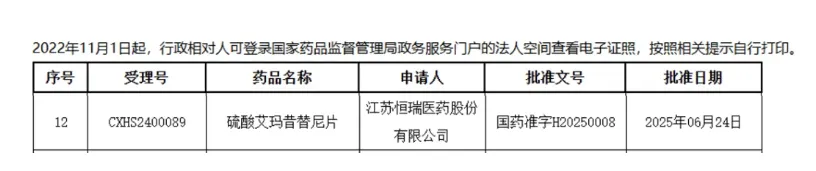
这是继强直性脊柱炎、类风湿关节炎、特应性皮炎三大适应症后,艾速达®在今年连续斩获的第四大适应症。
艾速达®是中国首个自主研发的高选择性JAK1抑制剂,采用“2个双环+1个单环”的优化结构,能够对JAK1精准实现“锁匙匹配”。其获批彻底打破了我国长期以来JAK1抑制剂的进口垄断局面,为斑秃临床管理带来了“中国创新方案”。
艾速达®此次获批是基于一项随机、双盲、安慰剂对照III期临床试验的积极数据9。该研究在中国31家医院同步开展,入组了330例成人重度斑秃患者(头皮脱发面积≥50%,包括全秃/普秃),分别予以艾速达®4mg QD、8mg QD治疗或安慰剂。研究的主要终点为在第24周时达到SALT评分≤20(即头皮脱发面积≤20%)的患者比例,次要疗效终点包括不同时间节点的SALT评分、受试者整体评分(头发再生满意度和毛发再生可接受度)及安全性数据。

结果显示,治疗第8周,4mg组和8mg组SALT评分≤20应答率均高于安慰剂组;第24周,4mg组和8mg组SALT评分≤20应答率分别为34.9%和40.6%。
52周治疗期间SALT评分持续降低;第52周,4mg组和8mg组SALT评分≤20应答率分别为46.8%和63.1%。随症状改善,患者对头发再生的满意度与接受度显著优于安慰剂组。
安全性方面,整体安全性好,24周核心治疗期不良事件(TEAEs)发生率与安慰剂组相似,且一天一片(4mg),口服便捷,有助于提高患者治疗依从性。
艾速达获批打破了我国长期以来JAK1抑制剂的进口垄断局面,为斑秃临床管理带来了“中国创新方案”。值得一提的是,恒瑞对于艾玛昔替尼的规划,除了以上布局的口服片剂,还包括了皮肤制剂和外用混悬剂。其中皮肤制剂已于 2025 年 2 月在国内申报上市,拟用于成人轻度至中度特应性皮炎的局部外用治疗。恒瑞医药多年来持续围绕临床急需进行创新研发,已在国内获批上市23款1类创新药,4款2类新药,另有90多个自主创新产品正在临床开发,约400项临床试验在国内外开展。除了深耕传统优势的肿瘤领域,公司还在代谢和心血管疾病、免疫和呼吸系统疾病、神经科学等领域也进行了广泛布局。在自身免疫领域,经过多年的沉淀和布局,公司迎来研发突破,目前自免领域公司除已经获批上市的夫那奇珠单抗和艾玛昔替尼,还有6款产品在研。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 713
713

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 728
728

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 687
687