 产业资讯
产业资讯
 药时空
药时空  2025-07-12
2025-07-12
 728
728
2025年7月10日,美国食品药品监督管理局(FDA)宣布了一项重大举措:首次公开了200多封完整回应函(CRLs),这些信件涉及2020年-2024年间发出的药物/生物制品CRL档案。此举旨在提高监管透明度,减少制药行业的“猜测游戏”,让公众确切知道这些药物被拒绝批准的原因,以便制药企业更快解决审批障碍。

不过值得注意的是,FDA公开的内容中只有某些信件被共享,且部分信件存在时间范围不符(发生在FDA所说的四年时间框架之外)、且内容进行了脱敏处理。
1、什么是CRL?为何FDA现在选择公开?
CRL(Complete Response Letter,完整回复函)是美国FDA对新药申请(NDA/BLA)或补充申请(sNDA/sBLA)发出的拒绝批准通知。这种情况下,申请方往往需要投入更多的时间和资源来应对FDA的要求,进一步延长了药物上市的时间。
FDA可能给出CRL的常见原因包括:
安全性或有效性问题:临床试验数据未能充分证明药物的疗效或安全性。、
生产和质量控制问题:生产工艺、设备、质量管理体系不达标,可能影响药品质量。
数据完整性问题(Data Integrity Issues):数据被篡改、缺失或不符合要求,影响FDA对药品的评估。
监管合规性问题:如GMP(良好生产规范)违规、未能满足 FDA 的检查要求等。
过去,FDA极少公开CRL,导致制药公司常隐瞒关键问题,甚至误导投资者。根据FDA的声明,该机构2015年进行的一项分析发现,85%的公司在宣布其申请被拒绝时未提及FDA对安全性和有效性的担忧。
FDA在其声明中说:“从未批准中吸取的教训也没有在行业内分享,导致公司一再犯类似的错误。”FDA局长Marty Makary表示,长期以来,药企在与FDA打交道时一直在玩“猜谜游戏”,药企和投资者都希望提供可预测性,最终让患者更快获得有效治疗。
2、公开的CRL包含哪些内容?
此次FDA首批公开的200多份CRL均与后来获得批准的药物申请相关。这一策略选择显示出FDA在透明度和保护商业利益间的平衡考量。公开前,FDA对文件进行了必要处理,删除了商业秘密和机密商业信息,既保护了企业核心利益,又确保了公众能获得关键监管信息。
FDA表示这些信件均在2020年-2024年之间发出,涉及品牌药和非专利药。然而,某些共享的CRL远远超出了这个范围,例如2008年拒绝批准Kyowa Kirin的istradefylline(现在以 Nourianz 出售)治疗帕金森病“关期退化”。该药物于2019年获得批准。该机构没有回答有关时间框架差异的问题。
据了解,此次披露的CRL,绝大部分是505b(2)路径的改良药和351k路径的生物类似药,同时也涉及几十款创新药。很多产品被拒绝批准的原因具有广泛的代表性,如生产问题,临床治疗格局变化问题,生物分析方法问题等。
这些历史档案已在FDA的开放数据平台(openFDA)上线。根据FDA的说法,此次发布的CRL是“初始批次”,未来还将继续从档案库中发布更多CRL,并持续探索提高决策透明度的方式。
以下为此次FDA公开的CRL文件及部分信件截图:
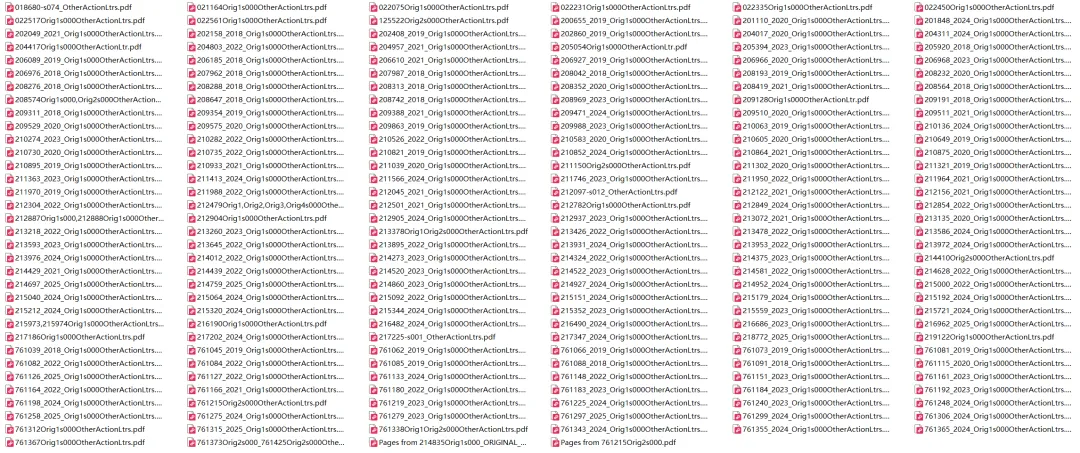
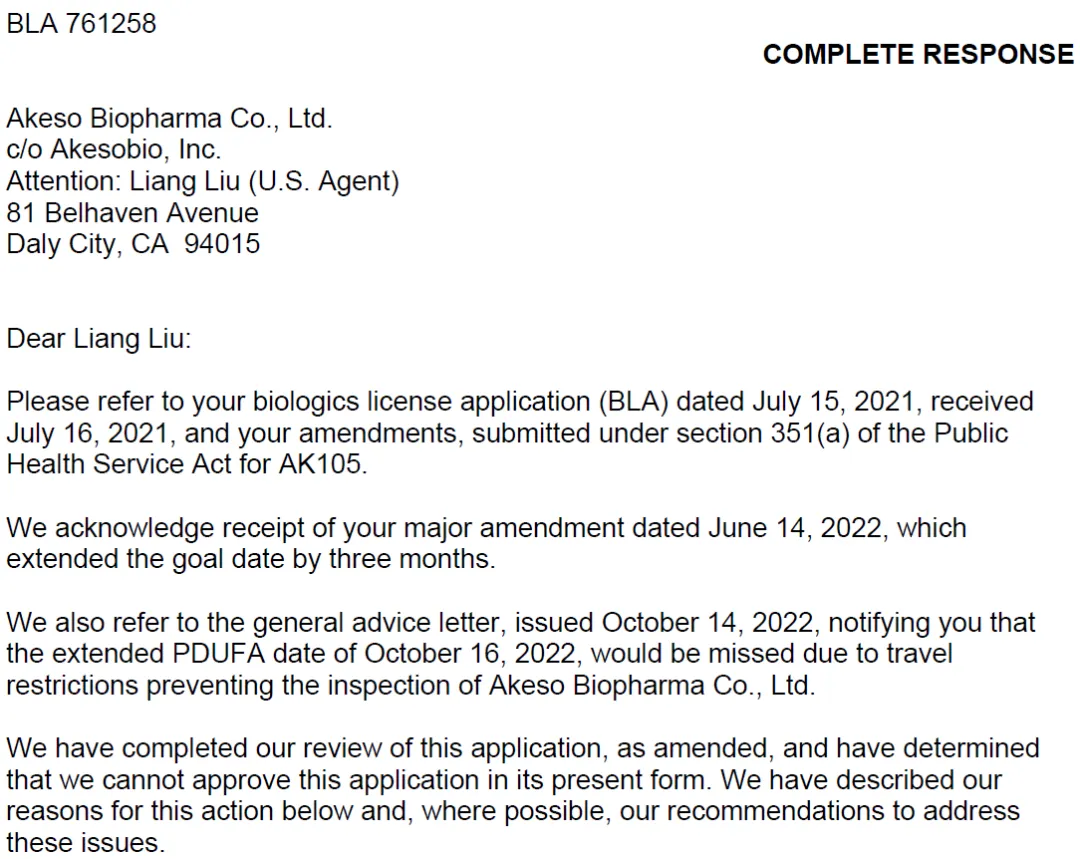

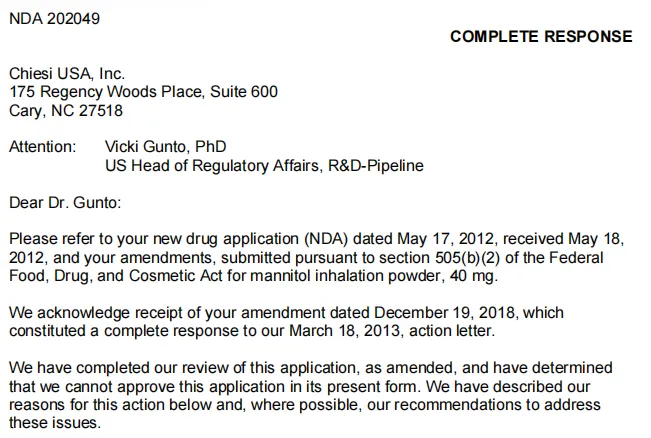
进入此链接或点击【阅读原文】即可进入下载上述文件:https://open.fda.gov/apis/other/approved_CRLs/

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 660
660

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 671
671

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 636
636