 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-07-12
2025-07-12
 834
834
7 月 10 日,中国药物临床试验登记与信息公示平台显示,信诺维 1 类新药注射用 XNW27011 登记了一项 III 期临床。公开资料显示,这是该药启动的首个 III 期。

截图来源:药物临床试验登记与信息公示平台
此次启动的是一项针对局部晚期或转移性胃/胃食管结合部腺癌患者进行的 III 期研究,旨在比较 XNW27011 和研究者选择的治疗在后线治疗胃或胃食管结合部腺癌的疗效。该试验拟在国内入组 375 人,研究的主要终点为无进展生存期和总生存期。已披露的给药方案如下:
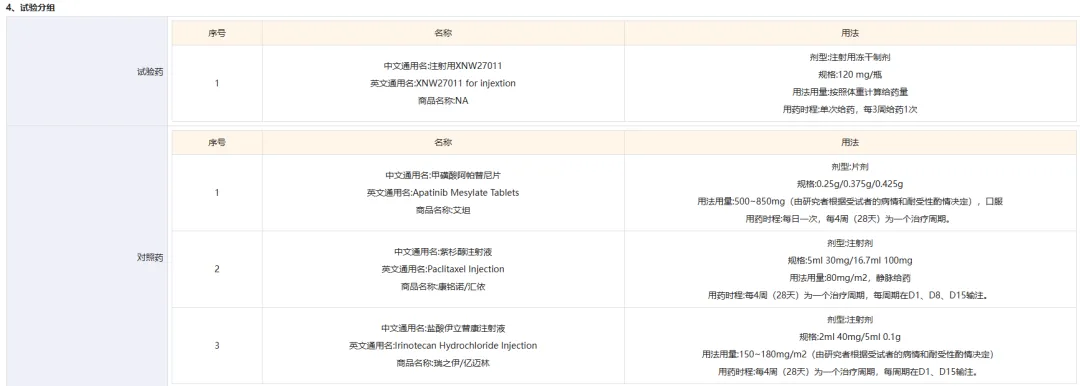
截图来源:药物临床试验登记与信息公示平台
XNW27011 是信诺维开发的新一代抗体偶联药物(ADC),靶向 Claudin18.2。2024 年 6 月,XNW27011 获得 FDA 授予快速通道资格,用于治疗胃癌。2025 年 5 月,该药被 CDE 纳入突破性治疗品种名单,用于 CLDN18.2 表达的局部晚期不可切除或转移性 HER2 阴性胃或胃食管结合部腺癌的三线及以上治疗。
2024 年 ESMO 大会上,信诺维公布了 XNW27011 针对局部晚期和/或转移性实体瘤患者的首次人体 I 期临床研究结果。在该研究中,XNW27011 剂量从 0.6 mg/kg(每三周一次,静脉注射)开始,采用加速剂量递增方案,随后进行 3+3 递增。剂量递增阶段的主要目标是确定最大耐受剂量 (MTD)。
截至 2024 年 4 月 15 日,共入组 16 例患者,剂量范围从 0.6 mg/kg 至 6.0 mg/kg,分为 6 个剂量组,包括 11 例胃癌/胃食管交界处腺癌、2 例卵巢癌、2 例前列腺癌和 1 例十二指肠壶腹部周围腺癌。12 例患者存在不同程度的 CLDN18.2 表达(≥1%,IHC≥1+)。
在剂量限制性内镜(DLT)治疗期间,最常见的不良反应(AE)为恶心和呕吐,其次是白细胞减少、中性粒细胞减少和贫血。在剂量限制性内镜治疗期间,4.8 mg/kg 剂量以下未观察到≥3 级 TRAE。未观察到 ILD 或 MMAE 相关的眼部不良反应和周围神经病变。1 例患者在 6.0 mg/kg 剂量下出现 DLT。
14 例患者可评估疗效,具体数据如下表。即使剂量低至 0.6 mg/kg,也观察到疗效。先前接受过 PD-1 免疫疗法、伊立替康或 CLDN18.2 抗体治疗的患者似乎未对疗效产生影响。

截图来源:ESMO 官网
综上,研究认为,XNW27011 表现出良好的安全性,具有较大的治疗窗口,在各种肿瘤类型和 CLDN 18.2 表达水平下均具有优异的初步疗效,并且具有优异的药代动力学特性,包括低有效载荷血浆暴露。
值得一提的是,今年 5 月 30 日,信诺维和安斯泰来就 XNW27011 达成了一项独家许可协议,信诺维授予安斯泰来独家拥有 XNW27011 在全球(除中国大陆、香港、澳门和台湾地区外)开发和商业化的权利。
根据协议条款,信诺维将获得 1.3 亿美元的首付款,并有资格收取最高 7000 万美元的近期付款,以及最高可达 13.4 亿美元的与开发、注册、商业化相关的里程碑付款。此外,XNW27011 获批上市后,信诺维还将获得该产品净销售额的特许权使用费。
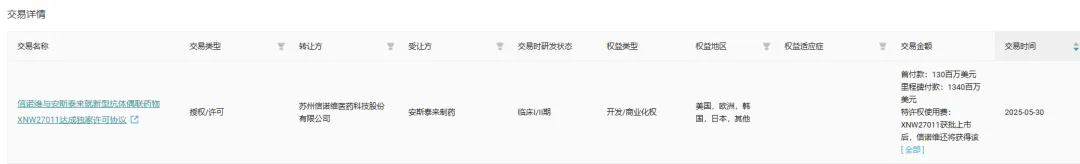
截图来源:Insight 数据库

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 650
650

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 660
660

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 628
628