 产业资讯
产业资讯
 医药魔方
医药魔方  2025-07-15
2025-07-15
 640
640
双载荷ADC通过在单一抗体上同时搭载两种不同作用机制的有效载荷(或同种载荷的不同连接子形式),灵活调控总药物抗体比(DAR),旨在提升药物活性、产生协同效应、增强治疗效果、拓展适应症范围并克服耐药性挑战。
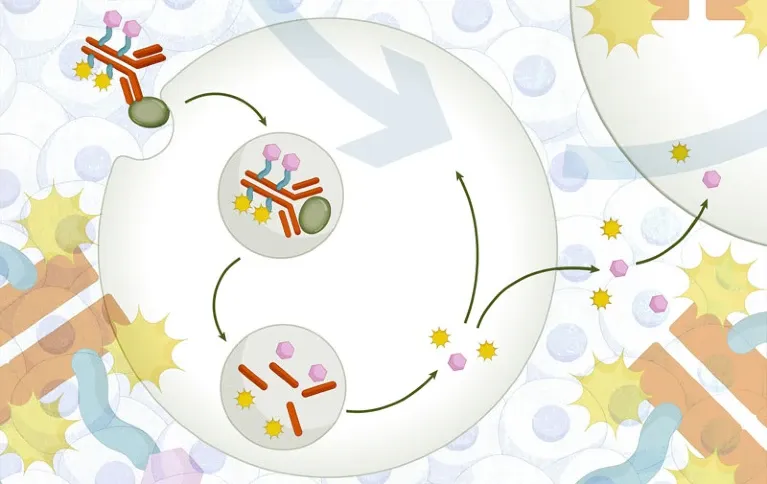
图1. 双载荷ADC示意图(来源:Nature Reviews Drug Discovery)
目前已有两款双载荷ADC进入临床用于癌症治疗,数十款候选药物正处于临床前开发阶段。
该领域的活跃度从融资动态可见一斑:初创公司Callio Therapeutics今年成功完成1.87亿美元融资,用于推进其双载荷ADC管线。公司首席科学官Jerome Boyd-Kirkup表示:“这一领域正经历快速演进。”
表1. 部分在研双载荷ADC
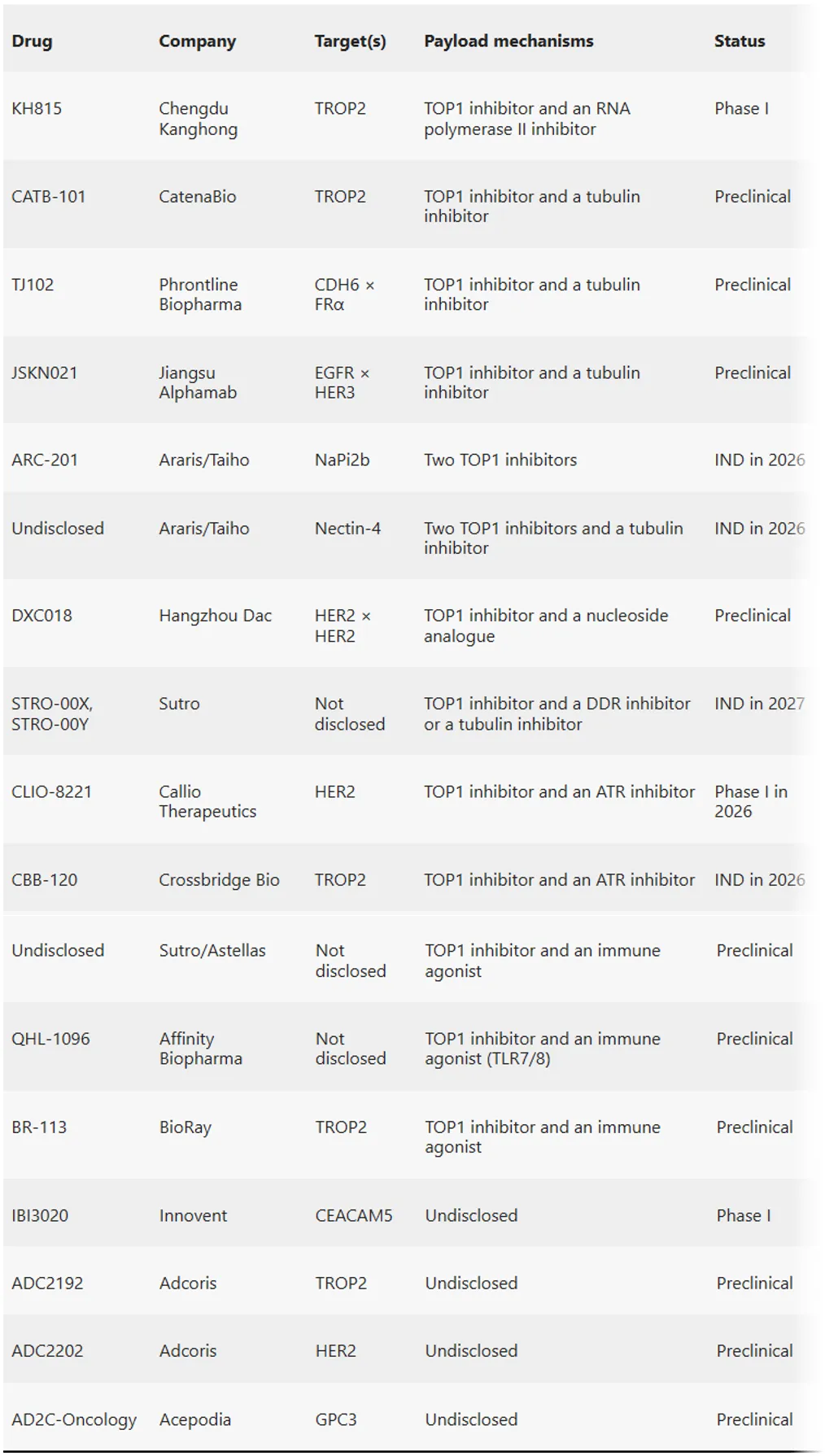
来源:Nature Reviews Drug Discovery
化疗组合先行
成都康弘药业生物新药研究院赵永浩博士指出,现有ADC的临床数据揭示了其局限:虽能在部分癌种中显著延长无进展生存期(PFS),但患者最终难免疾病进展。
癌细胞在细胞毒性药物压力下,极易通过激活替代信号通路或上调药物外排泵等机制产生耐药突变。联合用药是应对此挑战的经典策略,而双载荷ADC则提供了通过单一药物实现协同治疗的创新路径。
双载荷ADC优势在于:肿瘤细胞需同时对两种受抑制的通路产生逃逸突变,难度倍增,可能无法及时积累足够的耐药突变。
关键问题在于:如何选择配对的载荷?
当前公开项目中,拓扑异构酶1(TOP1)抑制剂(如依沙替康及其衍生物德鲁替康)因其高效破坏DNA复制的机制,成为基础载荷的首选。
康弘药业创新性地将依沙替康与靶向转录机制的雷公藤甲素(一种源自中药雷公藤的RNA聚合酶II抑制剂)配对。两者均具备纳摩尔级强效活性至关重要,因为ADC的疗效和耐受性往往受限于效力最弱的载荷。
考虑到TROP2靶向ADC(如戈沙妥珠单抗、德曲妥珠单抗)相比成熟的HER2靶向ADC存在更大的优化空间,康弘药业设计了差异化结构:在抗体Fab臂连接4个依沙替康分子,Fc区平均连接3.5个雷公藤甲素分子(DAR=7.5)。
其关键在于差异化的连接子设计,实现载荷的时序控制释放:依沙替康连接子更稳定,主要在抗体被肿瘤细胞内化后断裂,实现精准杀伤(裂解后释放的游离依沙替康也可产生旁观者效应);雷公藤甲素连接子则设计为在肿瘤微环境中、内化前即断裂,快速清除周边癌细胞,增强整体旁观者效应。
临床前研究显示,候选药物KH815在多种耐药移植瘤模型中(包括对戈沙妥珠单抗或德曲妥珠单抗耐药的模型)展现出显著活性。目前,康弘药业已启动KH815的临床试验患者招募。
除康弘药业外,信达生物的靶向CEACAM5双载荷ADC(IBI3020)也已进入临床阶段,具体载荷组合尚未披露。
三载荷探索同步进行
双载荷并非终点。
Araris公司正探索搭载双载荷乃至三载荷的ADC。其靶向NaPi2b的双载荷ADC结合了依沙替康及其衍生物两种TOP1抑制剂,并通过差异化设计调控旁观者效应:依沙替康发挥主要旁观者作用,而其低渗透性衍生物则专注于增强靶细胞内的直接杀伤。
另一款靶向Nectin-4的三载荷ADC则同时整合了两种TOP1抑制剂和微管蛋白抑制剂MMAE。这两类载荷在靶向Nectin-4的应用中均经过充分验证。MMAE诱导的免疫原性细胞死亡(ICD)特性,还为其与免疫检查点抑制剂的联用提供了潜在可能。值得注意的是,TOP1抑制剂联合微管蛋白抑制剂(如MMAE)也是多家公司的重点研究方向。
连接子技术是此类复杂ADC成功的关键。Araris采用独特的支链肽连接子技术,通过单一亲水性连接子将所有载荷分子定点偶联至抗体的特定谷氨酰胺位点。该设计既能维持ADC稳定性,又能有效屏蔽疏水性载荷,减少非靶组织摄取;其优化的裂解动力学避免了细胞内化后载荷的瞬时爆发释放。2025年3月,大冢制药子公司Taiho Pharmaceutical以4亿美元收购了Araris,充分认可了其连接子平台的价值。
拓展新型载荷组合
部分企业正突破传统化疗载荷的范畴,探索更具机制协同性的新型组合。其中,靶向DNA损伤修复(DDR)通路的药物与TOP1抑制剂的联用备受关注。
其科学依据在于:肿瘤细胞常通过上调DDR通路修复TOP1抑制剂造成的DNA损伤以获得耐药性;反之,抑制DDR则会使肿瘤细胞对TOP1抑制异常敏感。ATR作为DDR的关键调控因子,成为极具潜力的组合靶点,其抑制对肿瘤细胞具有选择性毒性。
Callio Therapeutics的靶向HER2双载荷ADC CLIO-8221(HMBD-802)正是此策略的代表,以4+4的DAR组合TOP1抑制剂与ATR抑制剂。非人灵长类动物高剂量实验未显示意外的协同毒性,公司计划于2026年第一季度启动首次人体试验。该策略有望克服HER2低表达肿瘤对现有ADC反应不佳的难题。
CrossBridge Bio同样聚焦TOP1和ATR的组合。其通过系统的游离药物筛选矩阵锁定协同效应最优的配伍。关键体内实验数据显示:其专有支链连接子技术的双载荷ADC在对德曲妥珠单抗(基准ADC)和单载荷ADC(50%应答率)无效的耐药模型中,实现了100%的应答且持续超过120天,展现出显著优势。
此外,Sutro也在探索TOP1抑制剂与DDR抑制剂的组合(具体靶点未公开),其AACR会议数据表明抑制PARP可增强TOP1抑制剂效果。
免疫刺激策略
免疫疗法与ADC具有天然互补性:前者效应持久但对高肿瘤负荷效果有限;后者减瘤能力强但易耐药。
双载荷ADC提供了将细胞毒素与免疫刺激剂整合于单一分子的可能,旨在通过ADC减瘤为免疫激动剂激活免疫系统创造条件,实现协同增效。
尽管诺华、Tallac Therapeutics等公司在抗体-免疫刺激剂偶联物(ISAC)领域已有探索,临床突破尚待实现。免疫刺激性双载荷ADC(iADC)是此概念的深化。Sutro与安斯泰来的合作项目包含两款此类iADC,其中一款正在进行IND申报所需的临床前毒理研究。
临床数据揭晓在即
随着首批双载荷ADC进入临床,人体数据即将揭晓。I期研究的首要关注点仍是安全性。不同载荷组合的毒性特征各异,例如康弘药业KH815中的依沙替康和雷公藤甲素均存在血液学毒性(如中性粒细胞减少)风险,其叠加效应需密切监测。
此外,缓解率与持久性等疗效指标同样至关重要。需要注意的是,不同双载荷ADC在靶点、载荷、适应症乃至连接子设计上的巨大差异,使得单个项目的成败难以直接推及整个领域。
连接子策略的多样性尤为显著:Callio与CrossBridge采用支链连接子;Sutro与康弘药业为不同载荷设计独立连接子;Araris则融合两者之长。这些设计直接影响ADC的稳定性、裂解动力学、生产可行性和最终命运。首批临床数据的解读需要结合具体技术路线进行,其结果值得期待。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 648
648

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 658
658

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 625
625