 产业资讯
产业资讯
 研发客
研发客  2025-07-16
2025-07-16
 936
936
•自体生成CAR-T有望突破传统体外CAR-T诸多局限,未来定价可能较传统CAR-T低一个数量级;
•全球范围内真正突破tLNP-mRNA自体生成CAR-T技术壁垒的企业不多;
•云顶新耀和tLNP-mRNA自体生成CAR-T领域领先公司Capstan的技术路径和开发进度类似;
•今日,EVM14的IND获CDE正式受理,EVM14成为云顶新耀首个实现“中美双报”的mRNA肿瘤治疗性疫苗;
•云顶新耀的mRNA管线已吸引多家MNC的关注和接洽。
自体生成CAR-T(in vivo CAR-T)正成为跨国药企竞逐的新战场。
今年上半年,该领域已接连诞生重磅交易。3月,阿斯利康以10亿美元收购专注于慢病毒载体(ENaBL)体内细胞疗法的EsoBiotech。6月,艾伯维以21亿美元将基于靶向LNP(tLNP)-mRNA 技术路线开发自体生成CAR-T疗法的Capstan收入麾下。
自体生成CAR-T受到重视是因为其有望突破传统体外生成CAR-T的局限:成本高、制备周期长、需提前化疗清淋和潜在安全风险等问题,同时还可能进一步拓展CAR-T疗法针对自免等相关疾病的治疗深度。
Capstan是目前tLNP-mRNA自体生成CAR-T领域最具代表性的公司。在国内,作为较早涉足该领域的公司之一,云顶新耀的技术路径与Capstan类似,同样聚焦于通过LNP递送mRNA,在无需体外细胞改造的情况下实现体内CAR-T的生成。
该技术路径的关键在于要将mRNA“信息即药物”的特性与CAR-T的精准靶向能力完美结合,把人体自身变成生产药物的“智能工厂”。
“通过自研的AI+mRNA平台,云顶新耀只押注可以改变世界的技术。”正如云顶新耀首席执行官罗永庆所言,“目前全球范围内真正突破该路径相关技术壁垒的企业很少,而我们之所以全力押注该领域,是因为相信其可以改变行业格局,为疾病治疗带来革命性的突破。”
据介绍,云顶新耀的自体生成CAR-T项目已取得多项临床前验证成果。在人源化小鼠模型中,云顶新耀通过多轮给药实现了有效的肿瘤细胞清除。在非人灵长类动物(猴)模型中,已验证T细胞的转染、CAR的表达以及B细胞的清除效果。
这些数据为后续临床转化奠定了基础,云顶新耀预计在今年会推出其首个自体生成CAR-T临床前候选药物,用于肿瘤及自身免疫性疾病。
多家MNC同台竞技
自体生成CAR-T产品的研发主要分为两大技术路线:一种是依靠病毒载体(LV和AAV)将表达CAR的基因递送到T细胞,直接在患者体内原位编辑为CAR-T;另一种则是依靠纳米颗粒(LNP、PBAE等)进行递送,该领域比较具有代表性的tLNP-mRNA自体生成CAR-T疗法就是采用第二种技术路线。
与应用病毒载体路线开发的自体生成CAR-T相比,后者的优势在于其不会改变患者T细胞的基因组,理论上安全性更高。此外,在生产成本和工艺方面也更具优势。不过,其瞬时性能否像传统CAR-T那样为患者带来长期获益,还有待未来临床进一步验证。
布局病毒载体相关产品的MNC包括阿斯利康、安斯泰来和诺华等,以及去年与慢病毒载体体内CAR-T公司Umoja达成合作的艾伯维,艾伯维此次重金收购Capstan正式将tLNP-mRNA技术纳入了跨国药企的自体生成CAR-T竞赛。
目前,第一种路线产品的临床进度相对更快,已有一些早期人体数据被公开。7月2日,《柳叶刀》刊登了EsoBiotec与普瑞金联合开发的一款自体生成BCMA CAR-T(ESO-T01)治疗复发或难治性多发性骨髓瘤(r/r MM)的首次人体数据,结果显示4例受试者中有2例在随访期内达到严格的完全缓解(sCR),另外2例获得部分缓解(PR)。

第二种路线的技术壁垒相对更高,全球进度最快的Capstan的候选产品于今年6月刚刚进入临床。
6月19日,Capstan公司的科学创始人、CAR-T领域的先驱Carl June教授作为共同通讯作者在Science杂志上发表的一项研究,展示了tLNP-mRNA自体生成CAR-T产品治疗癌症及自免疾病的潜力。
研究显示,该产品在动物模型中不仅证明了其对肿瘤的有效控制,更在自身免疫疾病动物模型中观察到B细胞的深度清除,引发的“免疫重置”(清除后重新出现的B细胞变为正常初始的B细胞)未来有潜力为自免疾病的长期缓解甚至治愈提供可能。

与传统疗法相比的优势
传统体外生成CAR-T细胞疗法为恶性血液肿瘤带来了颠覆性的突破。然而,目前获批上市及大量在研CAR-T产品,需经历“自体或异体T细胞提取-体外基因改造-扩增回输”的复杂流程,制备周期长,且需进行淋巴耗竭的预处理,还可能伴随细胞因子风暴等严重副作用。
更为关键的是,传统CAR-T疗法单疗程费用常突破百万元,极大限制了药品的可及性。
基于tLNP-mRNA技术的体内CAR-T疗法有望颠覆这一局面。
与传统体外生成CAR-T相比,其潜在优势体现在:现货型供应的体内CAR-T可大规模生产储备(无需病人住院)、无需体外改造T细胞使得成本更低、避免体外生产可能出现的细胞污染和变异风险、无需清淋避免了预处理对免疫系统的损伤等。
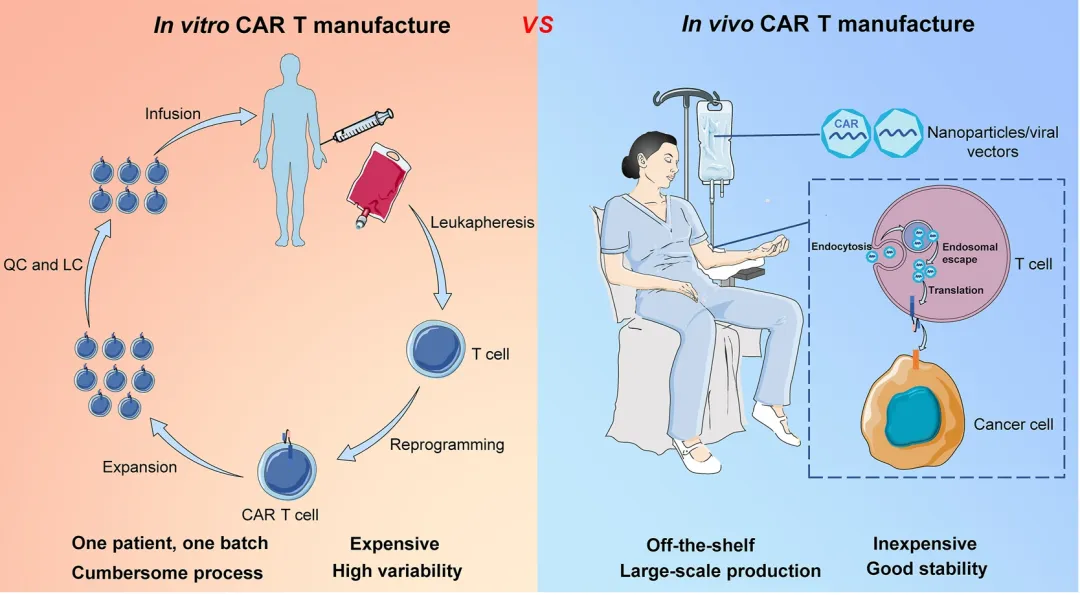
来源|Genes & Diseases
如果说传统CAR-T是“体外定制的精密武器”,自体生成CAR-T更像是“即开即用的智能导弹”。在实体瘤这一传统CAR-T表现不够理想的领域,自体生成CAR-T同样具有潜力。
体外生成CAR-T因受到实体瘤微环境的免疫抑制的影响,T细胞难以实现有效浸润。实体瘤的肿瘤异质性使得不表达CAR靶向蛋白的肿瘤细胞无法被清除,进而导致体外生成CAR-T单次给药效果有限。而由于自体生成CAR-T无需清淋,可通过多次给药持续补充CAR-T,再配合免疫调节药物改善肿瘤微环境,可为实体瘤治疗提供新的思路。
技术壁垒极高
尽管前景广阔,但由于该路线具有极高的技术壁垒,目前全球基于tLNP-mRNA技术路线开发自体生成CAR-T的企业寥寥无几,就连mRNA领域的龙头公司Moderna和BioNTech也尚未涉足。
挑战首先体现在阳离子脂质的优化。云顶新耀通过AI辅助筛选,从自建的包含500多个阳离子脂质库中锁定了在血浆和肝脏可以快速降解的候选脂质,尽可能地避免脂质在肝脏富集带来的毒性。
其次,想要保证靶向递送的精准性,避免mRNA在肝脏等非靶器官蓄积,对偶联技术的开发有非常高的要求,要保证每一批LNP偶联抗体具有稳定性和均一性。
最后,本身非常脆弱的LNP偶联抗体之后,进行放大生产时也会面临相当多的技术壁垒。
“云顶新耀拥有全产业链端到端的能力,基于自身不断迭代的mRNA平台以及过往积累的经验逐步克服了这些技术难点。”罗永庆表示。
从自我造血到创新输出
除自体生成CAR-T外,云顶新耀的核心管线还包括2款mRNA肿瘤治疗性疫苗EVM14和EVM16。
通用型现货肿瘤治疗性疫苗EVM14是基于云顶新耀自主知识产权的mRNA技术平台研发,是一款靶向5个肿瘤相关抗原的通用型的现货肿瘤治疗性疫苗,拟用于鳞状非小细胞肺癌、头颈鳞癌等瘤种的治疗。
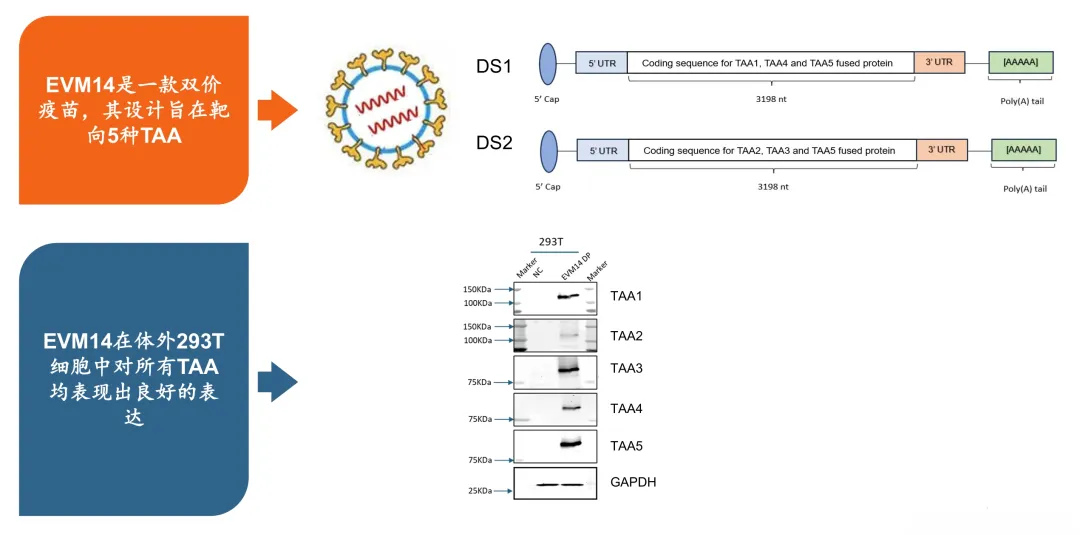
来源|云顶新耀
临床前研究显示,EVM14能诱导剂量依赖性免疫应答,在小鼠模型中显著抑制肿瘤生长,并诱导免疫记忆,具有有效降低肿瘤复发及转移的潜力。此外,研究还支持未来其与免疫检查点抑制剂联合用药的探索。
7月15日,EVM14的新药临床试验申请(IND)获CDE正式受理。今年3月,EVM14的IND已获美国FDA批准。EVM14成为了云顶新耀首个实现“中美双报”的mRNA肿瘤治疗性疫苗。
EVM16则是一款AI算法驱动识别肿瘤新抗原的新型mRNA个性化肿瘤疫苗。云顶新耀通过EVER-NEO-1“妙算”肿瘤新抗原AI算法系统,来设计专属的mRNA疫苗。
EVM16的IIT研究已在今年3月于北京大学肿瘤医院完成首例患者给药,初步数据显示低起始剂量也能激发晚期肿瘤患者特异性T细胞反应,具有良好的免疫原性。临床前数据还证明了EVM16与PD-1抗体联用后具有协同抗肿瘤效果。
这些管线均来自云顶新耀完全整合的端到端AI+mRNA平台,该平台涵盖从抗原设计、mRNA序列优化、LNP递送技术到产业化生产的端到端全产业链流程,且实现了从靶点筛选、序列设计到递送优化以及生产的效率跃升。

来源|云顶新耀
值得一提的是,该平台已在新冠疫苗的开发中得到了临床验证。云顶新耀研发的PTX-COVID19-B在头对头全球II期研究中表现出与辉瑞/BioNTech的Comirnaty疫苗相当的免疫原性与耐受性。
据罗永庆透露,基于该平台产出的管线已吸引多家MNC的关注和接洽。但对于是否要BD,何时BD?云顶新耀并不急切。
“BD的目的是为了价值创造,我们要做正确的BD,与合作伙伴实现优势互补,最大化发挥产品价值,其核心是一场基于长线战略的相互契合。”罗永庆表示,“我们拥有灵活选择权的底气源自对自身mRNA技术平台实力和对这一行业发展前景的信心。”
过去几年,依托“双轮驱动”战略,云顶新耀实现了从授权引进到自主创新的跨越,逐渐从Biotech蜕变为Biopharma。
一方面,三款商业化产品(依嘉®、耐赋康®、维适平®)将不断带来确定性回报;另一方面,自体生成CAR-T技术平台和mRNA肿瘤治疗疫苗平台为其在肿瘤及自免等领域打造核心原研产品,助推BD升温,拓展全球化蓝图。
“我们的目标是在2030年成为亚洲领先的全球综合性生物制药公司,mRNA技术正是实现这一愿景的核心引擎。”罗永庆最后表示。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 641
641

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 650
650

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 619
619