 产业资讯
产业资讯
 医麦客
医麦客  2025-07-22
2025-07-22
 2675
2675
随着老龄化进程的加速,抗衰老逐渐成为热门话题。据公开数据显示,2024 年中国抗衰老市场规模已达 0.6 万亿元,到 2035 年将达到 4.6 万亿元,在银发经济中的占比从 9% 跃升至 15%,人们对抗衰的需求持续增长。
今年 4 月,Cell 杂志发表了题为「From geroscience to precision geromedicine: Understanding and managing aging」的文章,在原来的十二大衰老机制——基因组不稳定性、端粒损耗、表观遗传改变、蛋白质稳态丧失、细胞自噬失能、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间通讯改变、慢性炎症、生态失调的基础上,又增加了细胞外基质变化和心理-社会隔离。
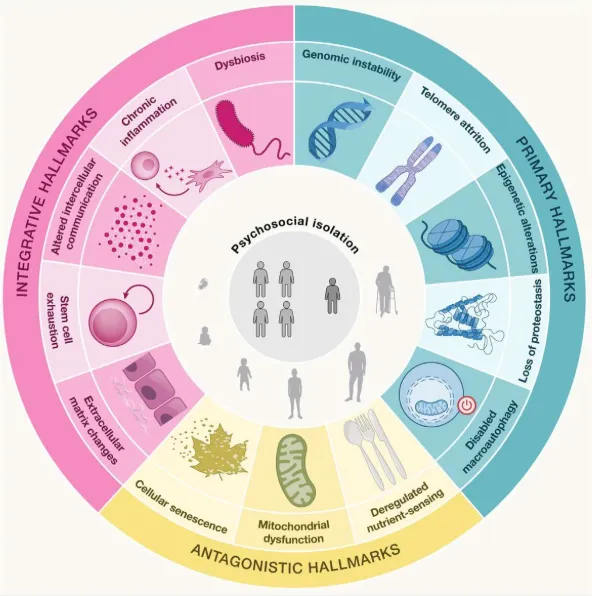
而衰老机制的明确,为 CGT 迈向抗衰提供了更加清晰的思路,推动抗衰创新药朝着「精准设计」的方向发展,在抗衰领域形成了多维度、精准化的干预体系,并从多方向建立起对抗衰老的 「立体防线」,为延缓衰老进程、改善衰老相关症状提供了多种可能性的方案。本文将梳理不同的策略的 CGT 创新疗法抗衰新进展。
对抗慢性炎症
近期,上海环码生物医药有限公司(CirCode)杨赟联合北京大学邓觅、苗蕾研究团队在 Cell 子刊 Cell Reports Medicine 上发表了题为:Cardiolipin-mimic lipid nanoparticles without antibody modification delivered senolytic in vivo CAR-T therapy for inflamm-aging 的研究论文,报道了新型 LNP 递送 circRNA 生成的体内 CAR-T。
研究团队设计了含有新型拟心磷脂磷酰胺(CAMP)脂质的 LNP,增加了硬度和相分离,促进 T 细胞偏向性摄取。此外,环状 RNA(circRNA)表达 CAR 蛋白,可增强脾靶向性并延长表达时间。
研究利用含 CAMP 的 LNP 包封的抗 uPAR(尿激酶型纤溶酶原激活物受体)CAR 蛋白 circRNA,可在单核/巨噬细胞和衰老成纤维细胞中有效表达,具有治疗肝纤维化和类风湿性关节炎(RA)的潜力。研究还设计和筛选人源抗 uPAR 抗原 CAR,有望促进治疗炎症性衰老的体内 CAR-T 疗法的临床转化。
而经过人类单细胞测序证实,uPAR 与类风湿关节炎的细胞衰老和炎症相关。研究团队设计了筛选并人源化抗 uPAR 的单链可变片段(scFv),建立了 PL40-LNP 递送编码的人源化 uPAR CAR mRNA,有助于促进体内 CAR-T 细胞疗法用于治疗炎性衰老疾病的临床转化。
相较于传统 CAR-T,体内 CAR-T 细胞疗法的成本将会大幅度降低,且在体内直接制备 CAR-T 减少了繁琐流程,能更好地适应衰老个体的免疫微环境,减少因细胞提取和体外培养带来的适应性问题,扩大了治疗的适用人群范围。
从安全性角度而言,体内 CAR-T 通过 mRNA 瞬时表达 CAR 蛋白,避免了体外扩增导致的 T 细胞过度活化,可降低长期持续免疫激活带来的风险,更符合衰老个体对治疗安全性的高要求。
清除衰老细胞
衰老细胞的积累,会通过分泌多种促炎细胞因子和酶,导致组织功能下降和慢性炎症,加速衰老过程。而 CAR-T 应对衰老的机制可以通过设计特定靶向的 CAR,特异性识别衰老细胞并通过释放毒素或诱导细胞凋亡的方式,清除这些衰老细胞,以达到抗衰的目的。
在临床前研究中,uPAR 是一个研究频率比较高的靶点,其在衰老细胞上高表达,有多项相关研究报道。

例如,一篇题为「Prophylactic and long-lasting efficacy of senolytic CAR T cells
against age-related metabolic dysfunction」的研究论文就报道了一种靶向 uPAR 的
CAR-T,该疗法能够安全地选择性清除衰老细胞,可以改善老年小鼠的运动能力,并改善老年小鼠和高脂饮食小鼠的代谢功能障碍,让老年小鼠恢复活力,或让年轻小鼠衰老得更慢。值得一提的是,这种
CAR-T 疗法只需要单次输注就可以实现长期治疗和预防的效果。
除了这个靶点外,NKG2D 靶点也被开发用于抗衰,此前该靶点主要被用于针对多种实体瘤。2023 年 8 月,四川大学华西医院赵旭东团队联合明尼苏达大学邓义斌教授在 Science 子刊 Science Translational Medicine 上发表了一篇题为「NKG2D-CAR T cells eliminate senescent cells in aged mice and nonhuman primates 」的研究论文。
该研究发现,NKG2D 配体在衰老细胞中表达上调。研究团队据此开发了 NKG2D-CAR-T 细胞疗法,能够在人类细胞、小鼠和非人灵长类动物体内选择性靶向表达 NKG2DL 的衰老细胞,激活 T 细胞的杀伤信号通路,精准诱导衰老细胞凋亡,且对正常细胞无显著影响。
清除衰老细胞是抗衰一种非常直接的方式,与传统抗衰手段多聚焦于改善代谢、抗氧化等间接途径不同,清除衰老细胞能从源头上实现对衰老进程的直接干预。
调节衰老标志物/多途径调控
衰老标志物是反映机体衰老状态的分子或生理指标,也是抗衰干预的重要目标。调节衰老标志物往往涉及多个调控途径,目前 CGT 赛道的主力是基因疗法。
Klotho Neuroscience 在今年 6 月公布了一项临床前研究数据,促使该公司股价上涨 787.8%。该公司通过 AAV9 载体递送分泌型 Klotho 蛋白(s-KL),增加了小鼠血清中 s-KL 的浓度,使其寿命延长 20%。此外,提高 Klotho 基因表达可以同时减少多个器官与年龄相关的退化,促进健康老龄化。
Klotho 蛋白是一类与抗衰老存在紧密联系的蛋白质,因此编码该蛋白的基因也常被称作长寿基因。相关研究证实,Klotho 蛋白可通过多种生物学路径对代谢过程、炎症反应及组织修复功能产生影响,进而起到延缓衰老进程的作用。早在 1997,Makoto Kuro-O 教授就发现了 Klotho 与寿命之间的关联性,该团队还发表研究表明当小鼠体内过度表达全长 Klotho 基因时,其存活时间较正常小鼠延长了 30% 至 40%。
2024 年 3 月,一家致力于开发 RNA 抗衰疗法的企业 SENISCA 筹集到额外的 370 万英镑资金。该企业目前已开发了利用 RNA 生物学重编程「衰老」细胞的专有技术,并正在研究能够专门靶向衰老细胞并打开或关闭靶基因以阻止其衰老的递送系统。SENISCA 计划从皮肤老化方向着手并逐步将其技术扩展到更广泛的药物用途。
而在皮肤抗衰方向上,也有类似的研究已经被报道。2024 年 11 月,一篇题为「Human skin rejuvenation via mRNA」的研究论文,揭示了基底干细胞中的 ATF3 是调控皮肤衰老的关键分子。随着年龄增长,ATF3 的表达量会出现明显下降,这一变化会促使细胞衰老进程加剧,同时还会干扰角质形成细胞对成纤维细胞胶原蛋白合成的调控作用。
基于这一发现,研究团队研发出针对 ATF3 的 mRNA 靶向治疗技术,能够使得皮肤衰老程度得到显著改善,成纤维细胞的胶原蛋白生成量增加 200%,这也为人类实现皮肤年轻化提供了一种新的可能性。
修复及再生
随着年龄增长,人体组织器官的自我修复机制逐渐弱化,再生能力显著衰退。当机体无法及时补充衰老凋亡的细胞、修复受损的组织结构时,器官功能便会逐步衰退,进而引发一系列衰老相关问题。因此,增强机体的修复及再生能力,成为延缓衰老、维持健康状态的核心方向之一。
在这一方向上,干细胞因具有强大的自我更新与多向分化潜能,能够分化为各种组织细胞,补充衰老或受损细胞,激活机体自愈机制,从根源上助力身体的修复及再生进程,延缓衰老。据悉,目前主要用于抗衰的外源成体干细胞主要包括脂肪干细胞、骨髓间充质干细胞和妊娠组织来源的间充质干细胞。
今年 6 月,中国科学院动物研究所刘光慧课题组、曲静课题组,联合首都医科大学宣武医院王思课题组开展相关研究,共同在 Cell 上发表了题为「Senescence-resistant Human Mesenchymal Progenitor Cells Counter Aging in Primates」的论文。

研究团队利用合成生物学对长寿基因 FOXO3
通路进行重编程,构建了兼具抗衰老、抗应激和抗恶性转化能力的工程化人类抗衰型间充质祖细胞(SRC),并在灵长类动物模型中验证了其延缓多器官衰老的效果,为人类衰老干预提供了新的细胞治疗范式。
今年 5 月,汉密顿生物宣布其人脐带间充质干细胞注射液获得 CDE 批准进入临床,适应症为卵巢早衰,成为国内首个针对卵巢早衰适应症并获批临床试验的干细胞候选药物。卵巢早衰作为病理性衰老的一种表现形式,存在着未满足的临床需求。
值得一提的是,干细胞治疗已经入选《延缓衰老药物干预研究中国老年医学临床专家共识(2024)》。临床试验结果显示,老年衰弱患者注射干细胞后, 某些症状得到改善,炎症标志物水平有所下降。
通过间充质干细胞输注治疗衰老的衰弱患者研究显示,在衰老的衰弱患者中移植骨髓来源的 MSCs 后存在有益效果, 能改善衰老的衰弱患者 6 min 步行距离、认知状态和身体功能等。此外, 干细胞治疗在治疗衰老相关疾病领域也已经得到了应用和研究。
总结
抗衰老研究正迈向精准化、多元化。CGT 技术通过靶向慢性炎症、清除衰老细胞、调节标志物、修复再生等路径,为延缓衰老提供了新可能。未来,随着衰老机制研究的持续深入,CGT 抗衰疗法将朝着更精准、更安全、更普惠的方向迈进。

 产业资讯
产业资讯
 新华网
新华网  2026-02-13
2026-02-13
 782
782

 产业资讯
产业资讯
 医曜
医曜  2026-03-27
2026-03-27
 39
39

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2026-02-27
2026-02-27
 36
36