 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-07-31
2025-07-31
 575
575
AOC(抗体寡核苷酸偶联物)药物马上要爆了。
源于两家AOC头部开发企业Avidity Biosciences和Dyne Therapeutics的时间表,大多聚焦在2026年这一关键节点上。
AOC候选药物们已经摩拳擦掌,纷纷进入BLA准备阶段,预计从今年底开始将会迎来一大波AOC BLA申报潮。
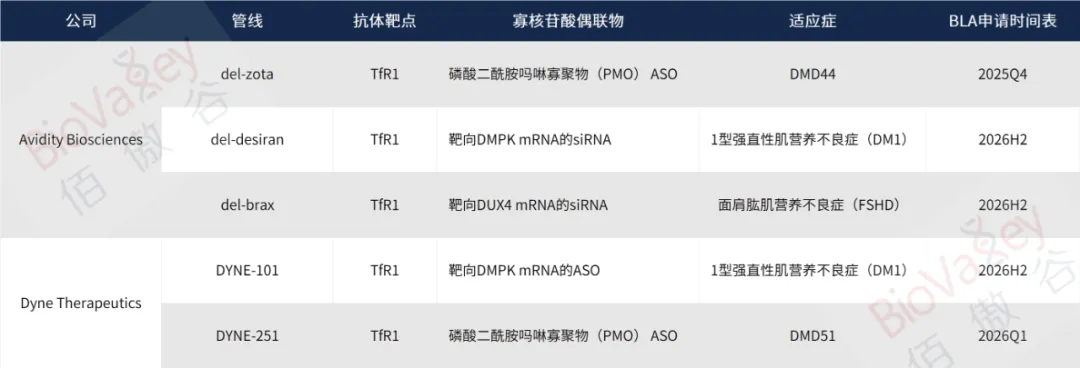
Avidity:12个月内3份BLA
根据Avidity公司日前所发布的简报,该公司正在进行商业特许经营权的筹备工作,同时推进3项注册试验,计划在未来12个月内提交3份生物制品许可申请,囊括了其主要的3款候选AOC。

最快的AOC,年底BLA
Avidity公司进度最快的AOC候选药物是Del-zota,是一款针对外显子44突变的杜氏肌营养不良症(DMD44)的外显子跳跃疗法,目前其治疗DMD44的1/2期研究EXPLORE44和EXPLORE44开放标签扩展(OLE)研究已经全部完成,支持在2025年底提交BLA。
Del-zota由靶向TfR1的单克隆抗体与磷酸二酰胺吗啉寡聚物(PMO)结合而成,旨在通过TfR1特异性靶向骨骼肌和心脏组织,以实现DMD外显子44跳跃,从而产生具备功能的接近全长的Dystrophin蛋白。
根据Avidity披露的数据,在EXPLORE44研究和EXPLORE44-OLE中证实了Del-zota有潜力改善DMD44患者的生活质量。

目前,Del-zota已经获得美国FDA授予罕见儿科疾病、孤儿药、快速通道、突破性疗法称号认定;以及欧洲药品管理局(EMA)的孤儿药称号认定。
DM1 AOC全球3期完成入组,26年下半年开始提交
Avidity的第2个BLA计划是AOC候选药物del-desiran。
del-desiran由专有的TfR1抗体偶联靶向DMPK mRNA的siRNA而成,旨在通过降低DMPK mRNA的水平从而缓解1型强直性肌营养不良症(DM1)。DM1发病机制的核心在于DMPK基因CTG重复的异常扩增,继而导致细胞内有毒RNA的异常聚集,干扰了RNA剪接调控因子的正常功能,从而引发组织和系统广泛受损。
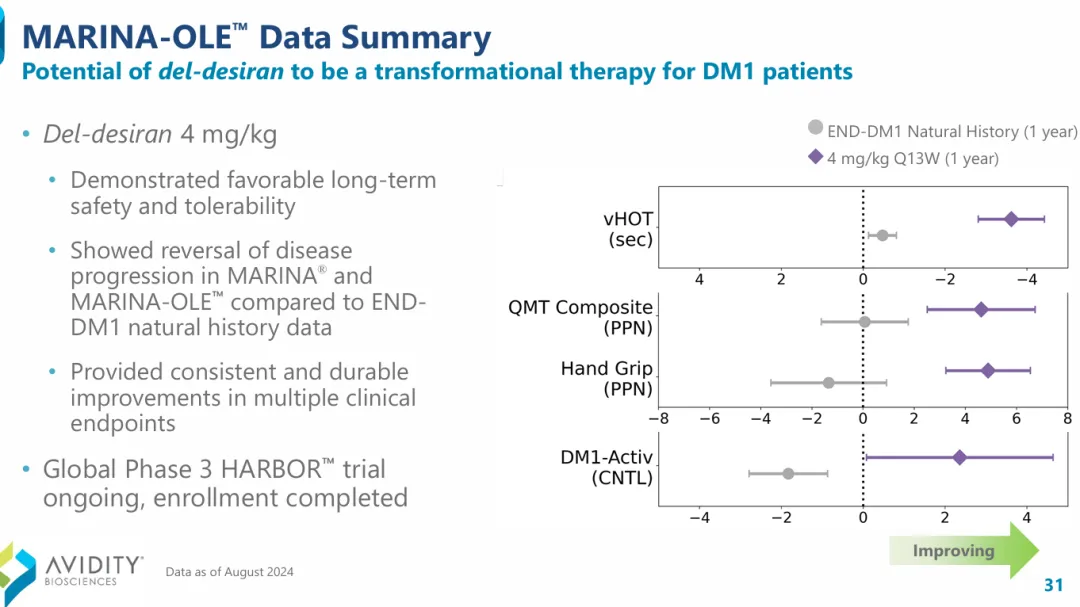
MARINA-OLE试验的长期数据显示,与自然史数据相比,del-desiran治疗的DM1患者实现了疾病进展的逆转,在多个临床重点上实现持续的改善。4mg/kg剂量队列的数据还证明了del-desiran具有良好的长期安全性和耐受性。
Del-desiran已经获得FDA授予的突破性疗法、孤儿药和快速通道称号认定;欧洲药品管理局(EMA)的孤儿药称号认定;以及日本授予的孤儿药认定。
2025年7月28日,Avidity公司宣布del-desiran针对DM1的全球3期研究HARBOR已经完成入组,预计将于2026年第二季度公布顶线数据。
另外,Del-desiran的监管路径已经明确。在启动HARBOR试验之前,Avidity已经与包括FDA在内的全球监管机构就del-desiran全面批准的监管路径保持一致。该公司计划从2026年下半年开始在美国、欧盟、日本等地提交上市申请。
Avidity在新闻稿中,提及del-desiran有望成为全球首个获得批准的DM1药物。但是它还面临着来自竞争对手Dyne Therapeutics同类AOC产品DYNE-101的竞速,DYNE-101的时间表预计在明年年底向FDA提交上市申请。
第3个BLA计划
Avidity的第3个BLA计划是Del-brax。
Del-brax是一款面肩肱肌营养不良症(FSHD)候选药物,FSHD是一种由DUX4基因异常表达引起的进行性肌肉疾病。Del-brax由专有的TfR1抗体偶联靶向DUX4 mRNA的siRNA而成,旨在降低DUX4 mRNA和坏DUX4蛋白表达。
Del-brax目前处于注册阶段研究,包括FORTITUDE生物标志物队列,以及针对FSHD的全球3期试验FORWARD。
此前,FDA已确认基于Del-brax的FORTITUDE生物标志物队列的加速批准途径已经开启,FORWARD研究旨在作为全面批准的确认性研究。FORTITUDE生物标志物队列的招募工作已于2025年3月完成,预计将于2026年第二季度发布初步顶线结果,并计划将于2026年下半年提交BLA。
Avidity此前报告的1/2期研究FORTITUDE数据显示,与安慰剂相比,del-brax治疗的FSHD患者在多种功能指标上都显示出持续的改善,以及生物标志物DUX4和CK的快速而显著的减少。
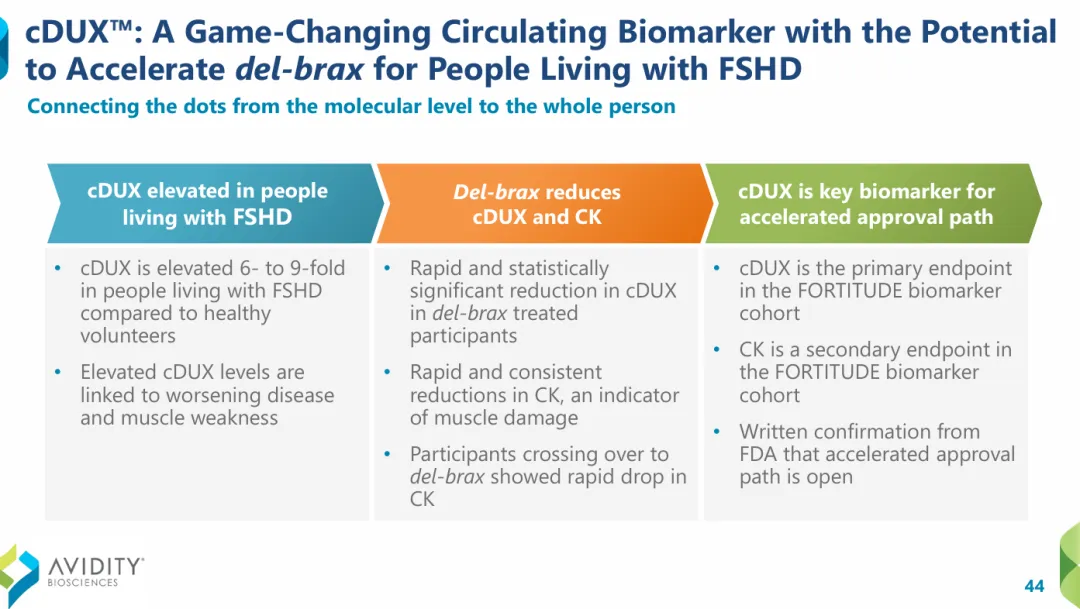
目前,del-brax已经获得FDA和EMA授予的孤儿药称号,以及FDA授予的快速通道称号。
Dyne明年也有两个BLA计划
另一家AOC头部开发企业Dyne Therapeutics在7月28日发布的2025年第二季度财报中,也披露了其在2026年的两个BLA计划。
另一款DM1 AOC,预计26年年底提交
Dyne公司宣布,其针对DM1的AOC候选药物DYNE-101正在进行ACHIEVE试验的注册扩展队列,预计将于2025年第四季度完成ACHIEVE试验注册扩展队列中60名患者的入组。该队列数据计划于2026年年中提供,以支持在2026年底向FDA提交加速批准申请。此外,Dyne公司预计将于2026年第一季度启动DYNE-101的全球验证性3期研究。
DYNE-101是一款AOC药物,由靶向TfR1的Fab与反义寡核苷酸(ASO)偶联而成,旨在降低致病性DMPK mRNA水平,纠正DM1的基因缺陷。DYNE-101此前已获得FDA授予的孤儿药、快速通道、突破性疗法称号认证。
2025年6月,Dyne公司与FDA举行了C类会议,成功更改了其寻求加速批准所基于的临床主要终点,将原先计划的主要终点—CASI-22(评估剪接校正效果),更换为vHOT(评估肌强直症状改善情况)。该修改方案导致了DYNE-101的上市计划推迟,进度稍落后于Avidity公司的del-desiran。
此外,Dyne公司将继续在美国境外寻求DYNE-101的批准途径。
DYNE-251治疗DMD45,26年初提交
由于DYNE-101的推迟,DYNE-251可能会成为Dyne公司首个提交BLA的AOC管线。
DYNE-251是一款研究性DMD外显子51跳跃疗法,由靶向TfR1的Fab与磷酸二酰胺吗啉寡聚物(PMO)偶联而成,旨在实现外显子51跳跃,使肌肉产生具有功能的、接近全长的Dystrophin蛋白,从而阻止DMD疾病进展。DYNE-251已经获得FDA授予的快速通道、罕见儿科疾病、孤儿药认定;以及EMA授予孤儿药认定。
目前,DYNE-251的DELIVER试验注册扩展队列已经完成完全入组,数据预计将于2025年底发布,支持2026年初FDA提交BLA以获得加速批准。
另外,Dyne公司将继续在美国境外寻求DYNE-251的用于治疗DMD51批准途径。
小结
实际上,目前AOC药物开发主要集中在国外,国内对于AOC的研究热情还不强烈,根据相关统计,国内仅有6家公司进行AOC的开发工作。
而随着头部几款AOC候选药物的撞线,可能会进一步引起MNC们的关注,从而引爆市场热情。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 61
61

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 63
63

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 63
63