 会员动态
会员动态
 UmabsDB
UmabsDB  2025-07-31
2025-07-31
 1754
1754
Umabs DB作为目前全球最全面的抗体药物专业数据库,收录全球近10000个从临床前到商业化阶段抗体药物,涉及靶点1600+,涉及疾病种类2400+,研发机构2900+,覆盖药物蛋白序列、专利和临床等多种专业信息。Umabs DB药物数据库已正式开放上线,可访问www.umabs.com注册享受7天免费试用。
近期,根据UmabsDB数据库的记录,信达生物刚刚在CDE药物临床试验登记与信息公示平台网站上,登记了一项PD-1/IL-2双抗药物IBI363,联合联合化疗,对比K药+化疗,在可手术切除的IB-III期非鳞非小细胞肺癌新辅助治疗的患者中,启动一项II期研究CTR20253028。
信达表现出了非凡的研发效率,昨日该项临床刚刚获得默许批准(直逼AK112:信达即将启动PD-1/IL-2+VEGF联合疗法),今日就在临床登记平台进行公示,加速明显。
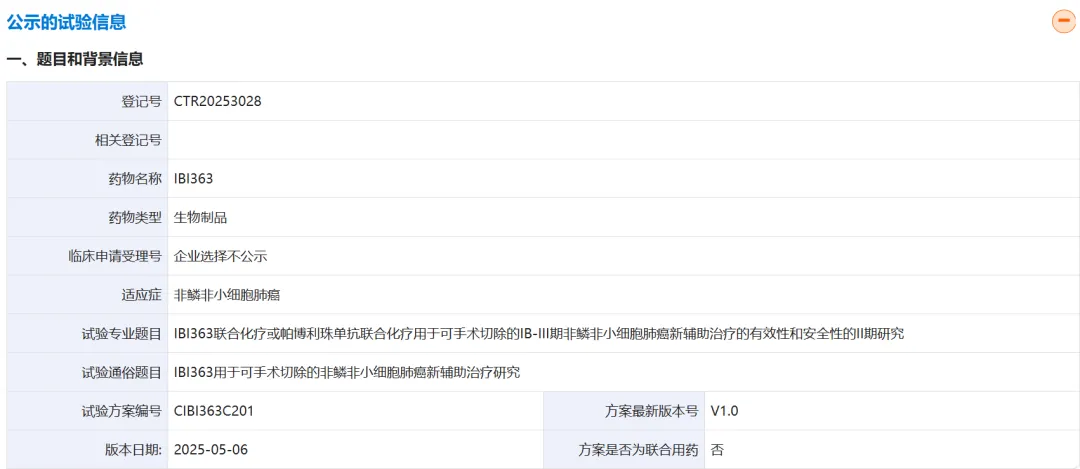
该项临床也预示在IBI363逐步从后线推进到前线,本次II期研究将比较IBI363联合化疗与帕博利珠单抗联合化疗用于可手术切除的IB-III期非鳞非小细胞肺癌新辅助治疗的病理完全缓解率,RP2D剂量或定为1
mg/kg。
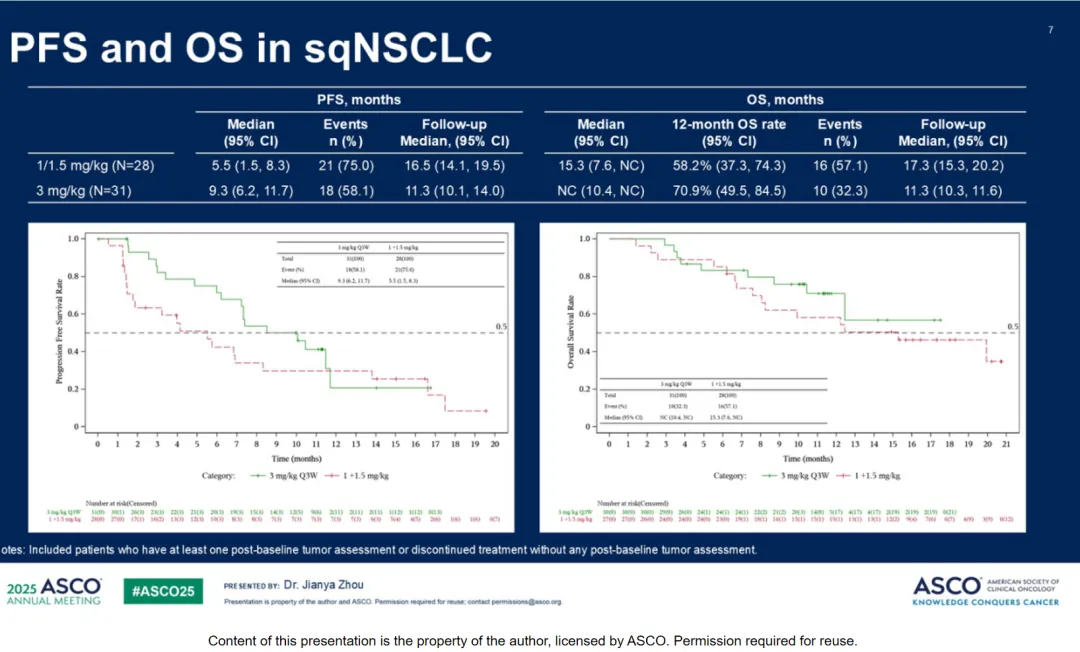
在今年ASCO会议上,IBI363在结直肠癌、黑色素瘤和非小细胞肺癌中进行了三项口头汇报,结直肠癌中更新的生存期数据让业界期待满满,在免疫治疗耐药的鳞状非小细胞肺癌中,3 mg/kg剂量下9.3个月的超预期PFS数据,创造了相关人群当前的最佳治疗数据。
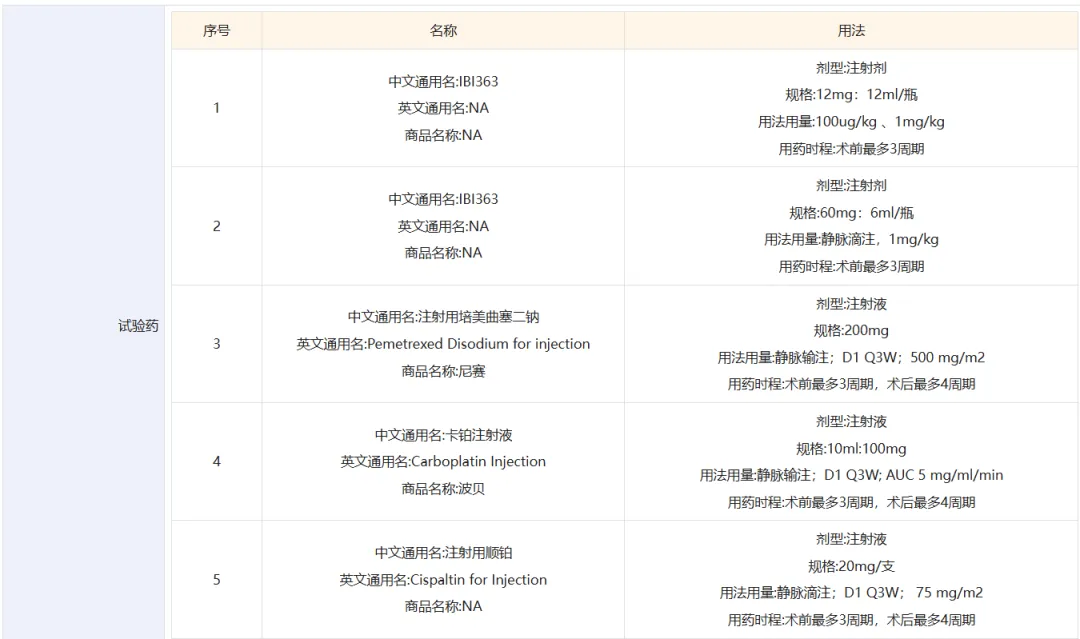
本次II期研究预计将入组患者170例,由广州医科大学附属第一医院何建行博士和辽宁省肿瘤医院刘宏旭博士共同担任主要研究者。
值得注意的是,帕博利珠单抗准联合含铂化疗新辅助治疗并在手术后继续帕博利珠单抗单药辅助治疗,用于可手术切除的II、IIIA和IIIB期非小细胞肺癌患者的治疗方案去年12月才刚刚获得NMPA批准,仅过半年就迎来了信达的挑战。
该项适应症的获批是基于全球3期临床试验KEYNOTE-671的研究数据,KEYNOTE-671是一项随机、双盲、安慰剂对照3期研究,在全球189个医疗中心开展相关试验。研究纳入了既往未经治疗、经病理学证实的2~3期NSCLC成人患者797例,以1:1的比例随机分配至帕博利珠单抗组和新辅助化疗组。
KEYNOTE-671试验第二次中期分析结果在2024欧洲肿瘤内科学会(ESMO)大会上发布,并同步发表于《柳叶刀》。
分析结果显示,相比于新辅助化疗组,帕博利珠单抗组36个月的OS率获益更显著(71% vs. 64%)、中位EFS更长(47.2个月 vs. 18.3个月),具有可控的安全性。研究结果支持在可切除的早期NSCLC患者围手术期使用帕博利珠单抗。
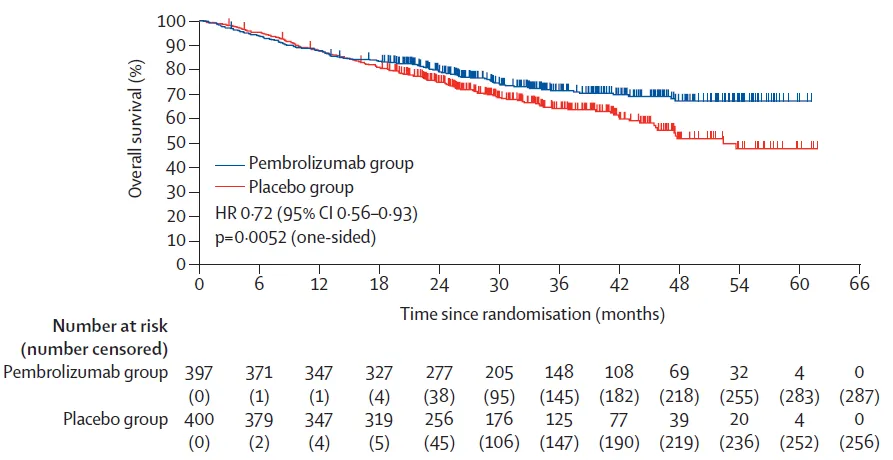
更早些时候,阿斯利康的PD-L1单抗度伐利尤的AEGEAN 研究是全球首个报道可切除 NSCLC 围术期免疫治疗「夹心饼」模式取得阳性结局的 III
期研究。
2024 年世界肺癌大会(WCLC)中报告了 AEGEAN 研究第二次计划中期分析结果。基于初步 EFS 分析后 18 个月的额外随访,与既往报道相一致,相较于安慰剂组,度伐利尤组的 EFS 更优,两组的 mEFS 分别为 NR 和 30.0 个月(HR = 0.69,成熟度为 39.1%),且各预设亚组中均观察到度伐利尤组 vs 安慰剂组的 EFS 获益。数据截止时,OS 成熟度为 35%,与安慰剂组相比,度伐利尤组的 OS 具有获益趋势(NR vs 53.2 个月;HR=0.89)。
期待IBI363基于独创性的结构设计,能够带来的非小细胞肺癌新的治疗突破。更多有关抗体药物具体信息、专利及临床等动态进展,敬请关注Umabs
DB全球数据库(www.umabs.com)的更新。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 166
166

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 166
166

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 185
185