 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-08-01
2025-08-01
 770
770
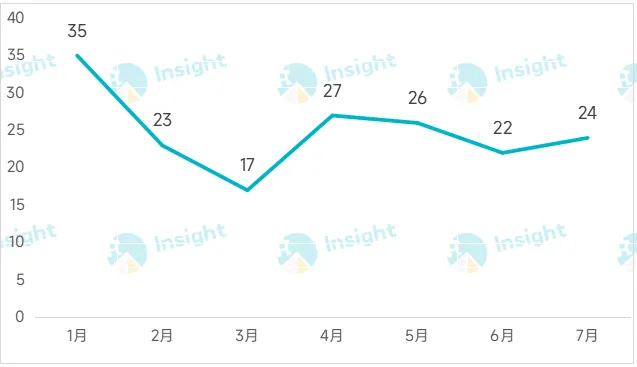
根据 Insight 数据库,7 月份,有 24 款新药向 NMPA 递交上市申请(含新适应症,截至 7 月 30 日),包括 12 个首次上市申请和 12 个新适应症申请。
从注册分类来看,24 款药中,国产药有 15 款,进口药有 9 款。药物类型上,化药有 17 款,生物药有 7 款。本文将节选其中几款重磅抗肿瘤新药信息做介绍,仅供参阅。
2025 年国内申报上市新药数量月趋势图
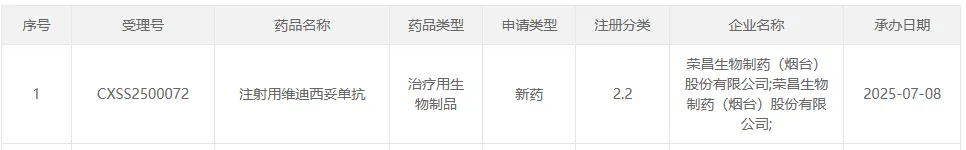
荣昌生物「维迪西妥单抗」
申报第 5 项适应症
7 月 8 日,荣昌生物维迪西妥单抗第 5 项适应症上市申请获受理,用于联合特瑞普利单抗(PD-1单抗)治疗 HER2 表达的局部晚期或转移性尿路上皮癌患者。
来源:CDE 官网
本次上市申请基于一项在中国开展的随机、平行对照、多中心 III 期临床研究(RC48-C016),旨在评价维迪西妥单抗联合特瑞普利单抗一线治疗 HER2 表达尿路上皮癌的疗效与安全性。
今年 5 月 ,荣昌生物宣布 RC48-C016 研究达到无进展生存期(PFS)和总生存期(OS)的两项主要研究终点,研究结果具有统计学显著差异和重大临床获益。在主要亚组分析中,无论患者是否适合接受顺铂治疗以及不论 HER2 表达状态,相比化疗,维迪西妥单抗联合特瑞普利单抗均能显著改善患者的 PFS 和 OS,而且整体安全性良好,不良反应可控。
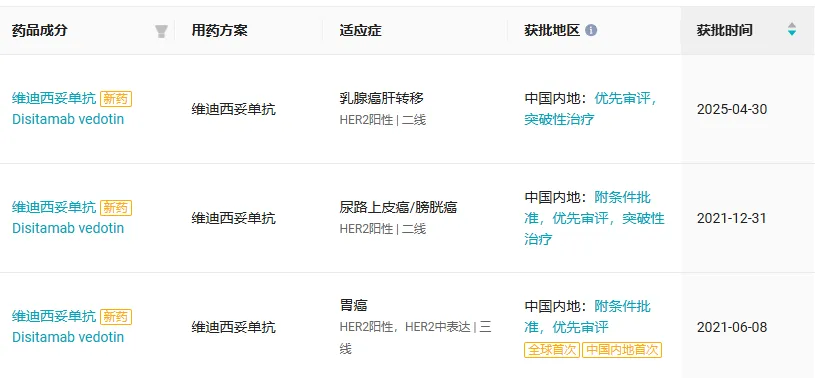
维迪西妥单抗是首个获批的国产 HER2 靶向 ADC ,此前已在国内获批 3 项适应症,涵盖胃癌、 尿路上皮癌、乳腺癌(详见下图)。今年 6 月,维迪西妥单抗的第 4 项适应症上市申请也已获得 CDE 受理,用于 HER2 低表达乳腺癌的二线治疗。
截图来源:Insight 数据库
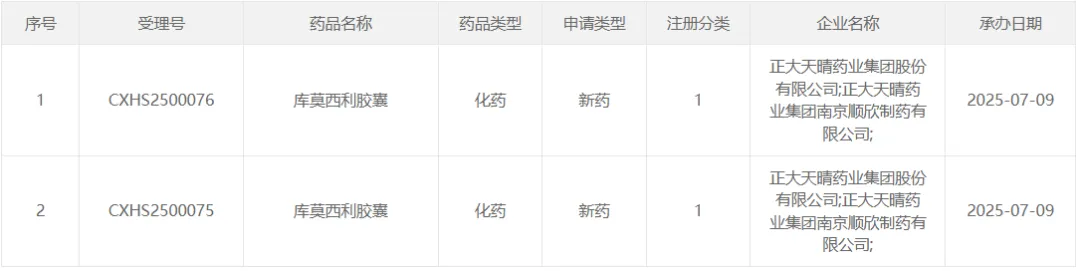
正大天晴「库莫西利+氟维司群」
申报第 2 项适应症
7 月 9 日,正大天晴库莫西利胶囊和氟维司群注射液的联合疗法新适应症报上市,用于 HR+/HER2-的局部晚期或转移性乳腺癌患者的初始内分泌治疗。

来源:CDE 官网
库莫西利是一款 CDK2/4/6 抑制剂,对 CDK2、CDK4、CDK6 激酶有不同程度的抑制效果。氟维司群是一种雌激素受体下调剂。2024 年 7 月,CDE 已受理这两款药物联合用于治疗既往内分泌经治的 HR+/HER2-局部晚期或转移性乳腺癌的上市申请。本次一线适应症的申请是基于 Ⅲ 期临床试验 TQB3616-Ⅲ-02 的阳性结果,研究旨在评价库莫西利+氟维司群对比安慰剂+氟维司群在既往未经治疗的 HR+/HER2- 晚期乳腺癌中有效性和安全性。
2025 年 3 月,正大天晴宣布经独立数据监查委员会(IDMC)判定,TQB3616-Ⅲ-02 研究达到方案预设规定的主要有效性终点,具有降低晚期一线乳腺癌患者疾病进展或死亡风险的获益趋势。
安进/百济神州 「塔拉妥单抗」
首次申报上市
7 月 16 日,安进和百济神州的注射用塔拉妥单抗申报上市,用于广泛期小细胞肺癌 (ES-SCLC) 成人患者的三线治疗。该申请已被纳入优先审评。
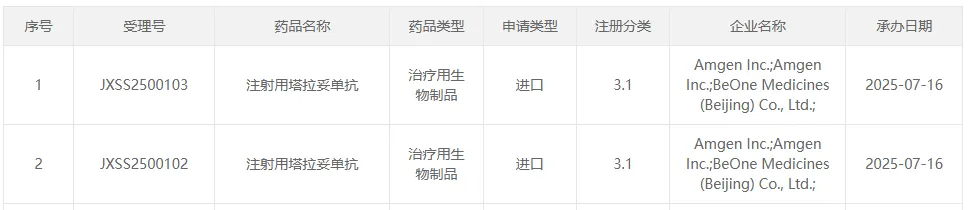
来源:CDE 官网
塔拉妥单抗是安进开发的一款 CD3×DLL3 双抗,已于 2024 年 5 月获得 FDA 加速批准,用于 ES-SCLC 成人患者二线治疗,是全球首个获批的 DLL3 靶向药。百济神州和安进达成战略合作,在中国共同开发和商业化包括塔拉妥单抗在内的多款药物。
2025 年 5 月,百济神州宣布塔拉妥单抗在中国开展的 Ⅱ 期临床研究 DeLLphi-307 中取得积极结果。这项研究旨在评估塔拉妥单抗用于治疗既往接受过至少二线治疗失败的 ES-SCLC 中国患者的疗效、安全性以及耐受性,主要研究终点为客观缓解率(ORR)。研究详细数据将在未来的医学大会上公布。
第一三共/阿斯利康「德曲妥珠单抗」
申报第 6 个适应症
7 月 17 日,第一三共和阿斯利康联合开发的 HER2 ADC 德曲妥珠单抗的新适应症申请获受理,单药用于HER2 阳性成人胃或胃食管结合部腺癌患者二线治疗。这是德曲妥珠单抗在国内的第 6 个适应症申请,已被纳入优先审评。

来源:CDE 官网
本次上市申请主要基于 III 期研究 DESTINY-Gastric04 的结果。在主要终点 OS 分析中,与对照组(雷莫西尤单抗+紫杉醇)相比,德曲妥珠单抗可使死亡风险降低 30%。德曲妥珠单抗组的中位 OS 为 14.7 个月,高于对照组的 11.4 个月。
在次要终点的分析中,与对照组相比,德曲妥珠单抗组将疾病进展或死亡风险降低了 26%。德曲妥珠单抗组的中位 PFS 为 6.7 个月、ORR 为 44.3%、DOR 为 7.4 个月、DCR 为 91.9%,均高于对照组。
在国内,德曲妥珠单抗此前已经获批四项适应症(见下图),涵盖乳腺癌、胃癌、非小细胞肺癌。今年 6 月,德曲妥珠单抗用于 HER2 阳性成人胃或胃食管结合部腺癌二线治疗的上市申请也已被 CDE 纳入优先审评。

截图来源:Insight 数据库
自 2019 年首次获批以来,德曲妥珠单抗的销售额也是高歌猛进,24 年全球销售额已超 38 亿美元,成为了全球最畅销的 ADC 药物。
拜耳「BAY 2927088」
首次报上市
7 月 23 日,拜耳 1 类新药 BAY 2927088 片申报上市,适应症为用于治疗携带 HER2(ERBB2)激活突变且既往接受过一种全身性治疗的晚期非小细胞肺癌(NSCLC)成人患者。该申请已被纳入优先审评。

截图来源:CDE 官网BAY 2927088 (Sevabertinib)是一种口服可逆酪氨酸激酶抑制剂(TKI)。在 2024 年 WCLC 大会上,拜耳公布了 I/II 期 SOHO-01 研究扩展部分的积极结果。该研究评估了 BAY 2927088 作为携带 HER2 激活突变的晚期 NSCLC 患者二线疗法的疗效和安全性。数据显示:
入选的 44 名患者中有 43 名可评估疗效,确认的客观缓解率 (ORR) 为 72.1% (n=31),包括 1 名完全缓解 。
中位缓解持续时间 (DOR) 为 8.7 个月 ,中位无进展生存期 (PFS) 为 7.5 个月。
在最常见的 HER2 YVMA 插入突变患者中,ORR 为 90.0%,DoR 为 9.7 个月,PFS 为 9.9 个月。
安全性可控。
除了 SOHO-01 试验外,拜耳还在全球 III 期 SOHO-02 试验中评估 BAY 2927088 作为携带 HER2 激活突变的晚期 NSCLC 患者一线疗法的潜力
艾力斯「伏美替尼」
申报第 3 个适应症
7 月 24 日,艾力斯伏美替尼第三项适应症上市申请获受理,用于既往经含铂化疗治疗时或治疗后出现疾病进展或不耐受含铂化疗,并且经检测确认存在 EGFR 20 外显子插入突变的局部晚期或转移性 NSCLC 成人患者的治疗。该申请已被 CDE 纳入优先审评。

截图来源:CDE 官网
伏美替尼是第三代 EGFR-TKI,此前已在国内获批 EGFR 突变的局部晚期或转移性 NSCLC 成人患者的二线、一线治疗适应症,并均已被纳入国家医保目录。
2021 年 6 月,艾力斯与 ArriVent 达成伏美替尼海外独家授权合作,目前伏美替尼针对 EGFR 20 外显子插入突变 NSCLC 患者一线治疗适应症的全球多中心 III 期注册临床研究正在顺利进行中。
康方生物「依沃西单抗」
申报第 3 个适应症
7 月 25 日,康方生物的 PD-1/VEGF 双抗依沃西单抗申报第三项适应症,联合化疗一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)。
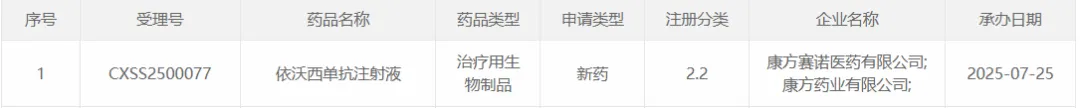
截图来源:CDE
官网依沃西此前已在国内获批两项适应症,分别用于 EGFR-TKI 治疗进展的局部晚期或转移性 nsq-NSCLC、一线治疗 PD-L1 表达阳性的晚期
NSCLC。
此次新适应症申请是基于 III 期临床(AK112-306/HARMONi-6 研究)积极结果。HARMONi-6 研究旨在评估依沃西联合化疗「头对头」替雷利珠单抗联合化疗的效果。今年 4 月,康方生物宣布,经独立数据监察委员会(IDMC)评估的预先设定的期中分析显示强阳性结果:
在意向治疗人群 (ITT) 中,依沃西联合化疗组的患者无进展生存期(PFS)相较对照组,获得了决定性胜出的阳性结果;
相较对照组,依沃西组在 PD-L1 阳性及 PD-L1 阴性人群中,均显示出具有临床意义的 PFS 显著获益;
本临床试验共入组 532 例受试者,中央型鳞癌占比约为 63%,与真实世界患者分布一致;
依沃西组总体安全性良好,未发现新的安全性信号。与治疗相关的严重不良反应发生率以及三级及以上出血事件发生率与对照组相似。
除了上述抗肿瘤新药,七月还有多款其它新药在国内递交了NDA,限于篇幅,本文不再一一介绍。如欲了解更多国内新药注册情况,可前往 Insight 数据库查看。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 61
61

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 63
63

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 63
63