 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-08-02
2025-08-02
 790
790
PD-1(L1)/VEGF双抗正在成为全球创新药研发焦点。
自2024年9月康方生物和Summit报告其PD-1/VEGF双抗Ivonescimab,在头对头3期临床中击败了“K药”(帕博利珠单抗,Keytruda)之后,默沙东、辉瑞、BMS等MNC们纷纷买进中国PD-1(L1)/VEGF双抗管线,潜在的总金额超过百亿美元。
同样,由于在全球PD-1/L1xVEGF双抗开发中,中国创新药企为主要研发力量,因此大多数临床数据也是来自中国研究。由此,一些国外评论认为,因为人种差异以及其他原因,可能无法在全球试验中复刻在中国的成功。同样的,对于这些交易的金额,也有部分评论认为“买高了”。
但是,随着康方生物/Summit的全球研究数据出炉,以及其他头部管线的进一步临床数据,证实了PD-1/L1xVEGF双抗的治疗潜力和未来市场。
(以下内容摘选了一些于近期发布的临床数据,且不分先后顺序。如有错漏,欢迎留言补充!)
头对头击败K药的依沃西
最重磅的数据,就是来自康方生物和Summit的PD-1/VEGF双抗Ivonescimab(依沃西单抗)。
2024年9月,CSCO 2024年会上,康方生物公布了Ivonescimab的3期临床试验HARMONi-2的主要分析数据。HARMONi-2是一项对比Ivonescimab与帕博利珠单抗在PD-L1表达阳性晚期非小细胞肺癌(NSCLC)的随机对照III期研究。数据显示,在这项头对头的3期研究中,Ivonescimab相较显著延长了患者无进展生存期(PFS),风险比(HR)显著优于预期(mPFS 11.14个月vs 5.82个月,HR=0.51,P<0.0001)。
基于该研究结果,Ivonescimab在2025年4月获得中国药监局(NMPA)批准单药用于一线治疗NSCLC。
此外,今年7月,Ivonescimab联合化疗1L治疗sq-NSCLC的上市申请获NMPA受理,该sNDA是基于依沃西联合化疗“头对头”替雷利珠单抗联合化疗的III期临床(AK112-306/HARMONi-6研究)强阳性结果。
另外,2025年5月,康方生物的海外合作伙伴Summit发布了Ivonescimab的针对EGFR突变NSCLC的全球多中心III期临床HARMONi的研究结果。
HARMONi研究结果显示,研究成功达到无进展生存期(PFS)的主要终点,且患者总生存期(OS)具有明显获益趋势:与单纯化疗相比,依沃西与化疗联合的无进展生存期(PFS)风险比值(HR)为0.52(疾病进展或死亡风险降低48%),总生存期(OS)HR为0.79;国际多中心HARMONi研究与在中国HARMONi-A研究的结果具有一致性(包括疗效和安全性的一致性),验证了依沃西在跨区域研究中具有一致性的临床疗效。
基于HARMONi临床试验结果,Summit表示将适时提交该适应症的生物制品许可申请(BLA)。
宜明昂科 IMM2510
2025年7月31日,宜明昂科公布了其PD-L1xVEGF双抗IMM2510/AXN-2510在中国开展的IMM2510联合化疗一线治疗非小细胞肺癌(NSCLC)患者的开放标签、多中心II期研究数据。
截至2025年7月1日,33例患者以10 mg/kg剂量给药,其中21例至少接受过一次肿瘤评估(可评估疗效)。数据显示:一线鳞状NSCLC患者客观缓解率(ORR)为80%(8/10);一线非鳞状NSCLC患者客观缓解率(ORR)为46%(5/11);整体可评估人群客观缓解率(ORR)为62%。
安全性结果支持进一步临床开发:33例可评估安全性患者中未观察到剂量限制性毒性;未出现导致剂量降低或死亡的治疗相关不良事件(TRAE),仅1例患者因TRAE停药;安全性结果支持进一步临床开发。
同时,这一积极的临床结果也支持AXN-2510在美国的临床开发。
2024年8月,Instil Bio以5000万美元的首付款,以及超过20亿美元的里程碑付款,获得了IMM2510以及CTLA-4抗体IMM27M在大中华区以外的开发和商业化权利。
2025年7月2日,美国FDA批准了AXN-2510的IND申请,预计将于2025年下半年启动AXN-2510的美国1b/2期试验。该IND批准事件也触发了合伙方Instil向宜明昂科支付1000万美元的里程碑付款。
三生制药 SSGJ-707
2025年5月,辉瑞以12.5亿美元的首付款,以及最高达48亿美元的里程碑付款,获得三生制药的PD-1/VEGF双抗SSGJ-707在全球(不包括中国内地)的开发、生产、商业化权利。
2025年7月24日,三生制药宣布与辉瑞就SSGJ-707达成的全球授权协议于正式生效。另外,双方同意,在5月20日公司公告将获得12.5亿美元首付款的基础上,三生制药将额外获得1.5亿美元款项,以进一步授予辉瑞在中国内地独家开发和商业化SSGJ-707的权利。
这场授权许可的总金额刷新了当时中国创新药的出海记录(目前已经被恒瑞医药与GSK关于PDE3/4抑制剂等12个项目的合作刷新),也打响了PD-1(L1)/VEGF在全球的热度。
同时,辉瑞这笔交易也在海外引起巨大的讨论,赞同声有,但是争议也不少。面对这些质疑,SSGJ-707以优异的临床数据证明了自己。2025年7月25日,辉瑞召开了主题讲座,详细介绍了SSGJ-707的详细临床数据。
数据来自一项在中国进行的2期研究,评估SSGJ-707作为一线治疗PD-L1阳性晚期NSCLC患者,该数据发布于ASCO 2025上。
在10 mg/kg剂量组中,SSGJ-707实现深度而持久的疗效,ORR高达64.7%。该剂量组同时具有可管理的安全性,仅有23.5%的患者发生3级及以上治疗相关不良事件,约20%的患者发生治疗相关严重不良事件;导致停药的治疗相关不良事件非常低,且无治疗相关死亡。
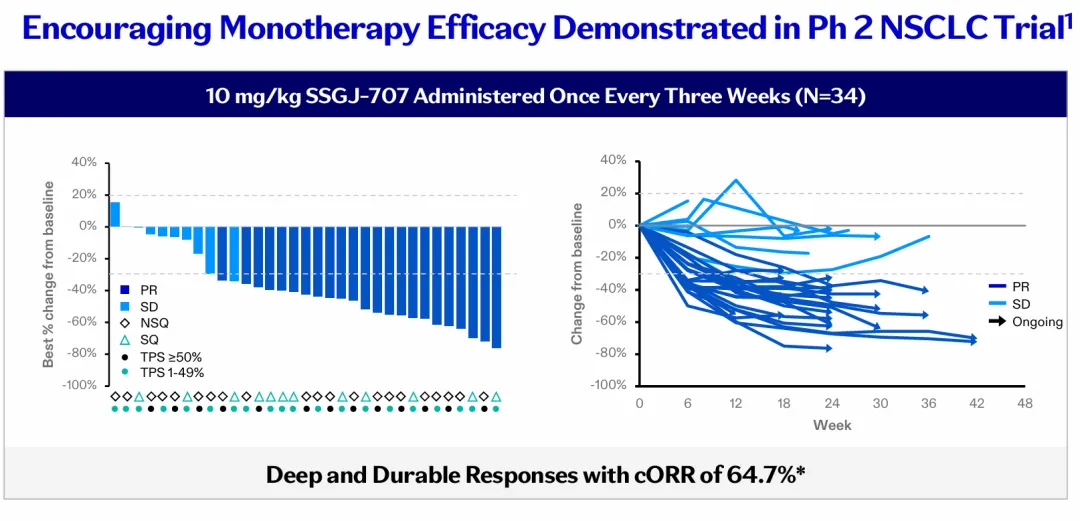
图片来源:参考资料9
此外,10 mg/kg Q3W剂量下,2期研究中的各亚组获益率相似。鳞状NSCLC的ORR和DCR分别为75%和100%;非鳞状NSCLC的ORR和DCR分别为64%和96%;PD-L1表达水平TPS 1-49%的ORR和DCR分别为62%和95%;TPS≥50%的ORR和DCR分别为77%和100%
结果表明,SSGJ-707有望治疗以往难以治疗的鳞状NSCLC患者以及PD-L1水平较低的患者群体。
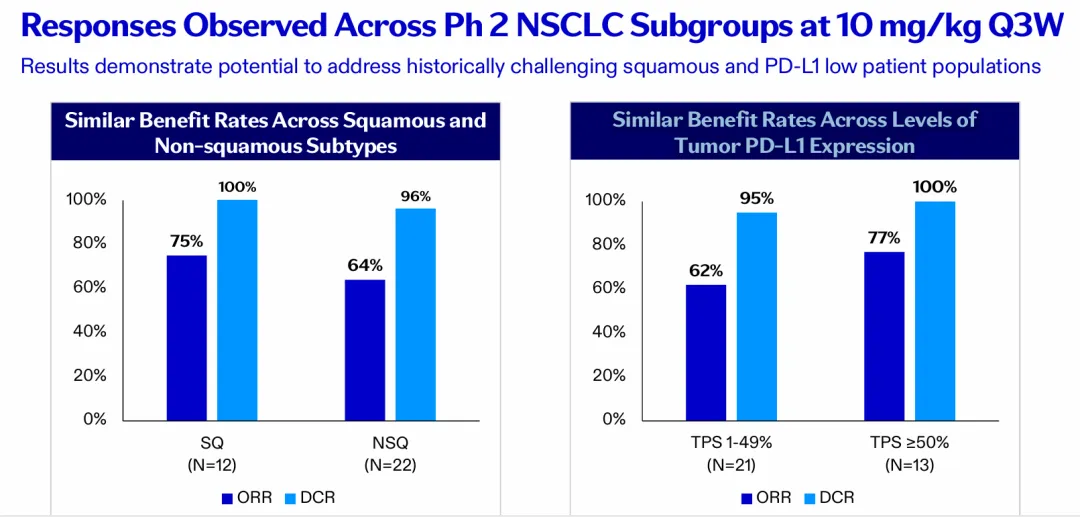
图片来源:参考资料9
普米斯 PM8002/BNT327
几经转手后,由普米斯所开发的PD-L1/VEGF-A双抗PM8002,目前由BMS所拥有。延伸阅读:正在热议丨BMS与BioNTech就普米斯PD-L1/VEGF-A双抗达成高达111亿美元合作
2025年3月,在2025年欧洲肺癌大会上,BioNTech公布了BNT327联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)的II期临床试验数据。中位随访时间为14.5个月,ORR为85.4%,DCR为97.9%。中位无进展生存期(PFS)为6.9个月,12个月的总生存率(OS)为72.7%,中位总生存期(OS)尚未成熟。
2025年5月,ASCO2025年会上,普米斯公布了BNT327联合化疗一线治疗恶性间皮瘤的II期临床结果。数据显示:在胸膜间皮瘤(MPM)患者中(n=23),cORR为43.5%,DCR为87.0%;在腹膜间皮瘤(MPeM)患者中(n=8),cORR为75.0%,DCR为100%。
小结
以上数据并不完全包括所有PD-1(L1)/VEGF双抗数据,只是挑选了部分近期发布的临床数据作汇总整理,如有错漏欢迎留言补充!
总而言之,在交易市场的狂热追捧下,PD-1(L1)/VEGF双抗也在用临床证据证明自己的实力。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 61
61

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 63
63

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 63
63