 产业资讯
产业资讯
 药明康德
药明康德  2025-08-02
2025-08-02
 501
501
编者按:2025年,药明康德迎来创立25周年的重要里程碑。值此契机,我们向所有与我们共同书写产业变革篇章的科学家、医药人和投资者致以衷心感谢与诚挚敬意,也特别推出“致敬时代”系列,回顾全球同仁如何借助科学与合作的力量,不断拓展治疗边界、改善患者命运。
四分之一个世纪的坚守,只为加速每一款新药的诞生。下一个25年,我们将继续心怀感恩与敬畏,依托独特的CRDMO模式,与全球伙伴携手同行,共赴健康未来。
百年前的罕见病
肺癌是全球范围内最为流行,也最为致命的癌症之一。根据2024年发布的GLOBOCAN报告,每年约有180万人死于肺癌,几乎相当于每3分钟就有10人因此去世。令人意外的是,100多年前,肺癌曾被视为罕见病。1912年,纽约的一名医生出版了一本关于肺癌的著作,记录了他从全球文献中能找到的所有肺癌病例,仅有374例。另一名外科医生在学徒期间观察了一位肺癌患者的解剖过程,而他下一次见到肺癌病例,竟是17年之后的事了……
值得注意的是,有学者指出,当时肺癌的“罕见”与医学认识不足密切相关。由于缺乏有效诊断手段,许多肺癌患者被误诊为肺结核,唯有通过尸检才能确诊病因。这段医学模糊期并未持续太久,自上世纪40年代末期起,肺癌新发病例开始激增,肺癌也从“罕见病”迅速演变为“流行病”。
图片来源:123RF
揭示罪魁:烟草与肺癌的关系
在过去的100年里,如果要评选人类理解肺癌的决定性时刻,很多人也许会将票投给1950年的一篇论文。英国的两名研究人员理查德·多尔(Richard Doll)与奥斯汀·布拉福德·希尔(Austin Bradford Hill)在论文中指出,英格兰与威尔士的肺癌死亡病例数从1922年的612起,猛增到了1947年的9287起。也就是说,在短短的25年里,肺癌的死亡病例增长了14倍!
上文中我们也提到,过去肺癌病例的缺失可能与诊断技术有关。随着新型诊断技术的发展,更多肺癌患者得以确诊,这也在一定程度上导致了肺癌病例数与死亡数的激增。然而两位研究人员却指出,“诊断技术的进步”并不能完全解释这一现象。因此他们设计了一套问卷,在20家伦敦医院中分发给肺癌患者与其他癌症患者(作为对照),寻找导致肺癌的其他原因。
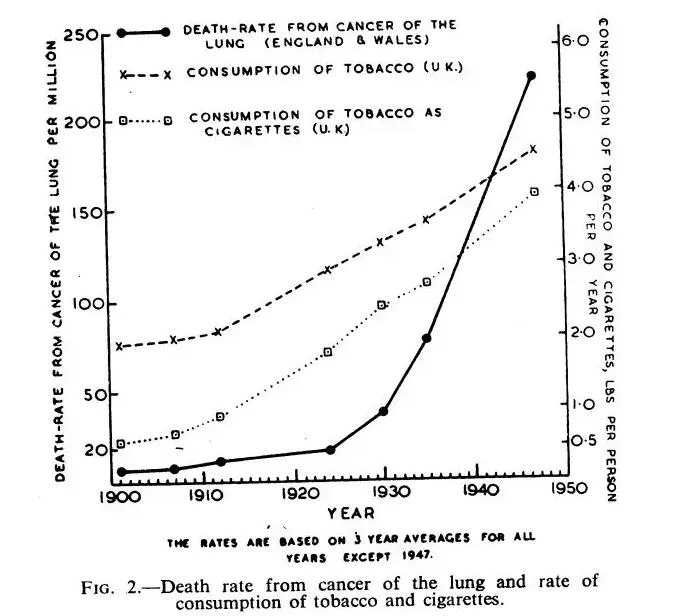
▲1950年的一篇论文,找到了烟草与肺癌之间的关联(图片来源:参考资料[3])
在大气污染(比如汽车尾气,煤炭燃烧,焦油路面扬灰等)与使用烟草等原因中,研究人员们清楚地找到了后者与肺癌之间的关联。随后进行的多个研究,也再次验证了烟草与肺癌之间的联系。上世纪60年代,英国皇家医师学会(The Royal Society of Medicine)和美国医疗总监(U.S. Surgeon General)各自发表报告,介绍烟草使用的致病风险。
在美国,吸烟率自报告发布后出现下降,而肺癌发病率也在约20年后出现了成比例的减少。多个全球癌症统计报告也指出,过去几十年来肺癌发病率出现持续下降,烟草控制功不可没。
至暗时刻
与肺癌发病数逐步下降的趋势形成鲜明对照,人们在肺癌患者的治疗上却显得举步维艰。自上世纪的后半叶起,多种诊疗技术陆续问世。它们虽然能够起到一定的治疗效果,但也存在各种不一样的风险与问题。
对于早期肺癌患者来说,手术是一种相对安全有效的方法。通过切除患者肺部的肿瘤,或是部分肺叶,患者的病情能够得到快速缓解。但这一方法的局限在于,许多患者在确诊时,病情已进入晚期,肿瘤甚至已经发生扩散。遇到这些患者,手术就显得无能为力。此外,手术还会为患者的身体带来比较严重的负担,而且术后很容易复发。
对于手术无法帮到的患者,射频消融术(radiofrequency ablation)、放疗与化疗有望带来帮助。第一种方法通过高能电磁波来“加热”肿瘤,“烫死”癌细胞;第二种方法是使用高能射线,破坏癌细胞的DNA,起到杀伤作用;第三种方法则是在患者体内注入具有细胞毒性的药物或药物组合,攻击癌细胞。可以看到,这些疗法的作用机制不够精准,很多时候会“误伤”正常细胞,带来一定的不良反应。
这也正是医学界为何一度曾对肺癌的治疗“感到悲观”。我们有了更先进的诊断技术,可以尽早发现肺癌;我们通过遗传和免疫的手段,找到了和吸烟没有关联的全新肺癌类型;我们不断对手术与化疗等治疗方案进行改良。然而对于晚期肺癌患者来说,他们的5年生存率在上个世纪的最后几十年里,几乎没有任何提高。
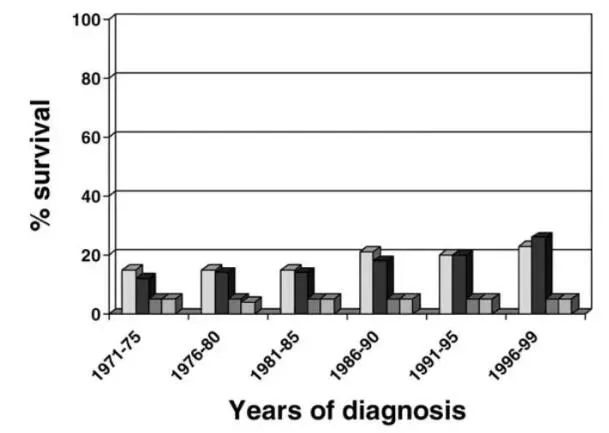
▲长久以来,肺癌的5年生存率几乎没有变化(白色:男性1年生存率;黑色:女性1年生存率;深灰:男性5年生存率;浅灰:女性5年生存率;图片来源:参考资料[2])
从EGFR靶点出发,开启靶向治疗时代
世纪之交,分子生物学的快速发展,让科学家们得以从更为微观的角度去理解肺癌。不少研究发现,许多非小细胞肺癌(NSCLC,肺癌中的一种,约占总病例的85%)都与一种叫做EGFR的蛋白质有关。具体来看,这一蛋白在80%的患者中均过量表达,在60%的病例中会出现基因拷贝数上升。此外,大约三分之一的肺癌患者带有EGFR基因突变。这些变异使得EGFR的活性大增,从而促进细胞出现不受控的生长。
基于这些发现,新药研发人员们期望通过小分子药物来抑制EGFR的活性,达到治疗肺癌的目的。于是,第一代EGFR抑制剂Iressa(gefitinib),Tarceva(erlotinib)以及Conmana(icotinib)应运而生。从这一刻起,肺癌治疗也正式宣告进入靶向疗法时代。

图片来源:123RF
有趣的是,这些靶向疗法的早期临床结果显得“参差不齐”。比如在NSCLC患者的生存收益上,gefitinib作为二线疗法所带来的中位总生存期(OS)为5.6个月,与对照组的5.1个月并没有显著区别。但用现在的观点看,这实际上反映了准确进行患者细分的重要性。回溯来看,EGFR基因拷贝数较高的患者,其缓解率为37.5%,明显高于对照组的2.6%。而对于明确有EGFR基因突变的患者,其无进展生存期(PFS)与客观缓解率(ORR)也要显著高于化疗对照组。Erlotinib也同样取得了类似的治疗结果。
为了提高疗效,新药研发人员们随即开发出了第二代EGFR抑制剂,Gilotrif(afatinib)与Vizimpro(dacomitinib)就是其中的代表。与第一代EGFR抑制剂不同,这些药物能不可逆地结合靶点,因此有望更强力地对其进行抑制。在PFS上,它们也的确展现出了更优的疗效。以2018年获批的dacomitinib为例,其为患者带来的中位PFS为14.7个月,而一代抑制剂的数据为9.2个月。
不过第一代和第二代EGFR抑制剂,都面临了同样的耐药性问题——据估计,在接受EGFR抑制剂治疗后,大约50%的患者会出现EGFR T790M突变,导致药物失效。面对这一难题,阿斯利康带来了第三代EGFR抑制剂Tagrisso(osimertinib):在携带EGFR突变的初治患者群体中,这款疗法的中位PFS为18.9个月,几乎是第一代EGFR抑制剂数据的2倍(10.2个月)。随后,更多新一代EGFR抑制剂获批上市,其中包括强生公司的Lazcluze(lazertinib)和武田的Exkivity(mobocertinib)。迪哲医药开发的Zegfrovy(sunvozertinib)在今年7月获批,用于治疗携带EGFR第20号外显子插入突变的局部晚期或转移性NSCLC成人患者。其它获批EGFR抑制剂包括倍而达药业的瑞齐替尼、圣和药业的瑞厄替尼、晨泰医药与阿斯利康联合开发的佐利替尼、贝达药业开发的贝福替尼、翰森制药的阿美替尼、奥赛康药业和信达生物联合开发的利厄替尼等。
百花齐放的新时代
EGFR抑制剂只是靶向疗法时代的一个开端。随着人类对肺癌病理的不断探索,越来越多的创新疗法逐渐浮出水面,针对不同的病因进行精准治疗。
譬如在非小细胞肺癌中,大约有5%的患者带有ALK基因重排变异。这一比例虽然不高,但却多发于不抽烟的患者。在他们体内,异常的ALK蛋白会导致细胞不断生长,诱发肺癌。面对这一突变,新药研发人员们同样带来了多代不同的疗法:辉瑞的Xalkori(crizotinib);诺华的Zykadia(ceritinib),罗氏的Alecensa(alectinib),武田的Alunbrig(brigatinib);以及辉瑞的Lorbrena(lorlatinib),就分别属于三代不同的ALK抑制剂。以Lorbrena(lorlatinib)为例,它不仅能治疗对其他ALK抑制剂产生耐药的患者,还可以穿越血脑屏障。去年在美国临床肿瘤学会(ASCO)年会上公布的3期临床试验长期随访结果显示,与第一代ALK抑制剂相比,它将患者的疾病进展或死亡风险降低了81%。而且,患者的颅内疾病进展风险降低94%。此外,贝达药业的Ensacove(ensartinib)在2024年获得FDA的批准。其它获批ALK抑制剂包括正大天晴的依奉阿克、齐鲁制药的伊鲁阿克等。
在另一些约占总数3%的肺癌患者中,会出现BRAF基因变异。由诺华带来的Tafinlar(dabrafenib)和Mekinist(trametinib)联合疗法也已于2017年获批,治疗带有BRAF V600E突变的癌症患者。在这一患者群体中,该联合疗法的缓解率可超过60%。辉瑞公司的Braftovi(encorafenib)与Mektovi(binimetinib)组合疗法在2023年获得FDA批准,治疗同一患者群体。

图片来源:123RF
RET基因融合是非小细胞肺癌的驱动基因变异类型之一,约发生在1%-2%的非小细胞肺癌患者中。针对这一靶点,礼来公司的Retevmo(selpercatinib)和Blueprint Medicines(现已被赛诺菲收购)开发的Gavreto(pralsetinib)在2020年双双获批。
针对ROS1阳性NSCLC,罗氏开发的Rozlytrek(entrectinib)、百时美施贵宝的Augtyro(repotrectinib)和Nuvation Bio公司的Ibtrozi(taletrectinib)为患者提供了更多精准治疗的选择。其它获批药物包括正大天晴的安奈克替尼、信达生物和葆元医药联合开发的他雷替尼等。
对携带MET基因突变的晚期NSCLC患者来说,德国默克开发的Tepmetko(tepotinib)是全球首款获批的MET抑制剂。诺华的Tabrecta(capmatinib)也已经获得FDA的批准。其它获批MET抑制剂包括海和药物开发的谷美替尼、浦润奥生物的伯瑞替尼等。
肺癌靶向治疗的进展也体现了医药行业在靶向“不可成药”靶点方面的突破,例如KRAS曾经是著名的“不可成药”靶点,KRAS基因突变在大约25%的NSCLC患者中出现,13%的患者携带KRAS G12C突变。在2021年和2022年,两款靶向KRAS G12C的特异性抑制剂Lumakras(sotorasib)和Krazati(adagrasib)先后获批上市,为携带这一突变的肺癌患者提供了针对性的靶向疗法。其它获批的KRAS G12C抑制剂包括劲方医药和信达生物联合开发的氟泽雷塞、益方生物与正大天晴合作开发的格索雷塞、艾力斯医药和加科思联合开发的戈来雷塞等。
免疫疗法也在肺癌治疗上大展身手。其中,百时美施贵宝的Opdivo(nivolumab)和Yervoy(ipilimumab)、默沙东的Keytruda(pembrolizumab)、罗氏的Tecentriq(atezolizumab)、再生元的Libtayo(cemiplimab)以及阿斯利康的Imfinzi(durvalumab)和Imjudo(tremelimumab)均已获批治疗非小细胞肺癌。ASCO官方新闻稿曾指出,在免疫疗法问世前,晚期非小细胞肺癌患者的5年平均生存率仅为5.5%。而在免疫疗法的治疗下,患者的5年总生存率可达18%,堪称是历史性的突破。其它获批治疗肺癌的免疫检查点抑制剂包括君实生物的特瑞普利单抗、康方生物和正大天晴开发的派安普利单抗和百济神州的替雷利珠单抗等。
值得一提的是,在传统的小分子药物和抗体药物之外,创新治疗模式也在肺癌治疗领域崭露头角,已有多款抗体偶联药物(ADC)和双特异性抗体获批用于治疗肺癌。在抗体偶联药物方面,阿斯利康和第一三共联合开发的Enhertu(trastuzumab
deruxtecan)在2022年获得FDA批准,成为首个治疗携带HER2突变的经治转移性NSCLC患者的HER2靶向疗法。艾伯维开发的c-Met靶向抗体偶联药物Emrelis(telisotuzumab
vedotin)和阿斯利康与第一三共合作开发的TROP2靶向ADC Datroway(datopotamab
deruxtecan)均在2025年获美国FDA批准治疗非小细胞肺癌。其它获批治疗肺癌的ADC包括科伦博泰的芦康沙妥珠单抗等。
在双特异性抗体领域,强生公司靶向EGFR和MET的Rybrevant(amivantamab),Merus公司靶向HER2和HER3的Bizengri(zenocutuzumab),安进公司的Imdelltra(tarlatamab),以及康方生物与Summit Therapeutics联合开发的依沃西(ivonescimab)均已获得监管机构批准,治疗特定NSCLC患者。这些疗法的出现,为肺癌患者提供了更为丰富和具有针对性的治疗手段。
一体化平台赋能肺癌新药开发
长期以来,药明康德都在支持全球合作伙伴从药物研究(R)、开发(D)到商业化生产(M)各个阶段的需求,通过独特的一体化、端到端CRDMO模式,助力突破性疗法加速研发进程、早日惠及患者。
在早期研发阶段,药明康德可助力肺癌靶向药物从药物发现、CMC及制剂、药理药效、药代毒理、IND申请到获得临床试验批件的全过程推进。例如,针对脑转移,药明康德生物学业务平台已建立多种肺癌脑转移动物模型,包括基于颈内动脉注射的模型,可更真实地模拟肿瘤细胞穿越血脑屏障的生物学过程,为药物脑部疗效评价提供坚实基础。
在后续开发阶段,药明康德建立了全面的能力,构建起了从科学探索到临床转化的加速路径,显著降低了合作伙伴的开发周期,提高了研发效率。例如,药明康德测试业务平台可为合作伙伴提供全面、专业、系统的生物分析解决方案,助力合作伙伴的药物成功申报IND、NDA和BLA。该平台还能为合作伙伴的药品提供全方位的临床研究服务,涵盖生物等效性(BE)/1期至4期的临床试验及真实世界研究。
合作伙伴对药明康德的工作也给予了高度评价,曾领导一款KRAS抑制剂开发的原Mirati Therapeutics高级副总裁,药物发现负责人Matt Marx博士表示,“药明康德是我们合作时间最长的合作伙伴之一,我们与药明康德的化学、DMPK、毒理学、癌症生物学和结构生物学团队紧密合作。”他补充道:“药明康德团队一直是一个稳定、高效且富有成效的合作伙伴,在我们努力为癌症患者创造有意义新疗法的过程中,我们深深感谢他们在其中的支持。”
从曾经的罕见病,到全球最为严重的癌症负担;从曾经的至暗时刻,到如今的百花齐放,肺癌的治疗格局正在被持续重塑。过去的100年里,人类对肺癌的认识有了翻天覆地的变化,也为无数患者带来了全新的希望。通过避免接触风险因子(如烟草),选择早期筛查,以及使用创新疗法,肺癌在过去的几十年里,无论是发病率,还是死亡率,均有着明显的下降趋势。在本文的最后,我们向所有改变肺癌治疗的英雄们致敬!药明康德也期待与业界的各位同仁一道携手共进,早日让肺癌变得不再可怕!

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 61
61

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 63
63

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 63
63