 产业资讯
产业资讯
 识林
识林  2025-08-08
2025-08-08
 400
400

FDA在2026财年将收取的处方药用户费用(PDUFA VII)增长8.6%。这一增长主要源于FDA预计接收的原始申请数量增加,但与申办方的会议次数减少。
FDA采用多种公式设定用户费用,其估算过程需平衡诸多因素。FDA预计药品审评与研究中心(CDER)将接收127份原始新药上市申请(NDA)或生物制品许可申请(BLA),相较于2024财年接收的115份有所增加。另一方面,尽管申请量上升,CDER预计与申办方的会议次数(包括书面回复)将从2024财年的4028次减少至2026财年的3843次。
与此同时,生物制品审评与研究中心(CBER)预计会议次数将从2024财年的923次增加至1001次,申请数量也将从12份增加至13份。但从总数看,FDA整体会议数量仍呈下降态势。
自特朗普政府上台以来,FDA因人员裁减和离职问题(就在7月29日,又一位CBER主任被迫离职),其履行用户费用项目下的会议及其他审评要求的能力受到质疑,部分肿瘤审评部门人员短缺问题较为突出。此外,由于卫生部(HHS)部长小肯尼迪对用户费用机制(UFA)持质疑态度,认为其使FDA过于依赖企业,引发业界对于下一期用户费用续签进程的担忧。
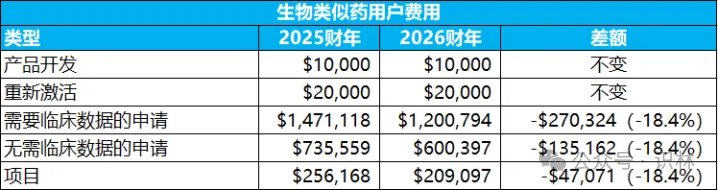
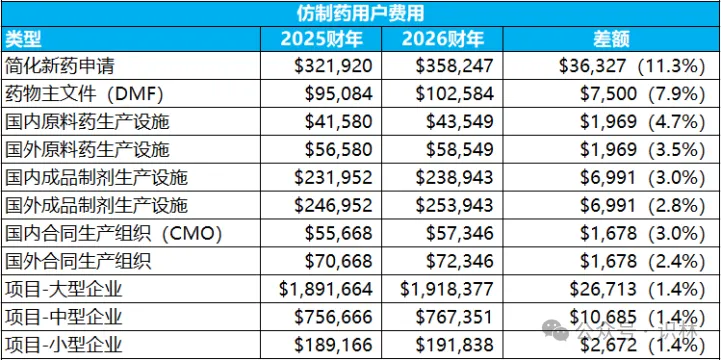
新药费用整体上浮,仿制药申请(ANDA)和原料药药物主文件(DMF)也涨了不少,分别是11.3%和7.9%,但生物类似药各项费用或者不变,或者大幅下降18.4%,其背景也许是生物类似药竞争和替代仍然不足,而FDA(以及各国药监)都在想方设法给申办方减负。
多个UFA面临新的谈判,识林曾报道PDUFA VIII和GDUFA IV的启动会已经召开。FDA目前表露出的倾向是可能减少收费,从而降低所谓的“企业影响”,但也有苗头是针对外国企业收取更多费用,从而促进所谓“制造业回流”。
2026财年具体费用(与2025财年对比)如下,供出海企业读者参考:


 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 573
573

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 581
581

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 557
557