 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-08-14
2025-08-14
 191
191
CTLA-4这个靶点可能有巨大的预期差。CTLA-4是最早被研究的免疫检查点之一,其相关单抗也是最早上市的免疫检查点相关单抗,要比PD-(L)1相关单抗早一些年头。
但是随着BMS的Y药(伊匹木单抗)上市,这个靶点的单抗便沉寂了十余年之久,一直到阿斯利康的替西木单抗上市才打破了Y药独占该靶点十余年的局面。而随后,随着康方AK104火箭般速度上市,该靶点便早早进入了双抗时代。
这个靶点远没有PD-1这么顺风顺水,也就是说在它身上还有比较大的预期差。在这个时代里,也许可以在双抗身上找一些该靶点的机会,但是,单抗时代里一些联用的经验教训,也有值得我们吸收借鉴的地方。
我们看到其实在双抗甚至三抗的在研管线,CTLA-4有机会发光发热。
01
CTLA-4靶点本身与Y药
CTLA-4又称为CD152,是活化T细胞表面的一种受体。1987年,Brunet等人通过筛选小鼠溶细胞性T细胞衍生的cDNA文库发现了该受体。
在免疫过程之中,我们之间曾经有写到过T细胞的活化依赖于TCR与APC的MHC呈递的特定抗原的结合。然而,这种识别,即第一个T细胞活化信号,不足以引起T细胞活化,要完全激活T细胞,需要第二个激活信号,也就是我们常说的共刺激信号。该信号由T 细胞的可诱导CD28受体提供,该受体与活化的专职APC上的配体B7结合。
那么CTLA-4和这些又有什么关系呢?它与CD28是竞争关系,竞争结合APC上的B7,并且关于二者亲和力方面的研究表明,CTLA-4受体与B7配体(CD80/CD86)的结合亲和力更高,且表面密度更低,因此在与B7配体的结合方面胜过CD28受体。因此,在存在CTLA-4受体的情况下,如果缺乏二次活化信号,则会导致T细胞无法活化。此外,CTLA-4受体还被证实能将B7配体从APC表面隔离,导致其表面配体显著耗竭。
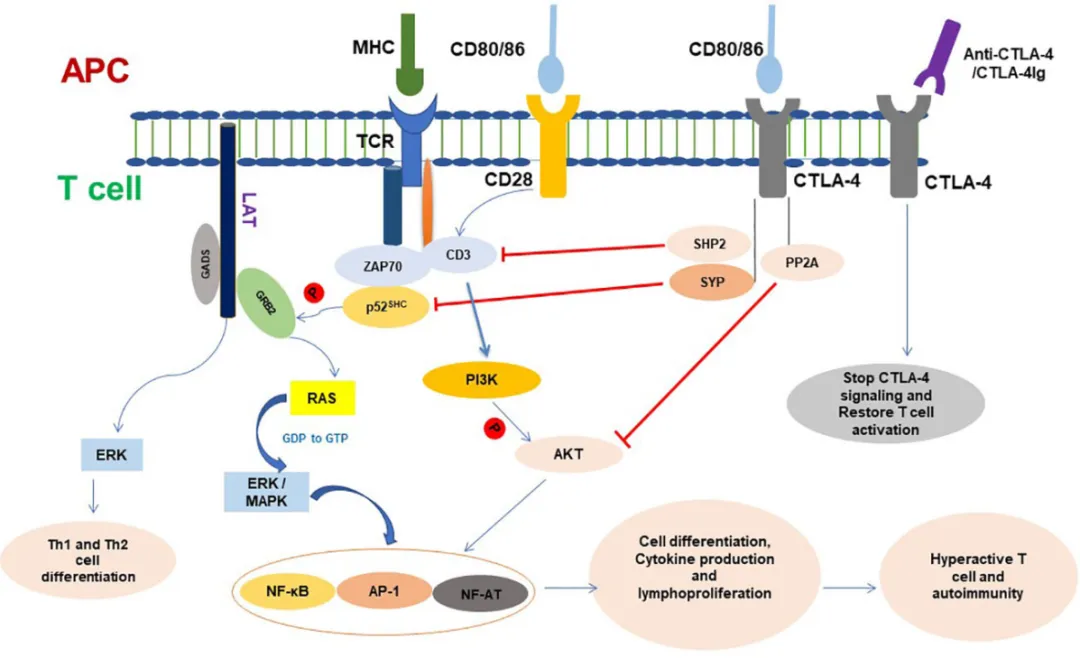
(图源:Current understanding of CTLA-4: from mechanism to autoimmune
diseases)
从这个角度来说,对于癌症患者而言,显然CTLA-4越多,对于癌症患者免疫系统活化越不利,要想办法抑制CTLA-4发挥它的功效。于是,就诞生了CTLA-4相关的单抗。
首先必须要提到的自然是CTLA-4单抗的首秀——伊匹木单抗。它由诺贝尔奖获得者James P. Allison发明,年代要追溯到上世纪九十年代(推荐一篇文章《Ipilimumab: A tale of twists and turns》),它的临床应用专利被授权给当时的一家小公司NeXstar Pharmaceuticals,后来辗转吉利德,Medarex(Medarex中间还与辉瑞签署过共同开发伊匹木单抗的协议),最后才来到BMS的手中(2009年BMS收购Medarex),在2011年该药物才修成正果获得FDA批准。
临床试验中的过程也是一波三折。如果采用传统研发方式,即基于RECIST标准评估疗效,那么将会面临一个问题:由于T细胞浸润至肿瘤细胞,这在放射学检查中将会显示为肿瘤体积增大,根据RECIST 标准,这可被视为疾病进展,患者将无法继续参与试验。因此需要密切注视患者进展,直到能够评估无进展生存期为止。
具体的三期临床参见文献《Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant Therapy》,患者接受III期皮肤黑色素瘤完全切除术后,我们将其随机分配接受伊匹木单抗(剂量为10 mg/kg,475例)或安慰剂(476例),每3周给药一次,共给药4次,之后每3个月给药一次,最长给药3年,或直至出现疾病复发或不可接受的毒性作用。无复发生存期为主要终点。
临床最后结果上,伊匹木单抗组5年无复发生存率为40.8%,安慰剂组为30.3%;伊匹木单抗组5年总生存率为65.4%,安慰剂组为54.4%。
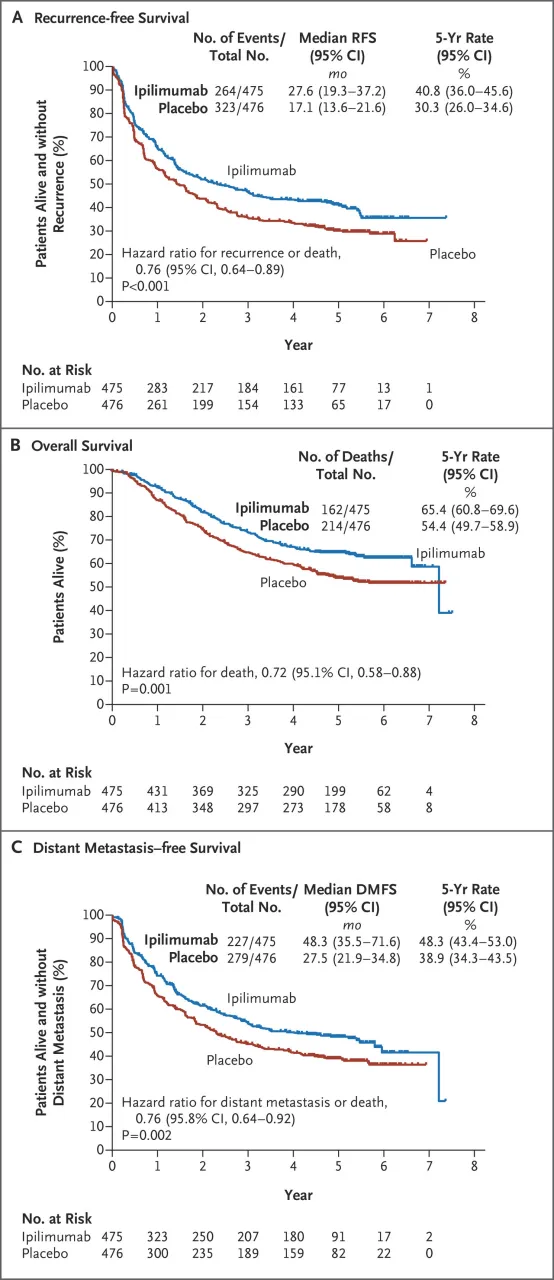
(图源:《Prolonged Survival in Stage III Melanoma with Ipilimumab Adjuvant
Therapy》)
伊匹木单抗的缘起,大致如此。
02
PD-1单抗的带动
可以这么说,PD-1单抗,或者更确切的说是O药,给了伊匹木单抗新的生命。我们今天看伊匹木单抗获批的适应症,除了第一个适应症是单药之外,剩下的适应症全部是和O药联用的。
疗效和安全性方面我们以最常见的癌症NSCLC进行对比,它的三期临床试验为CheckMate
-227。正好该试验是一线治疗NSCLC,基本不用去对比患者基线。对于PD-L1表达水平≥1%的患者,纳武利尤单抗联合伊匹单抗治疗组的OS为17.1个月,化疗组为14.9个月,OS的HR为0.79,算是验证出了疗效。
安全性如下表所示,在纳武利尤单抗联合伊匹木单抗治疗组和化疗组中,研究者确定与试验治疗相关的3级或4级不良事件的发生率相似(32.8% vs. 36.0%)。纳武利尤单抗联合伊匹木单抗治疗中,任何级别的治疗相关严重不良事件的发生率均高于化疗组(24.5% vs. 13.9%),导致停药的治疗相关不良事件的发生率也高于化疗组(18.1% vs. 9.1%)。
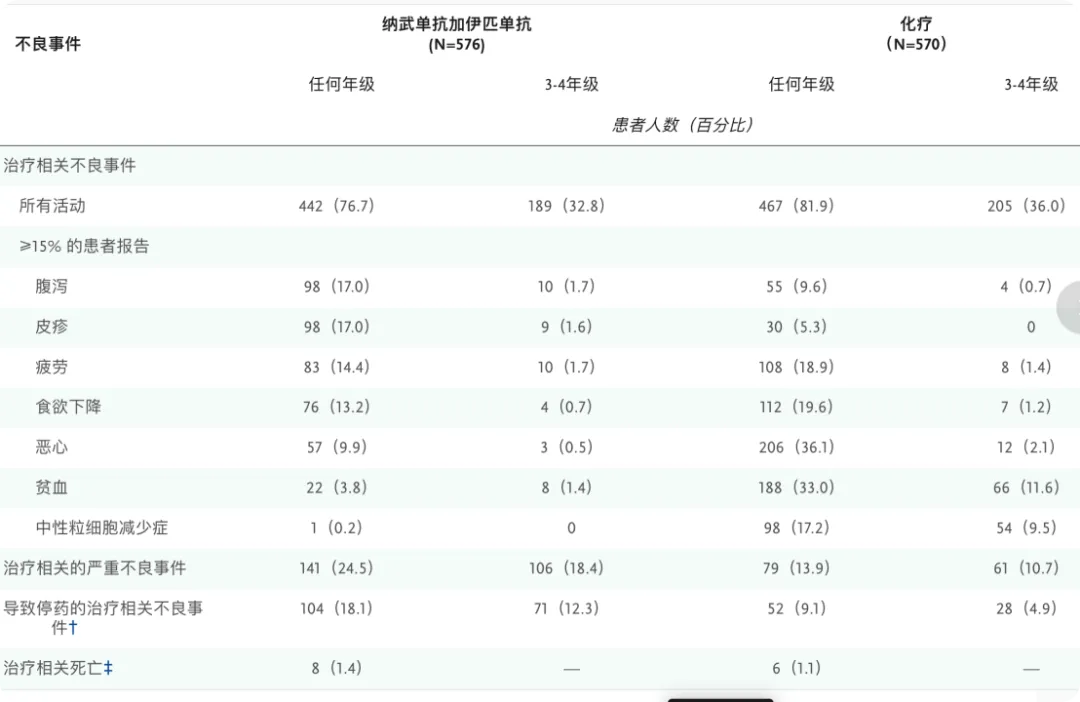
如今有些文章提到两药联用导致的安全性问题,但其实这个安全性我们今天来看,3级、4级TRAE上和化疗的安全性差不了太多。但这个OS数据看起来却比较擦边,似乎获益不算特别显著。那么我们再对比K药的一线治疗NSCLC的OS数据,K药在TPS≥1的人群中,三期试验的中位OS为16.4个月,HR同样为0.79。似乎O药联合伊匹木单抗才能达到K药单药的效果,而K药现在常见的疗法是联合化疗。
必须要和O药捆绑使用+OS获益并不算显著,或许是伊匹木单抗销售额一直不温不火的主要原因。2024年,它的销售额在25亿美元左右。或许在这之后的方向上,提高疗效仍然是一大重要问题。
03
新的可能性
当然,现在到了双抗时代,一些伊匹木单抗刚刚上市或者还没上市的时候,CTLA-4的双抗便已经迫不及待在占领市场了。其中跑得最快的自然是康方的AK104。
首先值得一提的是COMPASSION-15,AK104联合化疗一线治疗胃癌,AK104单抗+化疗组 vs 安慰剂+化疗组的中位PFS是7个月vs 5.3个月,中位OS是14.1个月vs 11.1个月,ORR是65.2% vs 48.9%,中位DOR是8.8个月vs 4.4个月。其中PFS和ORR的显著差异性自然肉眼可见,最为重要的是卡度尼利在OS上也做出了显著的差异性:HR达到了0.66,不再是之前HR在0.8左右徘徊的擦边状态。
然后是COMPASSION-16,AK104联合化疗联合贝伐珠单抗对比化疗联合贝伐珠单抗一线治疗宫颈癌。在全人群中,加用卡度尼利单抗后,12月OS率从73.7%提高至83.1%,24月OS率从48.4%提高至62.6%,AK104可显著降低36%的死亡风险。HR再一次小于0.7。
AK104告诉了我们真正的好药应该是什么样子。
之后的PD-(L)1×CTLA-4双抗和三抗还有好几条,这里就不一一列举了。并且有一个很重要的点,目前虽然PD-1×VEGF双抗BD交易炒的火热,但是PD-1×CTLA-4双抗却一直不温不火,康方自己在电话会中也表示不排除AK104借船出海的可能性,并且也欢迎合作伙伴去联系,这使得AK104出爆款交易成为了可能。
当然,目前还只是可能的状态。目前我们去看这个双抗乃至三抗,绝大部分原因是拓展PD-1×VEGF双抗之外的可能性,从目前AK104的情况去看,该双抗是有非常大的潜力的。虽然伊匹木单抗不温不火,但是也许在CTLA-4双抗上能够杀出黑马也说不定。
除了PD-1×CTLA-4双抗/三抗之外,还有一些biotech在伊匹木单抗的基础上开发新一代的单抗,这是另外的一大趋势。最为典型的是和铂医药的HBM4003,与已经上市的药物ipilimumab相比HBM4003具有以下优点:1)具有更小的分子量(76 kDa),因此具有更好的渗透性;2)通过Fc突变使抗体更强的ADCC效应,增强对Treg细胞的清除;3)较短的半衰期,减少药物的系统性的暴露时间,从而减少副作用;4)可以持续的清除Treg细胞,可以潜在的减少用药频率,减少副作用。除此之外,BioNTech也曾经买下了CTLA-4单抗——ONC-392,预付款达到2亿美金。
结语:通过今天的资料搜集与拆解,笔者颠覆了以前的看法。以前笔者认为CTLA-4单抗不温不火主要是安全性导致的,现在看来主要还是市场竞争太激烈加上疗效上没有明显的优势所导致的。K药的疗效优势确实非常惊艳。而未来,就将让CTLA-4双抗们接棒了。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 547
547

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 551
551

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 529
529